Актуальность. Методы деривации мочи после оперативного удаления мочевого пузыря разнообразны. Создание ортотопического мочевого пузыря признается методом, обеспечивающим наилучшее качество жизни пациента после цистэктомии [1, 2]. В отсутствие возможности сформировать неоцист прибегают к различным методам деривации мочи – уретерокутанеостомии, созданию влажной уростомы (операция Брикера), уретеросигмостомии. Метод имплантации мочеточников в сигмовидную кишку технически менее сложен и ранее широко применялся (впервые данная операция была выполнена J. Simon в 1852 г. по поводу экстрофии мочевого пузыря 13-летнему мальчику [3]), но уже с 1930-х гг. в литературе систематически начали появляться сообщения о повышении риска развития рака толстой кишки после уретеросигмостомии [4].
У таких пациентов рак ободочной кишки развивается в молодом трудоспособном возрасте, поэтому профилактика, диагностика и лечение колоректального рака в этой группе пациентов – скорее медицинская, социальная и экономическая проблема.
 Представляем собственное клиническое наблюдение.
Представляем собственное клиническое наблюдение.
Пациент Б. родился с экстрофией мочевого пузыря, гипоспадией. В период с рождения и до 3 лет пациенту проведены операции: 1) пластика мочевого пузыря, 2) пластика полового члена, 3) экстирпация мочевого пузыря, уретеросигмостомия.
Находился под наблюдением уролога. Периодические исследования толстой кишки с использованием видеоэндоскопических технологий, тест на скрытую кровь в кале, а также ирригоскопия в течение всего послеоперационного периода не выполнялись.
В декабре 2016 г. у пациента появились симптомы острого обструктивного пиелонефрита, в связи с чем он был госпитализирован в профильное урологическое отделение. При МСКТ органов брюшной полости выявлены конкременты в нижней трети правого мочеточника, уретерогидронефроз справа. Выполнена пункционная нефростомия справа.
После нормализации клинико-лабораторных показателей проведена антеградная гибкая уретеролитотрипсия, в ходе которой при ревизии дистальной трети и устья правого мочеточника выявлено образование сигмовидной кишки в зоне имплантации мочеточников. При видеоколоноскопии данное образование идентифицировано как рак дистальной трети сигмовидной кишки. Из протокола видеоколоноскопии: визуализируются 2 опухоли в местах имплантации мочеточников в толстую кишку (рис. 1).
Результат гистологического исследования биопсийного материала: аденокарцинома.
 Опираясь на данные проведенных исследований, пациенту установлен клинический диагноз: рак сигмовидной кишки сT2(m)N1M0 III стадии.
Опираясь на данные проведенных исследований, пациенту установлен клинический диагноз: рак сигмовидной кишки сT2(m)N1M0 III стадии.
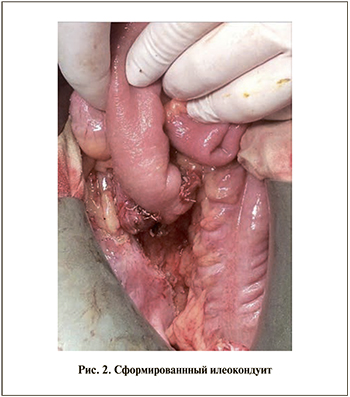
В отделении колопроктологии выполнена передняя резекция прямой кишки с D-3-лимфодиссекцией, формированием сигморектального анастомоза, формированием уретероилеоанастомоза (рис. 2).
Формирование илеокондуита в качестве метода деривации мочи было обусловлено следующими факторами: 1) отсутствие возможности использования уретры для отведения мочи, 2) отсутствие у пациента сформированного рефлекса мочеиспускания.
Длительность операции составила 350 мин. Оперативный доступ: срединная лапаротомия. Кровопотеря не превысила 100 мл. Из технических сложностей необходимо отметить наличие спаек в малом тазу. Интраоперационных осложнений не было.Течение раннего послеоперационного периода осложнилось длительным парезом кишечника, который разрешился на 10-е сутки после операции. Дренажи из малого таза удалены на 10-е и 11-е сутки. Нефростома перекрыта на 4-е сутки после операции, удалена – на 18-е сутки. Мочеточниковые стенты удалены на 24-е сутки после операции.
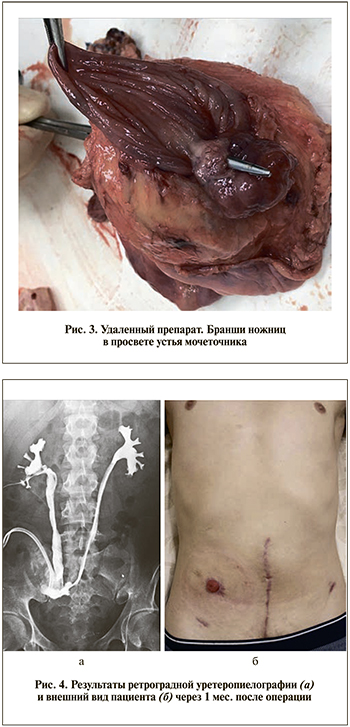
Гистологическое заключение: муцинозная аденокарцинома (G3) толстой кишки с инвазией в мышечный слой стенки кишки. pT2N0 (рис. 3).
Проведения адъювантной химиотерапия в послеоперационном периоде не показано.
В послеоперационном периоде пациент наблюдается по программе мониторинга, срок наблюдения – 11 мес. Признаков рецидива или отдаленных метастазов не выявлено (рис. 4).
 Обсуждение. Существует несколько гипотез, описывающих патофизиологические механизмы формирования рака толстой кишки у пациентов с деривацией мочи в толстую кишку [5, 6], но полностью процесс формирования опухолей остается не до конца изученным [7]. Одна из теорий описывает влияние нитритов и нитрозаминов на микрофлору кишечника и на изменение кислотности содержимого кишечника, что в свою очередь повышает риск развития опухолей. Другая теория объясняет повреждение ДНК эпителия кишечника образованием массы свободных радикалов в результате неконтролируемого воспалительного ответа со стороны иммунной системы [5, 8]. При этом большинство авторов сходятся во мнении, будто возникновение вторичной опухоли в зоне уретеросигмоанастомоза – вопрос времени. Так, анализ статистических данных двух германских регионов показал, что риск возникновения вторичных опухолей у пациентов с уретеросигмоанастомозами в возрастной группе 55–60 лет выше в 8 раз по сравнению с риском развития опухоли толстой кишки в общей популяции; а для возрастной группы 25–30 лет этот риск возрастает более чем в 500 раз [9]. По данным [10], риск развития рака толстой кишки в рассматриваемой группе пациентов в 100 раз выше, чем в популяции в целом, при этом характерно наличие латентного периода, предшествовавшего развитию злокачественной опухоли, который составляет в среднем 20–30 лет.
Обсуждение. Существует несколько гипотез, описывающих патофизиологические механизмы формирования рака толстой кишки у пациентов с деривацией мочи в толстую кишку [5, 6], но полностью процесс формирования опухолей остается не до конца изученным [7]. Одна из теорий описывает влияние нитритов и нитрозаминов на микрофлору кишечника и на изменение кислотности содержимого кишечника, что в свою очередь повышает риск развития опухолей. Другая теория объясняет повреждение ДНК эпителия кишечника образованием массы свободных радикалов в результате неконтролируемого воспалительного ответа со стороны иммунной системы [5, 8]. При этом большинство авторов сходятся во мнении, будто возникновение вторичной опухоли в зоне уретеросигмоанастомоза – вопрос времени. Так, анализ статистических данных двух германских регионов показал, что риск возникновения вторичных опухолей у пациентов с уретеросигмоанастомозами в возрастной группе 55–60 лет выше в 8 раз по сравнению с риском развития опухоли толстой кишки в общей популяции; а для возрастной группы 25–30 лет этот риск возрастает более чем в 500 раз [9]. По данным [10], риск развития рака толстой кишки в рассматриваемой группе пациентов в 100 раз выше, чем в популяции в целом, при этом характерно наличие латентного периода, предшествовавшего развитию злокачественной опухоли, который составляет в среднем 20–30 лет.
Формирование неоплазии в толстой кишке в раннем возрасте в отсутствие генетической предрасположенности говорит о значительной роли наличия уретеросигмоанастомоза как фактора риска развития опухоли толстой кишки. Предполагается, что рак возникает на границе слизистой оболочки толстой кишки и переходного эпителия мочеточников под воздействием химических веществ, появляющихся в просвете кишки после смешения каловых масс и мочи [11]. С одной стороны, в результате взаимодействия кала и мочи продуцируются химические агенты канцерогенеза, такие как N-нитрозосоединения, с другой – в зоне уретеросигмоанастомоза может длительное время сохраняться воспалительный процесс, который также способствует развитию опухолей [11–13]. В связи с высоким риском развития опухолей у пациентов с уретеросигмоанастомозами значительное количество людей данной группы были повторно оперированы с использованием других способов деривации мочи. Однако спустя определенный отрезок времени у части пациентов все равно развивались опухоли толстой кишки. Известен случай развития аденокарциномы толстой кишки у пациента, которому первично был сформирован уретеросигмоанастомоз, конвертированный спустя 8 мес. в илеокондуит [7]. По данным литературы [11–13], это служит следствием того, что достаточно незначительного по длительности раздражающего воздействия продуктов азотистого обмена на слизистую оболочку толстой кишки для развития в ней неоплазии.
В России первая имплантация мочеточников в сигмовидную кишку осуществлена в Киеве профессором Ф. А. Рейном в 1894 г., но закончилась она летальным исходом [14]. В дальнейшем в России продолжался поиск и развитие различных видов кишечной континентной деривации мочи, что объясняется несовершенством существующих методов и ростом числа пациентов, которым показано замещение мочевого пузыря при различных его заболеваниях (травмы, рак мочевого пузыря, экстрофия мочевого пузыря, интерстициальный цистит, сморщенный мочевой пузырь, нейрогенный мочевой пузырь и др.). В связи с простой техникой выполнения операция уретеросигмостомии не потеряла актуальности в России и странах СНГ по настоящее время [15]. При этом пациенты, которым осуществлена операция с отведением мочи в толстую кишку, должны быть в полной степени проинформированы о повышенном риске развития рака толстой кишки. Кроме того, им должна быть предложена адекватная программа мониторинга, которая обязательно должна включать анализ кала на скрытую кровь, микроскопию мочи, колоноскопию [16].
Мониторинг пациентов, у которых деривация мочи осуществляется в толстую кишку, в том числе после уретеросигмостомии, необходим для ранней диагностики рака толстой кишки [17, 18]. Позднее выявление рака толстой кишки у пациентов данной группы резко повышает смертность [12]. A. Zabbo и соавт. [18] показали, что большинство пациентов не знали о повышенном риске развития рака, связанном с использованием сегментов толстой кишки для реконструкции мочеотведения.
Установлено, что [19] после уретеросигмостомии, выполненной по поводу состояний, не связанных с онкологическими заболеваниями (экстрофия мочевого пузыря у детей), латентный период развития карциномы толстой кишки составляет от 10 до 40 лет с медианой в 22 года. В то же время, если оперативное вмешательство было выполнено по поводу рака мочевого пузыря, латентный период в среднем составляет 7 лет [19].
Сохраняется спор и относительно времени начала мониторинга, и относительно частоты использования эндоскопических методов исследования. Одни авторы [20, 21] считают, что первую колоноскопию необходимо проводить не позже 5 лет со дня операции, в то время как другие [22] рекомендуют начинать скрининг через 12 лет после оперативного лечения. Ассоциация колопроктологов Великобритании и Ирландии рекомендуют проведение скрининга не позднее 10 лет после проведения операции уретеросигмостомии [23].
В комплексном исследовании [24] авторы делают заключение о необходимости наблюдения вскоре после операции, так как: 1) неоплазия, включая аденоматозные полипы, может возникнуть спустя 2 года; 2) риск развития рака возникает сразу после операции; 3) имеются данные о раннем возникновении толстокишечного рака после операции уретеросигмостомии. Согласно данным [25], латентный период до появления вторичных опухолей составляет 4–34 года, что говорит о необходимости более раннего проведения мониторинга подобных пациентов. В описанном нами наблюдении опухоль толстой кишки выявлена через 18 лет после уретеросигмостомии.
Ежегодный осмотр после уретеросигмостомии рекомендован большинством авторов [21, 24, 26]. Риск развития рака не уменьшается с течением времени – наиболее позднее развитие рака зафиксировано спустя 55 лет после операции с деривацией мочи в сигмовидную кишку [27], в связи с чем мониторинг необходимо проводить в течение всей жизни пациента.
Заключение. Пациенты, перенесшие уретеросигмостомию, нуждаются в периодических медицинских осмотрах, включающих в том числе проведение видеоэндоскопических методов исследования толстой кишки, ультрасонографии органов брюшной полости.



