Введение. Многочисленные работы последних лет подтверждают существование для многих типов опухолей субпопуляции раковых стволовых клеток (РСК), способных давать начало всем субклонам опухолевых клеток. Экспериментальным путем доказано, что РСК обладают способностью к асимметричному делению, в результате которого возникает одна клетка-реплика исходной клетки и одна клетка, утрачивающая способность делиться асимметрично, но обладающая неконтролируемым пролиферативным потенциалом. Как РСК, так и их потомство характеризуются генетическими аберрациями [1–4].
Недавно двум группам ученых удалось выделить и охарактеризовать РСК мочевого пузыря, которые имеют сходство с базальными клетками уротелия по профилю экспрессии. Предполагается, что в уротелиальных карциномах (УК) вертикальная линейная иерархия опухолевых кластеров имитирует цитоархитектонику нормального уротелия [5–8]. Вместе с тем L. H. Philip et al. при повторных пассажах изолированных раковых клеток обнаружили, что опухолевые клетки люминального фенотипа (CD44-CK5/6-CD20+), выделенные из фракции предполагаемых РСК с базальным фенотипом (CD44+CK5/6+CD20-), в отличие от последних не способны к самообновлению и инициации [9–13]. Таким образом, приведенные выше результаты исследования показывают, что фундаментальный вопрос о происхождении РСК люминальных УК в настоящее время остается открытым. Пока не получено убедительных свидетельств, определяющих, происходят ли эти события в одной клетке, предположительно базальной, или осуществляются в разных клетках-предшественниках уротелия [14–16]? В настоящее время изучаются возможности ряда потенциальных стволовых маркеров в качестве РСК в УК и их прогностическая значимость [17–21].
Цель настоящего исследования: провести сравнительную оценку экспрессии стволовых маркеров ALDH1A1, CXCR4, CD24, CD82, CD105, CD133, NANOG, OCT4 и SOX-2 в молекулярных подтипах УК. Определить связь между характером экспрессии и морфологическими параметрами опухоли.
Материалы и методы. Объектом исследования послужил архивный биологический и текущий биопсийный материалы от 99 больных (62 мужчины и 37 женщин) в возрасте от 51 года до 89 лет (средний возраст – 66,9 года), проходивших хирургическое лечение в урологической клинике ПМГМУ им. И. М. Сеченова и урологическом центре научного клинического центра (НКЦ) ОАО РЖД по поводу уротелиального рака почечной лоханки в период с 2011 по 2017 г.
Для сравнения были изучены биоптаты 97 пациентов (65 мужчин и 32 женщины) в возрасте от 33 до 84 лет (средний возраст – 65,4 года) с уротелиальным раком мочевого пузыря, проходивших лечение в урологическом центре НКЦ ОАО РЖД с 2010 по 2017 г.

Гистологическое исследование. Все новообразования распределены по соответствующим группам на основании последней гистологической классификации опухолей мочевыделительной системы (ВОЗ, 2016) с изменениями. Степень клеточной анаплазии (G) оценивали по шкале от 1 до 4 по L. Cheng et al. [22]. Уровень инвазии (рТа–Т4) определяли согласно протоколу 7-го издания TNM-классификации опухолей мочевыделительной системы (МВС) [23].
Иммуногистохимическое (ИГХ) исследование. Все новообразования классифицировали по молекулярным группам согласно последней классификации Атласа ракового генома [24]. Серийные срезы толщиной 5 мкм депарафинировали и регидратировали по стандартной методике. Для «демаскировки» антигенов срезы подвергали высокотемпературной обработке в цитратном буфере и инкубировали 5 мин с 3%-ным раствором перекиси водорода (для каждого антитела в соответствии с рекомендуемым протоколом). Перечень использованных антител приведен в табл. 1. ИГХ-реакцию оценивали как негативную – 0 (менее 0,1% окрашенных клеток), слабую – 1 (10% окрашенных клеток и менее), умеренно-позитивную – 2 (11–49% окрашенных клеток), сильно-позитивную – 3 (50–89% окрашенных клеток) и выраженно-позитивную – 4 (90% окрашенных клеток и более) на 1000 клеток в каждой опухоли по J. Rajcani et al. [25] (табл. 2).

Микроваскулярную плотность (МВП) оценивали на 3–5 полях опухолевой ткани при ИГХ-реакции на CD31, CD34 и CD105 при увеличении 200 по М. Yasuyoshi et al. [26].
Результаты. При ИГХ-исследовании в группе неинвазивных папиллярных УК (НПУК) была выявлена положительная экспрессия всех исследуемых маркеров стволовых клеток (СК). Слабая и умеренно-позитивная экспрессия ALDH1А1 обнаружена в 8 (4%) случаях, из них в 5 наблюдениях опухоль соответствовала базальному фенотипу, а в 3 – люминальному.
Экспрессия SOX-2 наблюдалась в 36 (19%) опухолях в диапазоне слабой и умеренно-позитивной реакции. Из них в 20 случаях НПУК соответствовала базальному фенотипу, в 16 – люминальному.
Положительная реакция на CD24 и CD133 обнаружена во всех НПУК базального и люминального фенотипов.
В большинстве случаев экспрессия маркеров визуализировалась в слабой и умеренно-позитивной диапазонах. По 2 случая в опухолевых клетках обнаружена сильно-позитивная экспрессия CD24.
Слабая и умеренно-позитивная экспрессия CD82 выявлена в НПУК базального и люминального фенотипов в 24 (12%) и 21 (11%) наблюдении соответственно.
В 22 (11%) и 20 (10%) НПУК базального и люминального фенотипов в опухолевых клетках визуализировалась слабая и умеренно-позитивная реакция на CXCR4 соответственно.
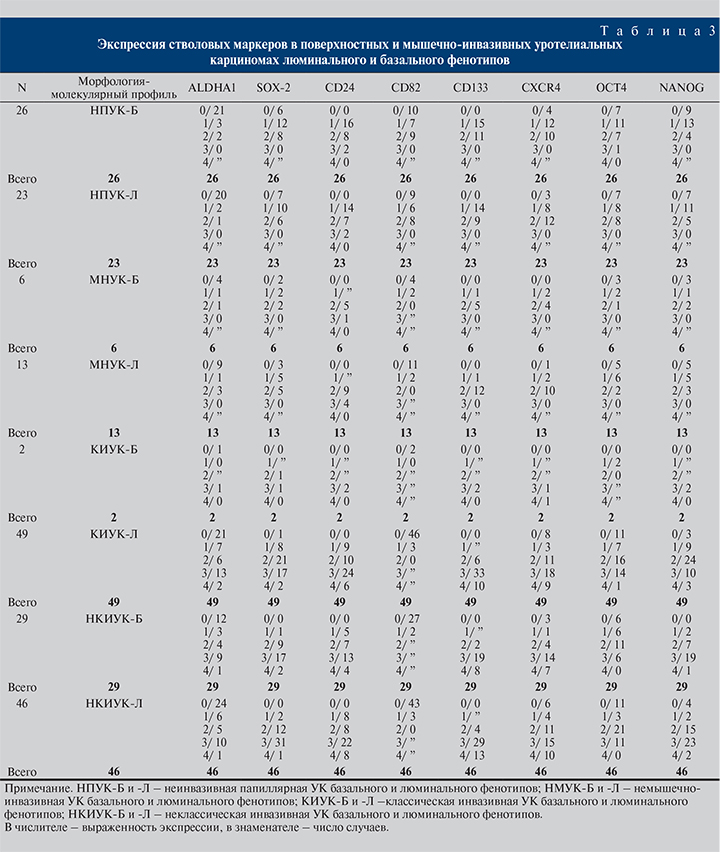
Экспрессия OCT4 в НПУК базального фенотипа обнаружена в 19 (10%) случаях. Из них в 11 новообразованиях наблюдалась слабая реакция, в 7 – умеренная. Лишь в одной опухоли с базальным фенотипом опухолевые клетки были декорированы экспрессией OCT4 в сильно-позитивном диапазоне. В карциномах люминального фенотипа по 8 случаев OCT4-положительные клетки соответствовали слабому и умеренно-позитивному диапазонам.
В 17 (9%) и 16 (8%) НПУК базального и люминального фенотипов обнаружена слабая и умерено-позитивная экспрессия NANOG соответственно.
В группе немышечно-инвазивных УК (НМУК) слабая и умеренно-позитивная экспрессия ALDH1А1 выявлена в 6 (3%) случаях. Преобладали опухоли люминального фенотипа. Только в 2 НМУК с базальным фенотипом была верифицирована положительная реакция в аналогичных диапазонах.
Экспрессия SOX-2 наблюдалась в 14 (7%) опухолях в слабой и умеренно-позитивной диапазонах. Из них в 10 случаях НМУК соответствовала люминальному фенотипу.
Экспрессия CD24 и CD133 обнаружена во всех НМУК базального и люминального фенотипов. Из них в 4 НМУК люминального фенотипа и в 1 – базального наблюдалась сильно-положительная реакция на CD24. В остальных случаях опухолевые клетки положительно реагировали на CD24 и CD133 преимущественно в умеренно-позитивном диапазоне. По 1 НМУК базального и люминального фенотипов обнаружена слабая экспрессия CD133.

По 2 (2%) случая оба фенотипа характеризовались слабой экспрессией CD82. Во всех НМУК базального фенотипа выявлена положительная реакция на CXCR4. Из них в 4 наблюдениях реакция была оценена как умеренно-позитивная, в 2 – как слабая. Из 12 CXCR4-положительных люминальных НМУК в 10 случаях определялась умеренно-позитивная реакция, в 2 обнаружена слабая экспрессия.
Экспрессия OCT4 в НМУК базального фенотипа обнаружена в 3 (1,5%) случаях. Из них только в 1 наблюдении визуализировалась умеренно-позитивная интенсивность реакции, в остальных – слабая. Из 8 OCT4-положительных люминальных НМУК только 2 характеризовались умеренно-позитивной реакцией. В остальных 6 опухолях имела место слабая экспрессия.
Слабая и умеренно-позитивная экспрессия NANOG визуализировалась в 11 (6%) новообразованиях. Преобладали опухоли с люминальным фенотипом – 8 (4%) случаев. Из них в 3 наблюдениях реакция оценена как умеренно-позитивная. В 5 образцах лишь единичные опухолевые клетки положительно реагировали на NANOG. В остальных 3 НМУК с базальным фенотипом в 2 также была выявлена умеренно-позитивная реакция, в 1 – слабая экспрессия.
В группе мышечно-инвазивных УК классического гистологического строения (КИУК) экспрессия ALDH1А1 обнаружена в 27 (14%) случаях. Преобладали опухоли с люминальным фенотипом (n=26; 13%). В 14 новообразованиях экспрессия ALDH1А1 идентифицирована как сильно-позитивная. Из них только одна опухоль имела базальный фенотип. Среди остальных 13 КИУК с люминальным фенотипом в 6 случаях обнаружена умеренно-позитивная экспрессия, в 7 опухолях визуализировалась слабая реакция.

Экспрессия SOX-2 не была выявлена только в одной опухоли с люминальным фенотипом. В опухолевых клетках преобладала умеренно-позитивная экспрессия (n=22; 11%). В 18 наблюдениях реакция оценена как сильно-позитивная. В 8 КИУК люминального фенотипа обнаружена слабая реакция, в 2 опухолях более 90% клеток экспрессировали SOX-2.
Все КИУК базального и люминального фенотипов экспрессировали CD24 и CD133. В опухолевых клетках преобладала сильно-позитивная реакция. В этом диапазоне экспрессия CD24 и CD133 визуализировалась во всех КИУК базального фенотипа, а также в 24 и 33 люминальных КИУК соответственно. В 6 и 10 КИУК с люминальным фенотипом более 90% опухолевых клеток экспрессировали CD24 и CD133 соответственно.
Слабая реакция на CD82 идентифицирована только в 3 (1,5%) люминальных КИУК. Экспрессия CXCR4 наблюдалась во всех КИУК базального фенотипа в сильно- и выраженно-позитивных диапазонах. Из 49 КИУК люминального фенотипа только в 8 случаях не была позитивной экспрессии. Преобладали опухоли с экспрессией в сильно-позитивном диапазоне (n=19; 10%). В 10 новообразованиях обнаружена выраженно-позитивная реакция, в 11 опухолях реакция оценена как умеренно-позитивная. У 3 пациентах опухолевые клетки слабо реагировали на CXCR4.
Во всех КИУК базального фенотипа обнаружена слабая реакция на OCT4. В 14 КИУК с люминальным фенотипом экспрессия OCT4 обнаружена в сильно-позитивном диапазоне, в 16 наблюдениях выявлена умеренно-позитивная экспрессия. В одном случае более 90% клеток положительно реагировали на OCT4. В 11 опухолях зафиксирована отрицательная экспрессия OCT4.
Все КИУК с базальным фенотипом экспрессировали NANOG в сильно-позитивном диапазоне. Среди NANOG-положительных люминальных КИУК преобладали опухоли с экспрессией в умеренно-позитивном диапазоне (n=24; 12%). В 10 случаях экспрессия NANOG оценена как сильно-позитивная. В 3 наблюдениях обнаружена выраженно-позитивная реакция, в 9 – слабая.
В группе мышечно-инвазивных УК неклассического гистологического строения (НКИУК) экспрессия ALDH1А1 в опухолях с базальным фенотипом обнаружена в 16 (8%) наблюдениях. Из них в 9 образцах экспрессия маркера визуализировалась в сильно-позитивном диапазоне, в 4 обнаружена умеренно-позитивная экспрессия, а в 3 определялась слабая реакция. В одном случае более 90% опухолевых клеток положительно реагировали на ALDH1А1. Среди люминальных НКИУК преобладали опухоли с сильно-позитивной экспрессией (n=10; 5%). В 6 и 5 наблюдениях определена слабая и умеренно-позитивная реакция соответственно. Только в 1 случае более 90% опухолевых клеток экспрессировали ALDH1А1.
Во всех НКИУК базального и люминального фенотипов верифицирована экспрессия SOX-2, CD24 и CD133. В 17, 13 и 19 НКИУК с базальным фенотипом экспрессии SOX-2, CD24 и CD133 соответственно была выявлены в сильно-позитивном диапазоне. В 9, 7 и 2 случаях соответственно наблюдалась умеренно-позитивная реакция. В 2, 4 и 8 опухолях экспрессия SOX-2, CD24 и CD133 соответственно оценена как выраженно-позитивная. В 1 и 5 новообразованиях опухолевые клетки слабо реагировали на SOX-2 и CD24 соответственно.

В 31, 22 и 29 люминальных НКИУК экспрессия SOX-2, CD24 и CD133 соответственно была выявлены в сильно-позитивном диапазоне. Экспрессия вышеуказанных маркеров в 12, 8 и 4 случаях наблюдалась в умеренно-позитивном диапазоне, в 1, 8 и 13 наблюдениях отмечена выраженно-позитивная экспрессия. В 2 и 8 новообразованиях опухолевые клетки слабо реагировали на SOX-2 и CD24 соответственно.
В этой группе положительная экспрессия CD82 обнаружена в 5 (2,5%) случаях. Из них 2 опухоли имели базальный фенотип, а 3 УК соответствовали люминальному фенотипу. Во всех случаях визуализировалась слабо-позитивная реакция на CD82.
Среди НКИУК с базальным фенотипом экспрессия CXCR4 обнаружена в 26 (13%) случаях. Преобладали опухоли в сильно-позитивном диапазоне (n=14; 7%). В 7 случаях более 90% опухолевых клеток положительно реагировали на CXCR4. В 4 наблюдениях экспрессия маркера соответствовала умеренно-позитивному диапазону, в 1 случае была выявлена слабая реакция. Из 46 люминальных НКИУК в 15 наблюдалась сильно-положительная реакция. В 10 случаях положительная экспрессия отмечена в более 90% клетках.
В 11 наблюдениях визуализировалась умеренно-позитивная экспрессия, в 4 опухолях определена слабая реакция.

Позитивная реакция на OCT4 обнаружена в 23 (12%) НКИУК базального фенотипа. Преобладали опухоли в умеренно-позитивном диапазоне (n=11; 6%). По 6 случаев выявлены сильно-позитивная и слабая реакции. Из 46 НКИУК с люминальным фенотипом в 11 опухолях реакция на OCT4 была негативной. В 21 случае экспрессия соответствовала умеренно-позитивному диапазону, в 11 новообразованиях отмечена сильно-позитивная реакция. Слабая реакция на маркер обнаружена в трех наблюдениях.
Все НКИУК базального фенотипа экспрессировали NANOG. Преобладали опухоли в сильно-позитивном диапазоне (n=19; 10%). В 7 карциномах определялась умеренно-позитивная реакция, в 2 обнаружена слабая экспрессия. В одномслучае более 90% опухолевых клеток экспрессировали NANOG. Среди люминальных НКИУК преобладали опухоли с сильно-позитивной (n=23; 12%). В 15 опухолях отмечалась умеренно-позитивная реакция, по 2 случая выявлена слабая и выраженно-позитивная экспрессия NANOG (табл. 3).
Из оставшихся 2 НКИУК с нейрональным фенотипом в 1 опухоли обнаружены слабая экспрессия CD82, умеренно-позитивная коэкспрессия ALDH1А1, OCT4 и сильно-позитивная реакция на SOX-2, CD24, CD133 и CXCR4. Другая опухоль, кроме CD82, положительно реагировала на все маркеры в сильно-позитивном диапазоне.

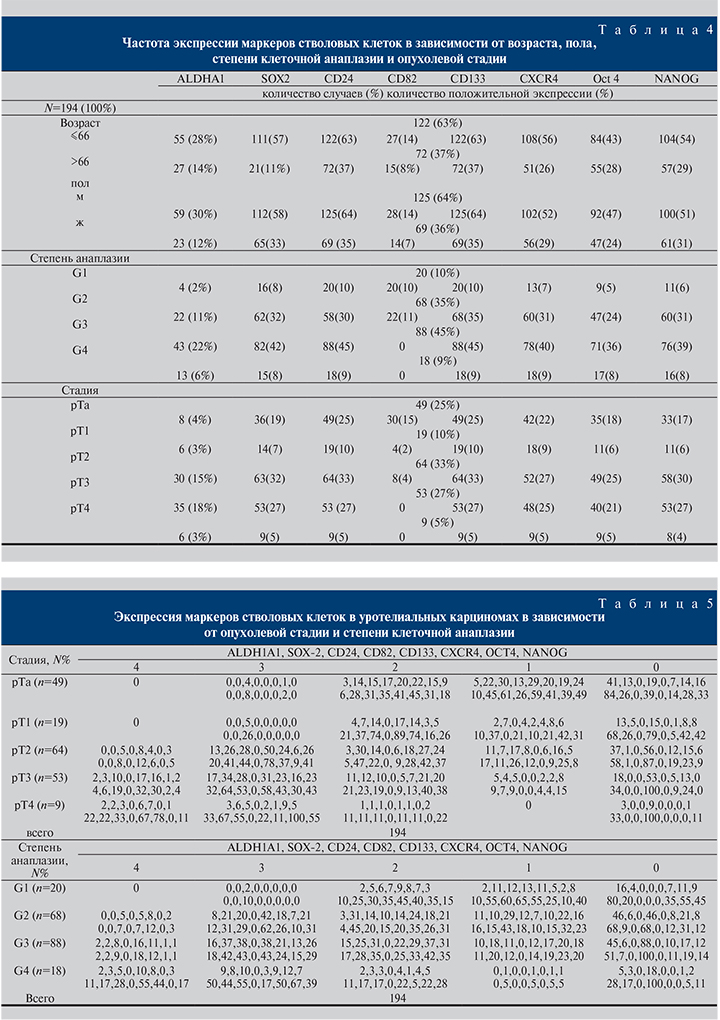
Полученные результаты показывают, что использованные в исследовании маркеры СК экспрессируются во всех молекулярных подтипах УК, по частоте и уровню экспрессии не имеют характерных особенностей (рис. 1, 2). Между тем при распределении УК по стадиям установлено, что по мере увеличения стадии опухоли частота обнаружения экспрессии ALDH1А1, SOX-2, CD24, CD133, CXCR4, OCT4 и NANOG возрастает. В отличие от вышеуказанных маркеров СК положительная экспрессия CD82 в подавляющем большинстве случаев выявлена в НПУК.
Аналогичные результаты были получены при сравнительном анализе частоты экспрессии маркеров в зависимости от степени клеточной анаплазии УК (табл. 4).
Выявленные диапазоны реакций исследуемых маркеров также имели характерные особенности. Так, было определено, что в УК независимо от молекулярного фенотипа по мере увеличения стадии и степени клеточной анаплазии процент положительно прореагировавших клеток на ALDH1А1, SOX-2, CD24, CD133, CXCR4, OCT4 и NANOG возрастает (рис. 3).
Таким образом, при интерпретации полученных результатов определено, что в УК имеется тенденция к усилению частоты и уровня экспрессии СК по мере увеличения стадии и степени клеточной анаплазии. Противоположная картина наблюдается с экспрессией CD82 (рис. 4, 5, табл. 5).
Сравнительная характеристика экспрессии эндотелиальных маркеров CD31, CD34 и CD105, являющихся в том числе идентификаторами гемопоэтических прогениторных клеток, показала, что CD105 – наиболее чувствительный белок для определения опухолевого прогресса в УК.

В нашем исследовании было выявлено, что при экспрессии CD105 среднее значение микроваскулярной плотности (МВП) в поверхностных УК значительно отличается (в опухолях в стадии рТа – 9,7, а для рТ1 – 23,1). Схожая ситуация наблюдалась и в мышечно-инвазивных УК (рТ2 – 37,0; рТ3 – 47,2; рТ4 – 59,4). В то же время при экспрессии CD31 существенные различия средних значений МВП были обнаружены между стадиями рТ1 рТ2 и рТ3 рТ4. При экспрессии CD34 значительное отличие средних значений МВП определено только между стадиями рТ2 и рТ3 (рис. 6). Аналогичная картина визуализировалась и при сравнительном анализе показателей средних значений МВП в зависимости от степени клеточной анаплазии (табл. 6).
Выводы
- Экспрессия маркеров СК в УК базального и люминального фенотипов варьируется в широком диапазоне. Данный факт демонстрирует внутриопухолевую гетерогенность обоих молекулярных фенотипов УК и отражает клональное разнообразие в пределах одной опухоли.
- Полученные результаты позволяют утверждать, что РСК с базальным фенотипом не являются исключительной субпопуляцией в УК. В качестве РСК могут выступать другие клетки-предшественники с иммунофенотипом промежуточных и/или зонтичных клеток.
- В большинстве случаев в УК обнаруживается коэкспрессия маркеров СК. В то же время в инвазивных опухолях имеется тенденция к усилению частоты и уровня экспрессии ALDH1А1, SOX-2, CD24, CD133, CXCR4, OCT4 и NANOG по мере увеличения стадии и степени клеточной анаплазии. Противоположная картина характерна для экспрессии CD82. Эти значимые показатели позволят разработать новые подходы к терапии УК.
- CD105 является предпочтительным панэндотелиальным предиктором опухолевого ангиогенеза и преметастатической ниши. Установлено, что в отличие от CD31 и CD34 по мере увеличения стадии и степени клеточной анаплазии количество CD105-положительных сосудов пропорционально возрастает.


