Было проведено многоцентровое двойное слепое исследование в параллельных группах с активным
и плацебо-контролем по изучению эффективности нового α-адреноблокатора силодозина. В исследовании приняли участие 1228 мужчин старше 50 лет из 72 медицинских учреждений 11 стран Европы, у которых сумма баллов по шкале IPSS составила 13 и более, максимальная скорость потока мочи (Qmax) – 4–15 мл/с. Пациенты проходили 2-недельный период “отмывания” от предыдущей терапии и вводный период с плацебо в течение 4 нед. Всего 955 пациентов были рандомизированы в 3 группы (2:2:1). В 1-й группе в течение 12 нед пациенты (n=381) ежедневно получали 8 мг силодозина, во 2-й (n=384) — 0,4 мг тамсулозина, в 3-й (n=190) — плацебо. Было рассчитано изменение общего балла по IPSS по сравнению с началом исследования, определены значения по подшкалам накопления/опорожнения и качества жизни, а также Qmax. Ответ на лечение определялся как снижение балла по IPSS на 25% и более по сравнению с начальным уровнем, увеличение Qmax на 30% и более от исходного. При терапии силодозином и тамсулозином изменение общего балла по IPSS по сравнению с начальным уровнем было значительно выше, чем при приеме плацебо (p<0,001). Расхождение с результатами, полученными при приеме плацебо, в среднем составило 2,3 для силодозина и 2,0 для тамсулозина. При использовании силодозина и тамсулозина доля ответивших на лечение пациентов, определенная на основании шкалы IPSS (66,8 и 65,4% соответственно) была гораздо выше (p 0,001), чем в группе плацебо (50,8%). Значительное снижение ноктурии по сравнению с плацебо зарегистрировано для принимавших силодозин (изменение по сравнению с начальным уровнем составило -0,9, -0,8 и -0,7 для силодозина, тамсулозина и плацебо соответственно). Во всех группах было отмечено увеличение Qmax. Вычисленное методом наименьших квадратов
среднее изменение между начальной и конечной точками исследования составило 3,77 мл/с для силодозина; 3,53 мл/с для тамсулозина и 2,93 мл/с для плацебо. Однако изменение на фоне лечения силодозином и тамсулозином не было статистически значимым по сравнению с результатами, полученными при приеме плацебо, из-за необычайно высокого ответа на прием плацебо. В конечной точке исследования доля пациентов, ответивших на лечение на основании Qmax, составила 46,6; 46,5 и 40,5% соответственно для групп, получавших силодозин, тамсулозин и плацебо. Пациенты хорошо переносили активную терапию, и доля пациентов, прервавших терапию из-за нежелательных эффектов, была низкой во всех группах (2,1; 1,0 и 1,6% для силодозина, тамсулозина и плацебо соответственно). Наиболее распространенным побочным действием при приеме силодозина было отсутствие или снижение интенсивности эякуляции при оргазме (14%). Данный феномен является обратимым и возникает вследствие эффективного и селективного антагонистического действия на α1A-адренорецепторы. Для силодозина характерна более высокая, чем для тамсулозина, частота возникновения этого побочного действия. Однако лишь 1,3% получавших силодозин пациентов прекратили лечение по этой причине.
Таким образом, силодозин является эффективным и хорошо переносимым средством для облегчения состояния при нарушениях накопления мочи в мочевом пузыре и его опорожнения, что свидетельствует о взаимосвязи обструкции шейки мочевого пузыря и аденомы предстательной железы. Эффективность силодозина сопоставима с таковой тамсулозина. Из использованных в исследовании препаратов лишь силодозин достоверно уменьшал ноктурию по сравнению с плацебо.
Введение. Аденома предстательной железы (АПЖ) является следствием гиперплазии железистых и стромальных клеточных элементов [1]. Увеличенная предстательная железа может препятствовать оттоку мочи из мочевого пузыря [2]. Однако в исследованиях было показано, что размер предстательной железы и скорость потока мочи обычно не коррелируют со степенью выраженности расстройств мочеиспускания [3].
Хотя при развитии АПЖ преобладают симптомы опорожнения, пациентов больше всего беспокоят
симптомы накопления [4]. Целью терапии в таких случаях является облегчение расстройств мочеиспускания и улучшение качества жизни (КЖ) пациентов. Целью терапии является также предотвращение осложнений, таких как острая задержка мочи или нарушения уродинамики верхних мочевыводящих путей и функции почек вследствие инфравезикальной обструкции (ИВО). Препаратом первой линии лечения расстройств мочеиспускания, связанных с АПЖ умеренной или высокой степени тяжести, являются α-адреноблокаторы [5] а также ингибиторы 5α-редуктазы (5-AРИ). α-Адреноблокаторы можно использовать независимо от размера предстательной железы, поскольку они влияют на динамическое (нейронопосредованное) сокращение мышечной стромы, которая сильно выражена при АПЖ. Действие 5-АРИ направлено на уменьшение стромального компонента железы. В развитие симптомов заболевания у пациентов с АПЖ вносят вклад оба компонента [6].
При применении неселективных α1A-адреноблокаторов могут возникать нежелательные эффекты (ортостатическая гипотензия, головокружение и головные боли) [7–9]. Напротив, препараты с выраженной селективностью к α1A-адренорецепторам обладают более высокой специфичностью к тканям простаты, оказывают меньшее влияние на АД и характеризуются меньшим количеством нежелательных эффектов со стороны сердечно-сосудистой системы в целом [10, 11].
Силодозин является новым препаратом с высокой селективностью по отношению к α1A-адренорецепторам, преобладающим в мочевыводящих путях мужчин. В экспериментах in vitro было показано, что отношение связывания силодозина с разными подтипами рецепторов (α1A:α1B) чрезвычайно высоко (162:1), что свидетельствует о способности силодозина заметно снижать повышенный нейронопосредованный динамический тонус гладкой мускулатуры нижних мочевыводящих путей с минимальным количеством нежелательных эффектов в отношении АД [12–14].
В данной работе представлены результаты первого рандомизированного плацебо-контролируемого исследования препарата силодозин при терапии пациентов с АПЖ, проведенного в странах Европы.
Действие силодозина сравнивали с тамсулозином [15].
Материалы и методы. Многоцентровое двойное слепое исследование в параллельных группах с активным и плацебо-контролем проведено в 72 амбулаторных и стационарных учреждениях 11 стран
Европы. В общей сложности скрининг прошли 1228 пациентов, из которых 955 были рандомизированы
в 3 группы в соотношении 2:2:1. В течение 12 нед пациенты 1-й группы (n=381) получали силодозин
в дозе 8 мг, 2-й (n=384) — тамсулозин по 0,4 мг, а пациенты 3-й группы (n=190) – плацебо.
Было предусмотрено 8 контрольных точек: за 42 дня до начала исследования (начало периода “отмывания” от предыдущей терапии), за 28 дней (начало вводного периода терапии плацебо), начальная контрольная точка (до и после рандомизирования), а также спустя 7, 14, 28, 56 и 84 дней после начала терапии (или в день досрочного прекращения исследования).
На начальном этапе включения в исследование, а также спустя 7, 14, 28, 56 и 84 дня после начала терапии (или в день досрочного прекращения исследования) пациенты заполняли опросник IPSS, включая вопрос 8, касающийся КЖ. Поскольку исследование проводили в нескольких странах Европы с участием людей, разговаривающих на разных языках, была проведена валидация текстов на соответствующих языках.
В день заполнения опросника IPSS исследователи фиксировали наибольшее значение Qmax каждые 2–6 ч после приема препарата.
В каждой контрольной точке пациентам измеряли систолическое (САД) и диастолическое (ДАД)
артериальное давление, а также частоту пульса (ЧП). На этапе отбора и начальном этапе (до и после
приема первой дозы) проводили тест на ортостатическую гипотензию. На этапе отбора, начальном
этапе и в конечной точке исследования в случае его преждевременного прекращения делали лабораторные анализы и 12-канальную ЭКГ. В каждой точке контроля регистрировали нежелательные эффекты. Появление новых нежелательных симптомов, заболеваний или ухудшение существующего на начальный момент состояния пациентов в период после рандомизации рассматривали как побочное действие препарата, возникшее во время лечения.
Для участия в исследовании были отобраны больные АПЖ в возрасте 50 лет и старше с ИВО (общий
балл по шкале IPSS 13 и более; Qmax 4—15 мл/с; минимальный объем мочеиспускания 125 и более мл). Основные критерии исключения: уменьшение общего балла по шкале IPSS менее чем на 25% во
время периода вводной терапии; объем остаточной мочи 250 мл и более; внутрипузырная обструкция,
вызванная не АПЖ; оперативные вмешательства по поводу АПЖ в анамнезе; наличие инфекции мочевыводящих путей/рецидива инфекции мочевыводящих путей в анамнезе, хронический простатит, рак предстательной железы или рак мочевого пузыря в анамнезе, ортостатическая гипотензия в анамнезе, использование 5-АРИ в период 6 мес до начала исследования, использование α-адреноблокаторов или фитотерапии в 2-недельный период до началом исследования.
За параметр первичной эффективности было принято изменение общего балла по опроснику IPSS
(вопросы 1–7).
Вторичный анализ проведен в подгруппах пациентов, у которых на начальном этапе отмечена ноктурия (не менее двух мочеиспусканий в течение ночи по результатам ответа на вопрос 7 опросника IPSS).
Безопасность оценивали на основании зарегистрированных нежелательных эффектов в группах после
проведения рандомизации. Кроме того, отклонение от начального состояния пациентов оценивали в
соответствии со следующими параметрами безопасности: ДАД, САД и ЧП в положении лежа на спине
и стоя (ортостатическая проба), результатами лабораторных исследований, ЭКГ и результатами меди-
цинского обследования.
Результаты. Первый пациент был включен в исследование 18 мая 2006 г., а последний завершил его 10 мая 2007 г. Во всех группах уровень прерывания исследования вследствие возникновения побочного
действия препаратов был невысоким (≤2,1%).
Необходимо отметить, что гипертензию наблюдали у 424 (44,4%) пациентов. При этом масса пациентов проходили лечение антигипертензивными препаратами. Исходно многие пациенты имели в анамнезе эректильную дисфункцию (24%) или жалобы на нарушение эякуляции (24%).
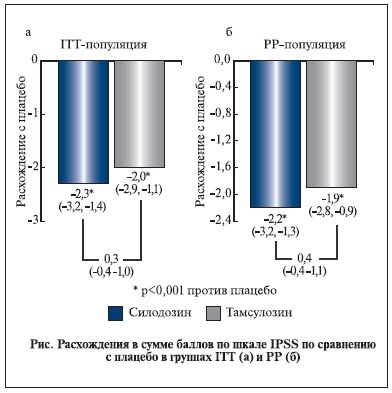
Изменение общего балла по шкале IPSS (вопросы 1–7) в разных группах пациентов по сравнению с
начальным уровнем, а также различия после активной терапии и использования плацебо редставлены
в табл. 1 и на рисунке.
Таблица 1. Изменение общего балла по шкале IPSS.
Во всех трех группах наблюдали непрерывное увеличение числа пациентов, ответивших на лечение, о
чем судили на основании изменения общего балла по шкале IPSS на 12-й неделе терапии относительно исходных данных. В конечной точке исследования улучшение наблюдали у 66,8 и 65,4% пациентов, получавших силодозин и тамсулозин соответственно; аналогичный показатель в группе плацебо составил 50,8%.
Таблица 2. Изменения баллов в подпунктах “Накопление мочи” и “Мочеиспускание” по шкале IPSS.
В табл. 2 представлены средние баллы по симптомам накопления (вопросы 2, 4 и 7) и опорожнения
(вопросы 1, 3, 5 и 6). Во всех контрольных точках наблюдали статистически значимое улучшение
на фоне активной терапии по сравнению с плацебо. При сравнении силодозина и тамсулозина статистически значимых различий выявлено не было, несмотря на то что суммарный балл симптомов
накопления по шкале IPSS для силодозина был несколько выше. Необходимо отметить, что в подгруппе пациентов с ноктурией перед началом исследования (n=764) наиболее значимое снижение ее
выраженности отмечено у пациентов 1-й группы — на 0,9; 0,8 и 0,7 соответственно в 1-й, 2-й и 3-й группах по сравнению с начальным уровнем.
Во всех трех группах у пациентов наблюдали выраженное улучшение КЖ по сравнению с начальным
уровнем: при ответе на вопрос 8 опросника IPSS для пациентов 1-й, 2-й и 3-й групп этот показатель
в среднем уменьшился на 1,1; 1,1 и 0,8 балла соответственно.
В 1-й и 2-й группах пациентов наблюдали значительный рост Qmax по сравнению с 3-й группой, однако это увеличение не было статистически значимым. Скорректированная средняя величина изменения между начальным и конечным уровнями составила 3,77 мл/с в 1-й группе (p=0,089 по сравнению с плацебо); 3,53 мл/с – во 2-й (p=0,221 по сравнению с плацебо) и 2,93 мл/с – в 3-й.
Наиболее распространенными (более 2%) были следующие нежелательные эффекты: снижение или
отсутствие эякуляции при оргазме и головная боль. Нарушения эякуляции (данный термин включал
следующие понятия: оргазм без семяизвержения, снижение качества эякулята и собственно ретроградную эякуляцию) наблюдали 14,2% (54 из 381) пациентов 1-й группы, 2,1% (6 из 384) – 2-й и 1,1% (2 из 190) – 3-й группы. Во 2-й группе частота возникновения головной боли была выше (5,5%; 21
из 384), чем в 1-й группе (2,9%; 11 из 381). Однако данный показатель был сопоставим с таковым 3-й
группы (4,7%; 9 из 190).
Доля пациентов, прервавших лечение из-за возникновения побочного действия препарата, была
небольшой и статистически не различалась в разных группах: в 1-й группе лечение прервали 8 (2,1%)
пациентов, во 2-й – 4 (1%), в 3-й – 3 (1,6%) пациента. Наиболее частой причиной досрочного прерывания лечения было отсутствие эякуляции (5 пациентов в 1-й группе и 1 – во 2-й), которое носило обратимый характер и исчезало после прекращения терапии.
Ни в одной группе пациентов за время проведения исследования клинически значимых изменений
лабораторных параметров, основных физиологических показателей или ЭКГ зарегистрировано не
было. Важной характеристикой силодозина является отсутствие клинически релевантных или статистически значимых изменений АД или ЧП по сравнению с плацебо, тогда как при приеме тамсулозина было отмечено небольшое, но статистически значимое расхождение данных параметров по сравнению с плацебо.
Обсуждение. В исследовании показано, что силодозин является эффективным средством лечения
больных АПЖ. Улучшение стало заметным вскоре после начала проведения терапии. Эффективность
силодозина была минимум эквивалентной таковой тамсулозина, а в абсолютных значениях параметров
превосходила ее.
Необходимо отметить, что селективное действие силодозина является клинически эффективным в
лечении нарушений мочеиспускания. Также важно, что силодозин показал значительную ффективность в облегчении ноктурии по сравнению с плацебо.
В данном исследовании терапия силодозином приводила к раннему и продолжительному увеличению
Qmax. Первое рандомизированное двойное слепое исследование силодозина с контролем плацебо было проведено в Японии. В нем участвовали мужчины в возрасте 50 лет и старше, у которых общий балл по IPSS составил 8 и более, а параметр КЖ — 3 и более. Пациенты были рандомизированы на 3 группы. Пациенты 1-й группы в течение 12 нед получали 4 мг силодозина 2 раза в день, 2-й – 0,2 мг тамсулозина 1 раз в день (дозировки лекарственных препаратов в Японии и США различаются от стран Европы), а 3-й группы – плацебо [15]. Первичной конечной точкой исследования стало изменение общего балла по шкале IPSS по сравнению с начальным уровнем. Всего были рандомизированы 457 пациентов (в 1-ю группу включены 176 пациентов, во 2-ю – 192, и в 3-ю – 89). Уменьшение общего балла IPSS по сравнению с начальным уровнем для 1-й, 2-й и 3-й групп пациентов составило 8,3, 6,3 и 5,3 соответственно. Начиная с 1-й нед в 1-й группе наблюдали значительное снижение общего балла IPSS по сравнению с 3-й группой, а начиная со 2-й нед — по сравнению с тамсулозином. В подгруппе пациентов с высокой степенью тяжести заболевания (суммарный балл по шкале IPSS 20 и более) эффективность терапии силодозином также была значительно выше по сравнению с плацебо (-12,4 против -8,7). Частота развития нежелательных эффектов составила 69,7, 47,4 и 36,4% соответственно. Наиболее распространенным нежелательным эффектом в группе пациентов, получавших силодозин, была аномальная эякуляция. Тем не менее лишь 5 (2,9%) участников прекратили участие в исследовании по этой причине.
В рамках двух рандомизированных исследований III фазы с плацебо-контролем, проведенных в США,
была проведена оценка эффективности и безопасности применения препарата силодозин в дозе
8 мг для лечения АПЖ [16]. Общее число пациентов составило 923, средний возраст — 65 лет. Из них 466 пациентов получали силодозин (8 мг/сут) во время завтрака в течение 12 нед, 457 пациентов получали плацебо. Через 0,5 нед (3–4 сут) после начала лечения у пациентов, получавших силодозин, наблюдали значительное улучшение показателей по общему баллу IPSS (расхождение -1,9; p<0,0001), а также по симптомам накопления (-0,5; p=0,0002) и опорожнения (-1,4; p<0,0001) по сравнению с группой плацебо. Среднее уменьшение общего балла IPSS по сравнению с начальным уровнем составило 4,2 для силодозина, тогда как для плацебо оно достигало 2,3. Среднее увеличение Q через 2–6 ч после введения первой дозы препарата было более выраженным для силодозина (на 2,8±3,4 мл/с), чем для плацебо (на 1,5±3,8 мл/с). К концу 12-й нед данные расхождения по-прежнему были значительными (p<0,001) [17].
В ходе долгосрочного 40-недельного открытого расширенного исследования с участием пациентов
из двух вышеупомянутых исследований все участники ежедневно во время завтрака получали 8 мг
силодозина [18]. Основная цель данного исследования состояла в оценке безопасности препарата.
Общее число участников составило 661, из них 435 (65,8%) завершили исследование. Пациентов предварительно разделили на группы, которые получали двойную слепую терапию (плацебо или силодозином). Доля пациентов с нежелательными эффектами была выше у впервые принимавших силодозин пациентов (ранее они получали терапию плацебо, 71,5%) по сравнению с группой пациентов, продолживших терапию данным препаратом (58,3%). Среди пациентов, прекративших участие в исследовании по причине нарушений эякуляции, 7,5% получали препарат впервые, а 1,9% пациентов получали препарат ранее. Силодозин обладал хорошей переносимостью, частота таких нежелательных реакций, как головокружение и ортостатическая гипотензия, была особенно низкой.
Поскольку эффективность тамсулозина и силодозина схожа, возникает вопрос: имеет ли силодозин какие-либо дополнительные преимущества? На основании результатов недавно проведенных исследований можно сделать вывод о том, что прием силодозина сопровождается менее выраженными
нежелательными эффектами со стороны сердечно-сосудистой системы по сравнению с тамсулозином.
Это связано с более высокой уроселективностью силодозина, что особенно важно при использовании
препарата пожилыми пациентами.
В работе S. Kobayashi и соавт. [19] представлены доказательства высокой селективности силодозина в отношении α1A-рецепторов. Исследователи оценили эффективность силодозина (антагонист α1A-рецепторов) и тамсулозина (антагонист α1A+1D-рецепторов) в отношении влияния на интрауретральное давление и возникновение гипотензии у собак с прогрессирующей АПЖ. Собаки были разделены на две группы – более молодые и старые. Влияние препаратов на интрауретральное давление было сопоставимым для обеих групп собак, при этом силодозин не оказывал значимого гипотензивного действия как на старых, так и на молодых собак, в то время как гипотензивное действие тамсулозина было значительно более выраженным у старых собак. Авторы пришли к выводу, что если экстраполировать полученные данные на мужчин, силодозин представляет собой наиболее безопасный и эффективный препарат лечения расстройств мочеиспускания у больных АПЖ независимо от возраста.
В рамках открытого перекрестного исследования с контролем плацебо, в котором оценивали возможность взаимодействия α-адреноблокаторов с 5-АРИ [20], 22 здоровых мужчины в возрасте 45–78 лет получали по 8 мг силодозина в течение 21 дня. На 7-й, 14-й и 21-й день участники исследования случайным образом получали однократную дозу препаратов: силденафил (100 мг), тадалафил (20 мг) или плацебо. Перед началом исследования (начальный уровень) и спустя 1–12 ч после введения однократной дозы соответствующих препаратов были сделаны ортостатические пробы. Одновременный прием здоровыми мужчинами силодозина и препаратов силденафил или тадалафил в максимальных терапевтических дозах не приводил к клинически значимым изменениям АД или ЧП, а также не вызывал ортостатических нарушений. Наиболее часто возникающий при проведении терапии силодозином нежелательный эффект — эякуляторная дисфункция, включающая один из следующих симптомов: оргазм с пониженным качеством семени; оргазм с пониженной интенсивностью семяизвержения или оргазм без семяизвержения.
Хотя мнение о том, что эякуляторная дисфункция является результатом воздействия на шейку мочевого пузыря, широко распространено среди клиницистов, эякуляторная дисфункция представляет собой не ретроградную эякуляцию, а скорее отсутствие эякуляции в результате воздействия на “эякуляторный аппарат” (предстательную железу, семенные пузырьки и семенные протоки). Таким образом, термин “ретроградная эякуляция” некорректен [21]. На протяжении многих лет исследователи считали семенные протоки идеальной фармакологической моделью для α1A-рецепторов с целью изучения α1A-адреноблокаторов [22]. Нельзя исключать тот факт, что клинические расхождения в действии силодозина и тамсулозина по сравнению с другими антагонистами α1-адренорецепторов связаны не только с селективностью этих препаратов к подтипам адренорецепторов [23]. Необходимо учитывать дополнительные свойства данных препаратов, например непреодолимый антагонизм в семенных протоках [24] или дополнительное действие на прочие рецепторные системы (дофамин и/или серотонин) [25]. Наконец было сделано предположение,
что причина аномальной эякуляции лежит не на уровне семенных протоков, а в участках центральной нервной системы, регулирующей функцию эякуляции [26].
Этот нежелательный эффект антагонистов α1-адренорецепторов типичен для препаратов с селективностью к α1A-адренорецепторам, поскольку данный подтип распределен в органах, участвующих в фазе эмиссии [27]. В рамках неклинических исследований было показано, что α-адренорецепторы (особенно α1A-адренорецепторы) необходимы для физиологического сокращения семенных протоков и доставки спермы из семенников в уретру [28]. Снижение интенсивности семяизвержения связано с нарушением функции семенных протоков, а не с изменением образования семени и количества семенных протоков [29]. При этом имеет место снижение объема семени, что является обратимым процессом – нормальная эякуляция восстанавливается в течение нескольких дней после окончания терапии [30, 31]. Пациенты не считают данный феномен тягостным – во всех группах исследования доля пациентов, прекративших участие в исследовании по причине нарушений эякуляции, была очень низкой и сравнимой с таковой в группе плацебо.
На данный момент установлено, что развитие эякуляторной дисфункции обычно связано как с возрастом пациента, так и с наличием расстройств мочеиспускания [32–35].
Ретроспективный анализ исследований по силодозину, проведенных в странах Северной Америки
[16], позволил заключить, что эякуляторная дисфукция может быть признаком блокирования α1-адренорецепторов. В работе C. Roehrborn и соавт. [36] было показано, что эякуляторная дисфункция являлась нежелательным эффектом при лечении 28,1% участников исследований, причем улучшения нарушений мочеиспускания в этой группе пациентов были более выраженными, чем в группе пациентов без этого нежелательного эффекта [36]. В работе Y. Homma и соавт. [37] был проведен аналогичный анализ по данным исследования, проведенного в Японии [15]. В группе пациентов с нарушениями эякуляции, которые получали силодозин, наблюдали более существенное снижение общего балла по шкале IPSS по сравнению с пациентами, у которых ухудшения эякуляторной функции не происходило, а также подгруппой плацебо (соответственно -11,8 против -7,2 против -5,3).
Как и следовало ожидать от препарата с высокой уроселективностью, силодозин безопасен, при
этом по эффективности он не уступает тамсулозину. Основным преимуществом силодозина является минимум нежелательных эффектов со стороны сердечно-сосудистой системы. При измерении АД в
положении лежа на спине и при проведении ортостатической пробы показано, что препарат не оказывает клинически релевантного действия на АД. Данный факт важен, поскольку основную долю пациентов, проходящих лечение с расстройствами мочеиспускания вследствие АПЖ, составляют пожилые мужчины, которые нередко получают сопутствующую антигипертензивную терапию или такие препараты, как 5-АРИ. По результатам проведения ЭКГ и лабораторных анализов, включая исследование функции печени и определение уровня креатинина и глюкозы, неблагоприятных эффектов препарата выявлено не было.
Заключение. В данном большом мультинациональном исследовании подтверждены результаты более
ранних работ, в которых была показана эффектив-ность и безопасность препарата силодозин для лечения нарушений мочеиспускания вследствие ИВО, вызванной АПЖ. Силодозин может быть особенно
полезным для пожилых пациентов, у которых велика вероятность взаимодействия препаратов, и потому возможность нежелательных эффектов со стороны сердечно-сосудистой системы должна быть сведена к минимуму.
Европейская ассоциация урологов от имени Европейской группы по изучению препарата силодозин
(European Silodosin Study Group).
Статья доступна онлайн в базе www.sciencedirect.com
Регистрационный номер клинического исследования: ClinicalTrials.gov Идентификационный номер:
NCT00359905.
Европейская ассоциация урологов. Статья опубликована в издательстве B. V. Elsevier. Все права защищены.


