Введение. Хорошо известно, что аденома предстательной железы (АПЖ) —прогрессирующее заболевание. Это положение закреплено в руководстве по АПЖ, регулярно издаваемом Европейской ассоциацией урологов (EAУ) [1]. Прогрессирующее течение АПЖ подтверждено в ходе других исследований [2]. По прогнозам ООН, к 2025 г. на нашей планете будут проживать 8,3–8,5 млрд человек, доля пожилых мужчин будет соответствовать примерно 14,5%. Увеличение продолжительности жизни и старение мужчин приводят к увеличению числа пациентов с выраженными проявлениями АПЖ. Результатом активного консервативного лечения этой категории пациентов является увеличение доли больных с большими (более 80 см3) размерами предстательной
железы, для которых радикальным методом лечения АПЖ по-прежнему остается только оперативный [3]. Оперативное лечение больных АПЖ сопровождается повреждениями отдельных анатомических образований мочевого пузыря, предстательного отдела уретры, простаты. Применение трех основных оперативных методов лечения АПЖ (трансуретральная резекция предстательной железы, чреспузырная аденомэктомия по Федорову–Фрейеру, позадилобковая аденомэктомия по Лидскому–Миллину) часто сопровождается серьезными интра-, послеоперационными осложнениями и нередко – летальным исходом [4]. В настоящее время лучшим радикальным методом лечения АПЖ считаются чреспузырная экстрауретральная и позадилобковая аденомэктомии – классические методы по Сергиенко и Лидскому–Милину [5–7], позволяющие полностью удалять гиперплазированную ткань простаты и обеспечивать адекватное мочеиспускание, восстанавливать функциональное состояние детрузора, верхних мочевыводящих путей и почек [8—11].
Материалы и методы. Подробному описанию позадилобковой внепузырной экстрауретральной аденомэктомии (ПЭУА) предшествовало скрупулезное изучение возможного оперативного вмешательства в патологоанатомическом отделении, а затем в клинических условиях. По результатам предварительного изучения описания хода позадилобковой аденомэктомии, сопоставления анатомических особенностей предстательной железы и мочевого пузыря, парапростатического пространства у лиц, имеющих АПЖ, был изменен доступ к аденоматозным тканям простаты, позволяющий сохранять основной сосудисто-нервный пучок и предстательный отдел уретры.
Патологоанатомические исследования выполнены на трупах трех человек, имевших АПЖ, но умерших
от других заболеваний.
Оперативное вмешательство позадилобковым экстрауретральным доступом выполнено 29 больным
АПЖ. У 12 человек заболевание соответствовало 2-й стадии, у 17— 3-й. Возраст больных варьировался от 63 до 82 лет: в возрасте от 63 до 69 было 9 человек, от 70 до 79 — 17, старше 80 лет — 3 человека. У 5 пациентов в доклиническом периоде возникла острая задержка мочеиспускания, послужившая причиной госпитализации. Трое больных поступили в урологическое отделение с надлобковым мочепузырным свищом.
Особенности ПЭУА. Разрез по средней линии живота между пупком и лобком, или разрез по Пфаненштилю. Основные условия операции: тщательная препаровка тканей позадилонного пространства и передней поверхности простаты, сохранение дорзального сосудистого комплекса и предстательного отдела уретры, внутреннего замыкательного аппарата мочевого пузыря.
По передней поверхности правой и левой половин предстательной железы, отступив от средней линии
1—1,5 см, в продольном направлении, минуя основные венозный и артериальный стволы, производится
по два параллельных "обвивных" гемостатических шва длиной до 3—4 см. После чего между швами (продольно!) рассекают вначале фиброзную капсулу, а затем и всю хирургическую капсулу до аденоматозных тканей. Длина разреза варьируется в зависимости от величины простаты – обычно он на 1—2 см меньше ее продольного размера. Если фиброзная капсула простаты не прошита лигатурой, рана тотчас наполняется кровью, которая поступает из пересеченных сосудов, расположенных внутрикапсулярно (рис. 1, 2).
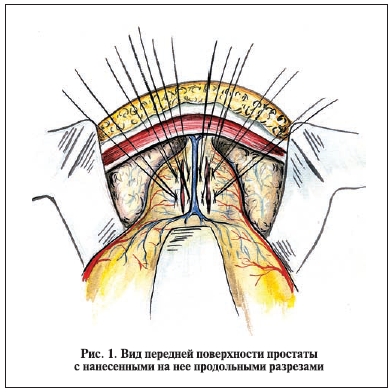
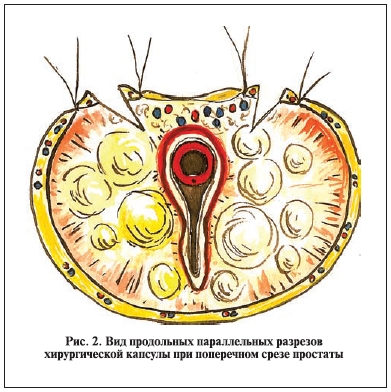
Перед выделением аденоматозных тканей оперирующий хирург вводит указательный палец левой
или правой кисти в прямую кишку с целью приблизить простату к ране. Этим простым приемом
удается контролировать всю массу аденоматозных тканей, сохранить предстательный отдел уретры и в
значительной степени облегчить энуклеацию аденоматозных узлов. В отдельных случаях аденоматозные ткани удается выделить полностью и свободно удалить через прямую кишку.
Тупым, а при необходимости и острым путем выделяют и удаляют отдельные фрагменты аденоматозно измененной части левой и/или правой половины предстательной железы.
Выделение аденоматозных тканей начинают с переднебоковой (латеральной) поверхности или со
стороны мочеиспускательного канала – внутренней (медиальной) поверхности – хирургической капсулы. Задняя и верхняя части аденомы выделяются после отделения их тупым путем от парауретральных тканей и шейки мочевого пузыря. Передняя и боковые поверхности выделяются легко, если кончик пальца расположить между хирургической капсулой и аденоматозной тканью. При нарушении очередности указанных этапов в ходе выделения аденоматозных узлов чаще повреждается медиальная хирургическая капсула по задней проксимальной полуокружности предстательного отдела мочеиспускательного канала (рис. 3).
Рисунок 3. Вылущивание аденоматозных тканей из боковых долей простаты.
При большом объеме аденоматозных тканей в боковой доле (более 30 см3) выполняют фрагментацию узлов. Размеры фрагментов не должны превышать длину разреза капсулы простаты. Выделенные
фрагменты выводят через разрез капсулы и удаляют.
Аденоматозные ткани, сращенные с предстательной частью мочеиспускательного канала по задней
полуокружности, предварительно с помощью инструментов подтягивают в разрез капсулы, затем под
контролем глаза отделяют острым путем.
При энуклеации аденоматозных узлов позадилонным доступом отчетливо ощущается внутренняя
хирургическая капсула со стороны тканей передней комиссуры и уретры; сохраняются целостность хирургической капсулы вне зоны рассечения и непрерывность пузырно-уретрального сегмента.
Передняя комиссура простаты представляет собой фиброзную ткань, сращенную с передней полуокружностью уретры. В передней комиссуре практически во всех случаях нет железистых элементов и, естественно, аденоматозных тканей. В момент выполнения позадилобковой аденомэктомии предстательный отдел уретры не повреждается. Сохранение передней комиссуры позволяет одновременно сохранить предстательную часть мочеиспускательного канала.
Сохранение сосудисто-нервного комплекса, составными частями которого являются основные
венозные стволы передней поверхности предстательной железы, направляющиеся продольно, обеспечивает достаточный отток крови из простаты и тем самым в определенной степени служит профилактикой кровотечения в момент и после энуклеации аденоматозных узлов.
Заключительный этап энуклеации аденоматозных тканей из боковых долей простаты позадилобковой
аденомэктомии представлен на рис. 4.
Рисунок 4. Наложение швов на хирургическую капсулу простаты.
Позадилонное пространство после проверки на гемостаз и инородные тела дренируют одной или
двумя трубками, подведенными к разрезам капсулы простаты. Рана передней брюшной стенки послойно ушивается до дренажей.
Результаты и обсуждение. Всем 29 больным сохранен предстательный отдел уретры. Для 26 больных
дренирование мочевого пузыря в послеоперационном периоде осуществлялось только трехходовым
уретральным катетером. Эти больные выписаны на амбулаторное лечение через 8–12 дней после операции. Трем больным, поступившим в урологическое отделение с мочепузырным свищом, кроме
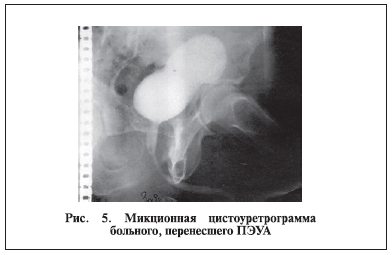
уретрального катетера дренирование мочевого пузыря осуществлялось через надлобковую цистостому. Послеоперационный период у этих больных протекал гладко, рана передней брюшной стенки зажила первичным натяжением, и больные выписаны через 15–18 дней после операции. Микционная цистоуретрограмма больного, перенесшего ПЭУА, представлена на рис. 5.
Ключевыми моментами при позадилобковом экстрауретральном доступе к аденоматозным тканям
являются методика обнажения позадилобкового пространства с учетом вариантов развития в области
переднего и переднелательного сосудистого сплетения (plexus Santorini); способ рассечения капсулы
простаты продольно, параллельно ходу сосудистонервного пучка и мочеиспускательного канала; техника выполнения аденомэктомии, дренирование мочевого пузыря, наконец способ ушивания хирургической капсулы и послеоперационное дренирование раны.
Успешность и безопасность позадилонной экстрауретральной аденомэктомии обеспечиваются
упреждающим прошиванием и перевязкой фиброзной капсулы предстательной железы в продольном
направлении параллельно дорзальному венозному комплексу. Швы накладывают как на правую,
так и на левую переднюю поверхность простаты. Лонопредстательные связки сохраняются.
Применение коагулирующих инструментов в парапростатической зоне крайне опасно из-за возможного обильного кровотечения как во время операции, так и в послеоперационном периоде.
На передней поверхности предстательной железы и нижней части мочевого пузыря преимущественно
встречается сетевидная форма венозного сплетения с множественными анастомозами, реже – магистральная форма сплетения. При магистральной форме
мочеполового венозного сплетения более отчетливо вырисовывается проходящая в продольном направлении вена, относящаяся к дорзальному венозному комплексу; более четко определяется граница между предстательной железой и мочевым пузырем. Вены парапростатического сплетения расположены в жировой клетчатке и соединительнотканных прослойках.
При относительно небольших размерах гиперплазированной предстательной железы венозные сосуды расположены более густо.
Мочеполовое венозное сплетение является своеобразным органом малого таза — морфологической
предпосылкой проявления конгестии в парапростатическом венозном сплетении и в простате, варикозного расширения вен шейки мочевого пузыря, застойного колликулита, застойного заднего уретрита и иногда повышенного кровенаполнения вен яичек и вен семенного канатика.
Оперативное вмешательство на увеличенной и застойной предстательной железе при варикозном расширении вен шейки мочевого пузыря часто сопровождается повышенным кровотечением.
При визуальном и пальпаторном контроле предстательная железа отличается от мочевого пузыря
по цвету, сосудистому венозному рисунку и плотности тканей. Основание предстательной железы
плотно прилежит и окружает шейку мочевого пузыря. Отчетливость межорганной переходной складки
зависит от увеличения простаты, вызванной аденоматозными образованиямиНа время оперативного вмешательства уретральный катетер целесообразно фиксировать тонкой лигатурой к уздечке полового члена; баллон катетера Фолея, если он наполнен, находясь в шейке мочевого пузыря, затрудняет точную ориентировку в тканях.
У двух больных АПЖ были множественные рубцовые изменения передней брюшной стенки, затруднявшие оперативное вмешательство. Доступ к предстательной железе у них осуществляли через поперечный надлонный разрез передней брюшной стенки. В других наблюдениях основанием для выбора способа позадилонной аденомэктомии служила четкая локализация аденоматозных тканей преимущественно в боковых долях простаты.
Заключение. Среди факторов, определяющих успех усовершенствованного классического метода позадилобковой аденомэктомии Лидского—Миллина, можно выделить следующие: вместо поперечного разреза фиброзной капсулы простаты с пересечением передней комиссуры простаты и предстательного отдела уретры применены продольные параллельные разрезы. За счет этого в методику оперативного вмешательства были внесены элементы, позволяющие сохранить предстательный отдел уретры, уретральное сосудистое сплетение и сосудисто-нервный пучок передней поверхности простаты, которые пересекаются в момент выполнения операции Лидского—Миллина. Упрощение методики оперативного удаления аденоматозных тканей простаты превратило операцию в менее травматичную и с меньшей кровопотерей. Реабилитация больных, перенесших ПЭУА, практически заканчивается заживлением раны мягких тканей передней брюшной стенки. Таким образом, предложен инновационный метод оперативного лечения больных аденомой предстательной железы.


