Введение. Рак предстательной железы (РПЖ) в развитых странах является наиболее распространенным злокачественным новообразованием у мужчин и второй причиной смерти от рака после рака легких [1]. В 2007 г. в структуре онкологической заболеваемости мужского населения России РПЖ занял 4-е место (8,9%): выявлено 20 223 новых случая заболевания [2]. Радикальная простатэктомия (РПЭ) и дистанционная лучевая терапия (ДЛТ) являются стандартом лечения пациентов с локализованным РПЖ с предполагаемой продолжительностью жизни не менее 10 лет [3]. При этом в России только 35% пациентов являются кандидатами для оперативного лечения в связи с распространенностью выявляемых опухолей, наличием тяжелых сопутствующих заболеваний и возрастом [4]. Поэтому пристальное внимание ученых направлено на изучение разработанных и внедренных в клиническую практику новых эффективных малоинвазивных методов лечения РПЖ, таких как конформная лучевая терапия, брахитерапия, ультразвуковая абляция (HIFU) и криотерапия [5]. Однако, в связи с тем что исследований, посвященных анализу эффективности HIFU-терапии РПЖ с когортой достаточного размера и статистической мощности, недостаточно, мы решили выполнить настоящую работу.
Цель исследования: оценить клиническую эффективность ультразвуковой абляции (HIFU) при лечении РПЖ.
Материалы и методы. Исследование выполнено в Самарском областном клиническом онкологическом
диспансере и было одобрено этическим комитетом. От всех больных было получено информированное
согласие на проведение исследования. В ретроспективный анализ были включены результаты лечения 748 пациентов, которым в 2007–2012 гг. была выполнена HIFU-терапия. Критерии включения в
исследование: пациенты, не являющиеся кандидатами для РПЭ или нежелающие подвергнуться оперативному вмешательству с локализованным и местно-распространенным РПЖ, больные с местным
рецидивом после РПЭ и ДЛТ. Критерии исключения: метастатический рак простаты, прорастание
опухоли в прямую кишку или невозможность ввести лечебный датчик в прямую кишку, толщина стенки
прямой кишки более 4 мм.
Пациенты были разделены на 3 группы в соответствии с риском прогрессирования болезни и предыдущим лечением: низкий риск (465 [62%] больных) – стадия T1–2N0M0, сумма баллов по шкале Глисона ≤6, уровень простатспецифического антигена (ПСА) менее 20 нг/мл; высокий риск (251 [34%] больной) – стадия T2-3N0M0, сумма баллов по шкале Глисона ≤9, уровень ПСА от 20 до 60 нг/мл; наличие местного рецидива после РПЭ и ДЛТ – 32 (4%) пациента. Средний возраст больных во всех группах составил 70 (52–89) лет, средний объем предстательной железы — 39 (5,5−178) см3. Процедуру выполняли под спинальной или эпидуральной анестезией на роботизированной системе Ablatherm® (EDAP, Франция). Среднее время наблюдения после HIFU-терапии составило 36 (3−60) мес. После лечения каждые 3 мес определяли уровень ПСА, проводили магнитно-резонансную томографию и биопсию простаты в случае увеличения этого показателя. 646 пациентам, у которых переднезадний размер простаты превышал 30 мм, перед HIFU-терапией была выполнена трансуретральная резекция (ТУР) простаты, при объеме резецируемой ткани более 30 см3 она выполнялась за 1 мес, при меньшем объеме простаты – непосредственно перед HIFU-терапией. Средний объем резецированной ткани простаты при ТУР составил 30 (5−120) см3. 102 пациентам была выполнена только HIFU-терапия. Процедура HIFU-терапии продолжалась 120 (60−245) мин. Среднее время госпитализации составило 7 (2−19) дней. У пациентов, у которых перед HIFU-терапией выполняли ТУР, катетер удаляли через 7 (3−21) дней, у остальных — через 14 (10 − 28) дней.
Результаты. Через 12 и 48 мес. после лечения в группе пациентов с низким риском прогрессирования медиана уровня ПСА составила 0,2 и 0,5 нг/мл; в группе с высоким риском − 0,8 и 1,2 нг/мл, в группе
больных с местным рецидивом после РПЭ и ДЛТ – 0,5 и 1,7 нг/мл соответственно (см. таблицу).
В большинстве случаев биохимический рецидив по времени совпадал с манифестацией метастазов
в костях и региональных лимфатических узлах, что потребовало назначения гормональной терапии и
бисфосфонатов.
Одиннадцати (1,4%) пациентам при возникновении местного рецидива была выполнена повторная
процедура HIFU-терапии. При этом пяти пациентам первичная HIFU-терапия проведена по нервосберегающей методике по требованию пациентов для сохранения потенции.
В течение первых месяцев после HIFU-терапии отмечены следующие побочные эффекты: недержание мочи I и II степеней – 17,5 и 7,7% пациентов соответственно. Недержание купировалось большинству больных в течение 3−6 мес. на фоне проводимой консервативной терапии. У 18,2% пациентов в течение первых 12 мес. после операции возникала стриктура простатического отдела уретры, что потребовало выполнения внутренней уретротомии и иссечения склеротически измененных тканей. У 3 (0,4%) пациентов в течение 1 мес. после лечения развился ректоуретральный свищ, в связи с чем были сформированы эпицистостома и колостома. Свищи закрылись самостоятельно в течение 6−12 мес. у двух пациентов. Летальных исходов и экстренных состояний после лечения не наблюдалось.
Была рассчитана 5-летняя безрецидивная выживаемость по методу Каплана–Мейера, которая составила 95,5% в группе с низким риском прогрессирования, 75% – в группе с высоким риском прогрессирования и 80,4 % – в группе пациентов после РПЭ и ДЛТ. Таким образом, наши наблюдения свидетельствуют о том, что HIFU-терапия в целом была эффективной для 90,9% пациентов (см. рисунок).
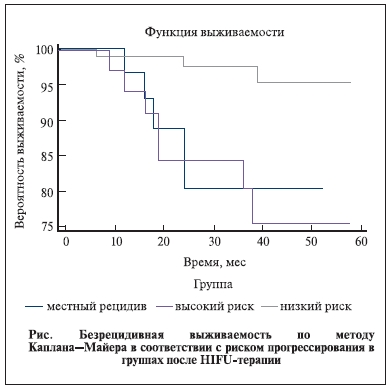
Обсуждение. В России локализованный РПЖ, при котором еще возможно проведение РПЭ, выявляется только у 35% пациентов [1]. При этом, по данным [6], у больных с I−II стадиями заболевания после
проведения радикальной простатэктомии или лучевой терапии в 25−50% случаев развивается рецидив РПЖ. Пациентам, не подходящим для оперативного или лучевого лечения и с рецидивом РПЖ, назначаются гормональная терапия, билатеральная орхиэктомия или максимальная андрогеновая блокада. Большинство исследователей считают, что при гормонотерапии показатели безрецидивной и общей выживаемости больных РПЖ остаются неизменными в течение нескольких десятилетий (12−24 и 24−36 мес. соответственно) [7]. Гормональная терапия второй и третьей линий, химиотерапия эффективны только в 15−20% наблюдений и не приводят к значительному увеличению продолжительности жизни пациентов, сопровождаясь при этом существенными побочными эффектами [8–10]. Именно поэтому разработка новых методов лечения для подобной категории пациентов является важной научно-практической задачей.
Таблица. Динамика уровня ПСА после HIFU-терапии.
Следует отметить, что в настоящее время не разработаны тактика и стратегия ведения больных РПЖ с
учетом внедренных в практику новых малоинвазивных технологий, не существует клинически обоснованных рекомендаций применения новых методик, окончательно не определены роль и место HIFU-терапии РПЖ и местных рецидивов после РПЭ и ДЛТ. На сегодняшний день опубликованы долгосрочные [11] и среднесрочные результаты [5, 12–16] HIFU-терапии РПЖ. По данным европейского многоцентрового исследования [5], включившего 559 пациентов с РПЖ группы низкого и умеренного рисков, отрицательный результат биопсии после HIFU-терапии был получен для 87,2% больных. А. Blana и соавт. [11] оценили результаты HIFU-терапии 146 пациентов со средним периодом наблюдения 22,5 мес. Средний дооперационный уровень ПСА составил 7,6 нг/мл, в то время как средний уровень ПСА через 3 мес. после лечения – 0,07 нг/мл.
Нами проанализированы результаты HIFU-терапии 748 пациентов РПЖ. Рассчитанная 5-летняя безрецидивная выживаемость по Каплан–Мейеру составила 95,5% в группе с низким риском прогрессирования, 75% – в группе с высоким риском прогрессирования и 80,4% – в группе пациентов
после РПЭ и ДЛТ. В нашем исследовании в целом HIFU-терапия оказалась успешной для 90,9% пациентов. При этом отмечены умеренно выраженные краткосрочные побочные эффекты. Очевидно, что требуются более длительные наблюдения для всесторонней оценки эффективности HIFU-терапии
пациентов с РПЖ.
Заключение. HIFU-терапия является безопасным, малоинвазивным методом лечения локализованного
и местно-распространенного рака предстательной железы. HIFU-терапия может также с успехом применяться у пациентов с местным рецидивом РПЖ после РПЭ и ДЛТ.


