Введение. В настоящее время среди возможных вариантов лечения локализованного рака предстательной железы (РПЖ) все большее значение приобретают малоинвазивные методики, одной из которых является высокоинтенсивная сфокусированная ультразвуковая аблация простаты (HIFU – High Intensity Focused Ultrasound). Данный способ лечения особенно актуален для больных пожилого и старческого возраста с отягощенным соматическим статусом, желающих получить эффективное лечение при сохранении достойного качества жизни [2–8]. В представленной работе мы хотели бы поделиться опытом выполнения подобных операций.
 Материалы и методы. В клинике урологии СГМУ им. В. И. Разумовского метод HIFU-аблации для лечения локализованного РПЖ применяется с февраля 2009 г. Результаты и эффективность лечения мы проанализировали у 112 больных морфологически доказанным по данным биопсии локализованным РПЖ. Средний возраст пациентов составил 66,3±5,83 года. В зрелом социально активном возрасте (до 60 лет) находилось 36,6% пациентов (41 человек), в пожилом и старческом возрасте – 63,4% (59 человек).
Материалы и методы. В клинике урологии СГМУ им. В. И. Разумовского метод HIFU-аблации для лечения локализованного РПЖ применяется с февраля 2009 г. Результаты и эффективность лечения мы проанализировали у 112 больных морфологически доказанным по данным биопсии локализованным РПЖ. Средний возраст пациентов составил 66,3±5,83 года. В зрелом социально активном возрасте (до 60 лет) находилось 36,6% пациентов (41 человек), в пожилом и старческом возрасте – 63,4% (59 человек).
Показания к HIFU-аблации: локализованный РПЖ (стадии Т1-Т2сN0M0) у пациентов, которым невозможно выполнить радикальную простатэктомию ввиду:
- Наличия противопоказаний.
- Соматически отягощенного фона.
- Если пациент после ознакомления со всеми вариантами лечения отказался от них и выбрал аблативную технологию.
- Градация опухоли по шкале Глисона в сумме не более 7 баллов.
- Низкий или умеренный онкологический риск по классификации А. D'Аmico (2003).
- Уровень простатспецифического антигена (ПСА) общей фракции до 20 нг/мл.
- Исходный объем простаты не более 50 см3.
- Подписанное информированное согласие на выполнение HIFU-аблации простаты.
Показания к HIFU-аблации: локализованный РПЖ (стадии Т1–Т2сN0M0) у пациентов, которым невозможно выполнить радикальную простатэктомию ввиду наличия противопоказаний, соматически отягощенного фона; отказ от предложенных вариантов лечения и выбор аблативной технологии; градация опухоли по шкале Глисона в сумме не более 7 баллов; низкий или умеренный онкологический риск по классификации А. D'Аmico (2003); уровень общего простатспецифического антигена (ПСА) менее 20 нг/мл; исходный объем простаты не более 50 см3. Все пациенты подписали информированное согласие на выполнение HIFU-аблации простаты.

Противопоказаниями являлись: утолщенная стенка прямой кишки (более 8 мм по данным трансректального УЗИ), наличие ректоуретральных фистул; наличие инородных тел между простатой и прямой кишкой (металлические клипсы и др.); объем ампулы прямой кишки менее 50 см3; отсут-ствие прямой кишки; наличие в предстательной железе кальцинатов размером более 1 см; аллергическая реакция на латекс.
Пациенты проходили стандартное клиническое обследование. Перед выполнением HIFU-аблации диагноз был морфологически верифицирован с помощью трансректальной мультифокальной биопсии под ультразвуковым наведением либо при патогистологическом исследовании ткани простаты, полученной при трансуретральной резекции. По результатам биопсии опухолевый процесс был выявлен в обеих долях простаты у 60% пациентов, в правой доле – у 10,8%, в левой – у 22,5%.
 У 6,8% пациентов наличие злокачественной опухоли выявлено при трансуретральной резекции простаты (ТУРП), выполненной по поводу аденомы предстательной железы.
У 6,8% пациентов наличие злокачественной опухоли выявлено при трансуретральной резекции простаты (ТУРП), выполненной по поводу аденомы предстательной железы.
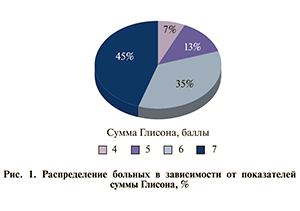
В ходе морфологического исследования биопсийного материала также произведена оценка степени дифференцировки опухолевых клеток. Наиболее часто встречались умеренно-дифференцированные опухоли (85,4 %), сумма баллов по шкале Глисона колебалась от 4 до 7 (рис. 1).
Для установления стадии заболевания на дооперационном этапе использована классификация ТNМ, редакция 2009 г. (табл. 1).
Средний уровень ПСА на дооперационном этапе – 9,6±3,4 нг/мл, Средний объем простаты – 33±7,7 см³.
По степени онкологического риска (по А. V. D'Аmico, 2003) больные распределены следующим образом:
Локализованный РП (T1–T2N0M0):
- низкий онкологический риск (Т1а–с, ПСА<10 нг/мл, Глисон <6) – 14 пациентов;
- умеренный риск (Т2а–с, ПСА 10–20 нг/мл, Глисон – 6–7) – 98 пациентов.
Методика проведения HIFU-аблации простаты. Сущность оперативного пособия заключается в воздействии на ткань предстательной железы сфокусированными ультразвуковыми волнами частотой 3 МГц. Операция выполняется в положении больного на правом боку под спинальной анестезией на специально оборудованном столе.
В прямую кишку вводится зонд-аппликатор, излучающий высокоинтенсивные, конвергирующие ультразвуковые волны. Последние абсорбируются на площади мишени, оказывая механическое в виде кавитации и термического воздействия и не повреждая тканей вне зоны излучения. В определенной точке, где происходит фокусирование лучей, повышается локальная температура (от 85 до 90 °С), что приводит к деструкции клетки.
За счет термического воздействия в течение нескольких секунд происходит коагуляционный некроз участка ткани. Зона разрушения при каждом воздействии составляет до 26 мм по высоте и 1,7 мм в диаметре. Путем поэтапного воздействия на всю простату достигается некроз железы с последующим замещением его соединительной тканью, что позволяет ликвидировать патологический процесс. Контроль расстояния между датчиком и стенкой прямой кишки осуществлялся в режиме реального времени в комбинации с автоматической коррекцией расположения фокальной точки, что позволяет обеспечивать безопасное и точное позиционирование. Для предотвращения термического поражения стенки прямой кишки использована интегрированная система охлаждения.
Следует отметить, что всем больным перед сеансом HIFU-аблации выполнена трансуретральная резекция простаты (ТУРП) для уменьшения объема предстательной железы, что делает последующую HIFU-терапию более радикальной. Дренирование мочевого пузыря в послеоперационном периоде осуществлено уретральным катетером.
Для детальной оценки изменения состояния ткани простаты в послеоперационном периоде применяли трансректальное УЗИ в комбинации с допплерографией и магнитно-резонансную томографию (МРТ) органов малого таза. МРТ проводилась на аппарате Philips Achieva 1,5 Тл в модифицированной программе Т2/TSE с параметрами (TR=3500 мс; TE=120 мс; турбо-фактор=7; матрица=512 384; FOV=400мм; толщина среза – 3 мм), количество срезов – от 26 до 30 в зависимости от размера железы. На серии магнитно-резонансных (МР) томограмм органов малого таза, взвешенных по Т1 и Т2 в трех проекциях, оценивались размеры предстательной железы, ее контуры, структура, наличие патологических узловых образований, их локализация, интенсивность, размеры. МР-анатомия предстательной железы изучалась в Т1 ВИ, а наличие патологических образований – в Т2 ВИ. Кроме того, обращали внимание на состояние капсулы простаты, оценивали семенные пузырьки, мочевой пузырь и их размеры, в том числе стенки пузыря. Изучали взаимоотношение предстательной железы с соседними органами (с семенными пузырьками, прямой кишкой, мочевым пузырем). Оценивали состояние окружающей парапростатической клетчатки, регионарных лимфатических узлов.
У пациентов с умеренным онкологическим риском применялась методика МРТ с динамическим контрастированием, которая заключалась в введении контрастного препарата (омнискан, дотарем) в стандартной дозировке (0,2 мл/кг массы тела). После введения контрастного вещества выполняли серию из двух динамических сканов на 1-й минуте и по одному скану на 2-й и 5-й минутах. По мере реконструкции каждого скана проводили автоматическое вычитание преконтрастного скана из каждого постконтрастного с построением субтракционных изображений.
Аксиальную Т2-ВИ-последовательность оценивали на наличие участков гипоинтенсивного сигнала в периферической или переходной зоне железы, динамическую МРТ – на наличие участков, накапливающих контрастное вещество на субтракционных изображениях. Особое внимание уделялось участкам с ранним (в 1–2-ю мин после введения контрастного вещества) интенсивным усилением сигнала. При обнаружении таких очагов исследовали динамику контрастного усиления путем построения кривой интенсивность–время. Для этого в области подозрительного очага выбирали зону интереса округлой или полициклической формы, соответствующей форме очага. Градиент контрастного усиления оценивали в относительных единицах (процентах) в автоматическом режиме при построении кривой. Выделяли три типа кривых: первый тип – линейный или близкий к нему, означающий непрерывное накопление контрастного вещества в течение длительного времени (до 7–10 мин); второй тип – раннее интенсивное усиление (в 1–2-ю минуту) с последующим плато (отсутствием динамики); третий тип – раннее интенсивное усиление с последующим вымыванием контрастного вещества начиная со 2–3-й минуты.

Результаты. Всего проведено 112 сеансов HIFU-аблации простаты. Среднее количество импульсов воздействия – 634±176, средний объем тканей, подвергнутых воздействию, – 34,6±15,2 см³ за 1 процедуру. Среднее время операции – 125 мин (от 90 до 165 мин). Послеоперационный койко-день колебался от 7 до 14 дней и в среднем составил 10±0,8 дня. Интраоперационных осложнений во время HIFU-аблации нами не отмечено. Уретральный катетер удаляли в среднем через 5 дней после операции. В течение первых дней после удаления уретрального дренажа наблюдались учащение мочеиспускания, а также императивные позывы у 54% больных. Средняя скорость мочеиспускания составила 16±2 мл/с через 2 недели и 18±1,5 мл/с – через 6 мес после операции.
Среди нежелательных эффектов в послеоперационном периоде у 15% пациентов после HIFU были отмечены незначительная боль и дискомфорт в области промежности, которые не требовали обезболивания и самостоятельно купировались в среднем на 2-е сутки после лечения. У 2 (1,7%) пациентов отмечены явления острого орхоэпидидимита, купированного консервативно, у 5 (4,4%) – непродолжительная гематурия. Следует отметить, что ни у одного из пациентов не наблюдалось ожогов слизистой прямой кишки; не потребовалось экстренных оперативных вмешательств после HIFU-терапии.
Стрессовое недержание мочи 1-й степени отмечено у 10,2% больных, 2-й – у 8,5 % пациентов непосредственно после процедуры. Ни у одного больного не наблюдалось тотального недержания мочи. Максимально ургентное недержание мочи сохранялось до 5±1,5 мес после лечения. Обструкция нижних мочевыводящих путей в связи со стриктурой уретры и склерозом шейки мочевого пузыря развилась у 19 (16,9%) пациентов в разные сроки после сеанса HIFU, что потребовало проведения эндоуретротомии и/или ТУР шейки мочевого пузыря. Частота обструкции нижних мочевыводящих путей была достоверно выше в группе пациентов, у которых перед HIFU предшествовал ТУРП в тот же день или за 2 дня до HIFU, по сравнению с пациентами, у которых ТУРП предшествовал в период более чем 1 мес до HIFU (р=0,032). Эректильная дисфункция развилась у 31,1% пациентов. Следует отметить, что у половины этих больных степень выраженности ее уменьшалась пропорционально времени послеоперационного периода. Так, из 31,1% больных половина через год имела достаточную эрекцию, необходимую для пенетрации. У 100% пациентов наблюдалась утрата эякуляции.
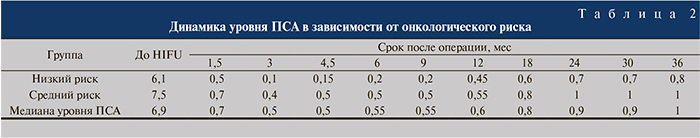
Послеоперационный период наблюдения за больными в среднем составил 36±1,2 мес. Концентрацию ПСА в крови определяли всем пациентам через каждые 1,5 мес в течение 6 мес после операции, в дальнейшем – через каждые 3 мес до года и далее через 6 мес. Средний уровень ПСА через 1,5 мес после операции составлял – 0,7 (0,12–3,67) нг/мл, спустя 3 мес – 0,5 нг/мл. При этом в 26% случаев концентрация ПСА была менее 0,3 нг/мл, в 33% – менее 0,5 нг/мл, в 41% – менее 1 нг/мл (табл. 2).
Минимальный уровень ПСА (nadir) достигнут через 20±2 нед после лечения и в среднем составил 0,26±0,01 нг/мл. При этом в группе пациентов с низким онкологическим риском минимальный уровень ПСА колебался от 0,01±0,09 до 0,4±0,06 нг/мл (медиана – 0,2 нг/мл). В группе пациентов со средним риском уровень ПСА колебался от 0,1±0,02 до 0,5±0,01 нг/мл (медиана – 0,41 нг/мл). Медиана исходного уровня ПСА составила 6,1 и 7,5 нг/мл соответственно.
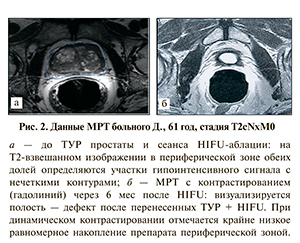
Послеоперационные изменения, по данным МРТ, оценивались через 1, 3, 6 мес послеоперационного периода. Результаты МРТ простаты показали закономерную последовательность изменений после HIFU-терапии. Объем простаты оценивался по Т2-взвешенному изображению, а поврежденные ткани – по снимкам после динамического контрастирования. При этом в большинстве случае спустя 1 и 3 мес визуализировалась центральная изоинтенсивная область, окруженная гиперинтенсивным «кольцом» (рис. 2). Данные признаки выявлены у 75,3% пациентов.
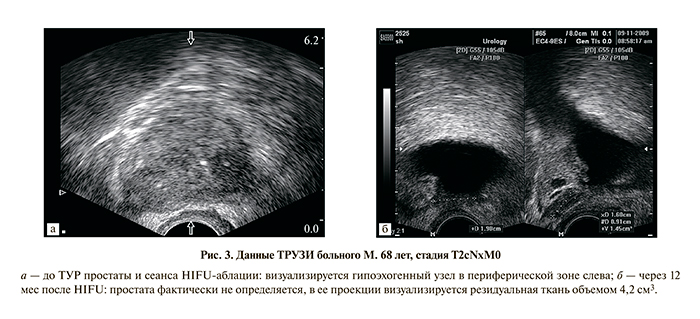
Через 6 мес объем простаты уменьшился в среднем на 49%. Структура железы имела низкую интенсивность сигнала на Т2-взешенных снимках. Отмечено, что степень интенсивности сигнала при МРТ, объем эхогенности ткани простаты при трансректальном УЗИ после лечения коррелирует с достигаемым уровнем сывороточного ПСА (r=0,9 [критерий Спирмена]; р<001) и с объемом простаты через 6 мес (r=0,8 [критерий Пирсона]; р=001). Трансректальное УЗИ выполнено спустя 3, 10, 30 дней, затем через 3, 6, 9 и 12 мес с момента операции. У всех больных в первые дни после HIFU отмечено увеличение простаты в среднем на 56% (от размеров после ТУРП), затем с 10-го дня наметилась тенденция к уменьшению. В дальнейшем размеры простаты постепенно уменьшались, и к 10–12-му месяцу оставалось в среднем 6,5±2,2 см3 железы. Как показало наблюдение, до 3 мес вся ткань простаты на ТРУЗИ визуализировалась в виде неоднородной, преимущественно диффузно-гипоэхогенной структуры. Если до HIFU-патологический очаг определялся в виде гипоэхогенного образования, то далее (в первые дни) последний становился видным менее отчетливо и в дальнейшем не определялся за счет общей гипоэхогенной структуры ткани. Начиная с 6-го месяца после операции в ткани простаты на фоне уменьшения ее объема появляются мелкие диффузные гиперэхогенные участки без акустической дорожки. Оставшаяся ткань в целом характеризуется диффузно пониженной эхоплотностью (рис. 3).
Также совместно с ТРУЗИ в те же сроки всем пациентам проведено цветовое доплеровское картирование. В первые дни (на следующий и через 7 дней после операции) кровоток не определялся почти у всех больных. Наиболее вероятным представляется связь этого с отеком тканей. Значение этого факта подтверждается увеличением простаты в объеме в среднем на 56% от исходного. Отсутствие кровотока в отдаленном периоде наблюдения нами отмечено у 96,4% пациентов (рис. 4).
Для морфологической оценки состояния ткани простаты после лечения и диагностики рецидива рака больным выполняли контрольную биопсию простаты через 12±2 мес после лечения. Исключение составили пациенты, у которых объем резидуальной ткани простаты составлял менее 5 см3 и значение ПСА менее 0,5 нг/мл.
У пациентов с уровнем ПСА более 0,5 нг/мл спустя 6 мес после оперативного лечения контрольную биопсию простаты производили в соответствующие сроки.
Биохимический рецидив определяли как повышение уровня ПСА на 2 нг/мл и более по сравнению с минимальным уровнем после лечения или на 0,75 нг/мл в год и более [1, 4, 5]. К локальному рецидиву заболевания относили случаи, когда пальпировалось уплотнение в проекции простаты и/или отмечались характерные изменения (гипоинтенсивный или гипоэхогенный очаг) в области ложа простаты при МРТ или трансректальном УЗИ в сочетании с повышением ПСА и позитивной биопсии.
Число столбиков было прямо пропорционально резидуальному объему простаты. Помимо стандартных точек дополнительный материал получали из участков, подозрительных по данным цветового допплеровского картирования. Отрицательные результаты биопсии были получены от 85% пациентов.
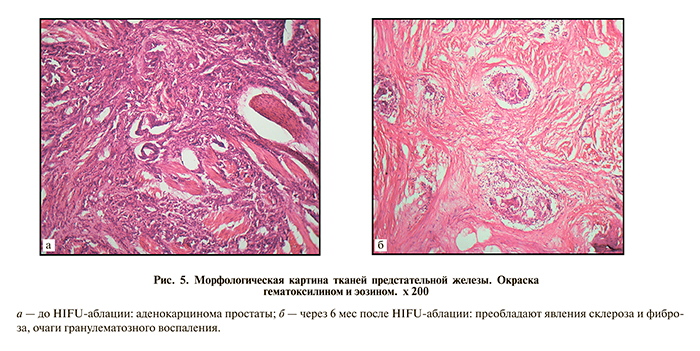
При стандартной окраске гематоксилином и эозином в гистологических препаратах простаты независимо от срока после лечения преобладали склеротические изменения, фиброз занимал 70–90% всей площади материала, что соответствовало лечебному патоморфозу опухоли 3-й и 4-й степеням. В большинстве случаев эпителиальные железы в центре тканей, подвергнутых аблации, были некротизированы. В 75% случаев некроз сопровождался гранулематозным воспалением (рис. 5).
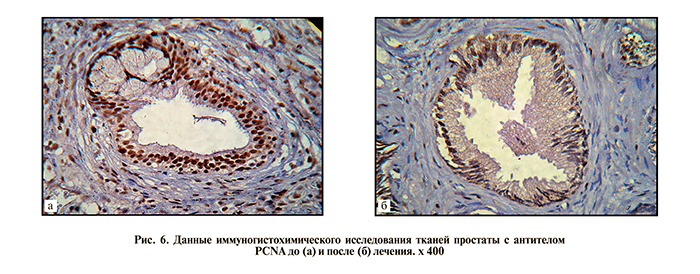
Для оценки пролиферативной активности опухолевых клеток до и после лечения применяли маркер антигена пролиферирующего клеточного ядра (PCNA), учитывая, что пролиферация является кардинальным признаком злокачественных опухолей [9–11]. Установлено, что у 75% экспрессия данного маркера после аблации значительно снижалась (рис. 6).
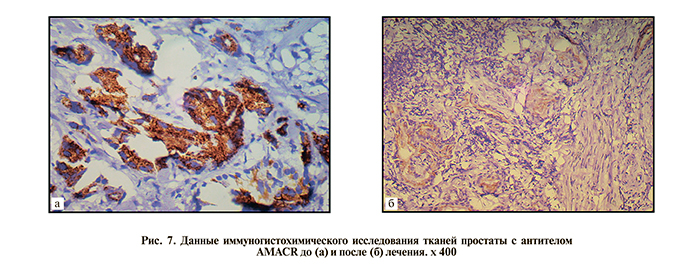
В 86% экспрессия маркера злокачественной трансформации клеток простаты (AMACR) и экспрессия блокатор-апоптоза (Bcl2) после лечения также снижалась (рис. 7).
Безрецидивное течение отмечено у 96 (85,8%) больных. Рецидивы РПЖ выявлены у 16 (14,2%) пациентов: из них у 11 (9,82%) – биохимическое прогрессирование, у 5 (4,46%) диагностирован местный рецидив (подтвержден морфологически). Общая 3-летняя выживаемость в группе низкого онкологического риска составила 100%, онкоспецифическая выживаемость – 100%, безрецидивная выживаемость – 84,7%. В группе умеренного риска 3-летняя безрецидивная выживаемость составила 80,5%, общая выживаемость – 98,7%, онкоспецифическая выживаемость – 100%. В этой группе всего умерли 2 (9,7%) пациента, причиной смерти стали сердечно-сосудистые заболевания (инсульт, n=1; инфаркт миокарда, n=1). В целом показатели выживаемости в данной группе высоки, сопоставимы с таковыми в группе низкого риска.
Заключение. Таким образом, 3-летний опыт использования HIFU-аблации простаты в лечении локализованного рака предстательной железы показал обнадеживающие результаты. Несмотря на незначительный срок наблюдения, не позволяющий сделать однозначные выводы, данный малоинвазивный метод можно расценивать как реальную альтернативу для пациентов с высоким операционно-анестезиологическим риском, а также для больных, отказавшихся от операции. Можно с уверенностью сказать, что новые технологии, в частности HIFU, не пришли на смену хирургическим методам лечения, а лишь заняли свою нишу в лечении пациентов со злокачественными заболеваниями мочеполовой системы.


