Введение. Хронический простатит – самое частое воспалительное заболевание половых органов у мужчин. По данным различных авторов, от 15 до 50% мужчин в разные периоды жизни страдают от симптомов, характерных для хронического простатита [1, 2].
В 10–15% случаев методом стандартного бактериологического посева в секрете простаты и/или постмассажной порции мочи выявляют бактериальную микрофлору. Остальные 85–90% случаев хронического простатита относят к абактериальным. Несмотря на то что бактериальный агент как причина воспаления выявляется нечасто, антибиотики назначают большинству больных хроническим простатитом [1, 3, 4]. Попытки выделить группы пациентов для дифференцированного лечения антибиотиками малоэффективны [5]. В 30–70% случаев антибактериальная терапия неэффективна, и заболевание рецидивирует. О проблеме простатита свидетельствуют данные японских исследователей: более 52% урологов пессимистически относятся к возможности эффективного лечения хронического простатита [6].
Имеются многочисленные публикации о выявлении в секрете и ткани простаты небактериальной, труднокультивируемой и другой (unusual, atypical, cryptic, fastidious) микрофлоры [7–10], однако вопрос об этиологии хронического простатита до настоящего времени остается открытым.
Цель исследования – выявление этиологических агентов хронического абактериального уретропростатита методами углубленной комплексной микробиологической диагностики.
Материалы и методы. Нами проведено обследование 287 пациентов в возрасте от 20 до 62 лет с хроническим рецидивирующим уретропростатитом. В анамнезе все пациенты имели неоднократные курсы лечения, эффект которых был недостаточным. Рецидив заболевания в сроки от 1 до 8 мес выражался усилением симптомов простатита либо отрицательной динамикой лабораторных показателей воспаления в уретре и предстательной железе. У всех обследуемых собирали анамнез, проводили осмотр и пальпацию наружных половых органов, пальцевое ректальное исследование простаты, анкетирование по шкале суммарной оценки симптомов хронического простатита (СОС-ХП), УЗИ предстательной железы. Лабораторная диагностика включала микроскопическое исследование мазка из уретры, секрета простаты, бактериологический анализ секрета методом посева на 5%-ный кровяной агар.
Пациентам, у которых не было выявлено бактериальной микрофлоры методом стандартного бактериологического посева, проведено углубленное микробиологическое обследование в лаборатории сочетанных бактериально-вирусных инфекций и биологического контроля ГУ «РНПЦ эпидемиологии и микробиологии» МЗ Республики Беларусь. Мазок из уретры, секрет простаты у всех пациентов исследовали тремя методами: цитологическим, культуральным, иммунологическим. Диагностика осуществлена на основании принципов доказательной лабораторной диагностики: учтены совпадающие результаты не менее двух лабораторных методов. В отношении части пациентов применена методика предварительного культурального накопления возбудителя (C. trachomatis, T. vaginalis).
Для выявления антигенов C. trachomatis, Herpesvirus, T. vaginalis проведена реакция иммунофлуоресценции (РИФ). Для выявления противохламидийных антител (IgM, IgA, IgG), противотрихомонадных иммуноглобулинов G, для дифференцировки специфических антител к Herpesvirus использован иммуноферментный анализ (ИФА).
Материалом, полученным из урогенитального тракта, инфицировали культуру клеток McCoy. Контроль над развитием хламидийной инфекции осуществлен путем микроскопирования клеток McCoy в инвертированном микроскопе «Biostar» (Австрия) (×400). После инкубации материал окрасили по Романовскому–Гимзе и/или обработали мечеными моноклональными противохламидийными антителами для выявления антигенов C. trachomatis в реакции РИФ. Для дифференциации Herpesvirus использована тест-система для постановки РИФ.
T. vaginalis выявлен методом посева материала из урогенитального тракта на питательную среду для выделения трихомонад-жидкую (СВТ-ж, производство НИИЭМ им. Л. Пастера, Санкт-Петербург). Через 48–96 ч культивирования из осадка изготовлен препарат «раздавленная капля» и завизуализированы трихомонады. Электронно-микроскопическое исследование позволило изучить морфогенез инфекционных агентов, предварительно накопленных в культуре клеток McCoy. Ультратонкие срезы окрашены 1%-ным водным раствором уранилацетата и азотнокислым свинцом. Микроскопирование проведено с помощью электронного микроскопа JEM-100 CX-II («JEOL», Япония) при увеличении 14 000–53 000.
Полимеразная цепная реакция (ПЦР) проведена с помощью диагностических наборов производства НПФ «Литех» и «АмплиСенс» (Россия).
Методику предварительного культурального накопления возбудителя с последующей идентификацией его цитологическим методом и ПЦР применяли в случаях торпидного течения трихомониаза, хламидиоза, при малом количестве микроорганизмов в исследуемом материале. Для накопления C. trachomatis использована культура клеток McCoy, T. vaginalis – СВТ-ж. Результаты накопления T. vaginalis оценивали через 48 ч 9 сут в зависимости от репродуктивной активности различных штаммов трихомонад.
 Статистическая обработка данных проведена на персональном компьютере с помощью программ МО Excel 2003, STATISTICA 6.0 с использованием параметрических (t-критерий Стьюдента) и непараметрических (критерии Mann–Whitney, корреляционный анализ – по Spearman, ANOVA по – Kruskal–Wallis) методов исследования.
Статистическая обработка данных проведена на персональном компьютере с помощью программ МО Excel 2003, STATISTICA 6.0 с использованием параметрических (t-критерий Стьюдента) и непараметрических (критерии Mann–Whitney, корреляционный анализ – по Spearman, ANOVA по – Kruskal–Wallis) методов исследования.
Результаты. Бактериальная микрофлора в секрете предстательной железы в диагностически значимом титре (более 103 КОЕ/мл) выявлена у 83 (28,9%) пациентов. Видовой состав бактерий был представлен в 73,8% случаев грамположительной микрофлорой (Staphylococcus, Streptococcus) и в 26,2% – грамотрицательной (семейство Enterobacteriaceae).
У 204 (71,1%) больных бактериальной микрофлоры не выявлено, что позволило диагностировать абактериальный уретропростатит. Результаты углубленного комплексного микробиологического обследования пациентов с абактериальным воспалением простаты были следующими: C. trachomatis выявлена у 173 (84,8%) человек, T. vaginalis – у 154 (75,5%) и вирусы семейства Herpesviridae – у 140 (68,6%). Сочетанная инфекция встречена у 168 (82,4%) больных: хламидийно-трихомонадная – у 90 (44,1%), трихомонадно-герпетическая – у 17 (8,3%), хламидийно-трихомонадно-герпесвирусная – у 47 (23%). Возбудителей не выявлено у 14 (6,9%) пациентов с абактериальным уретропростатитом.
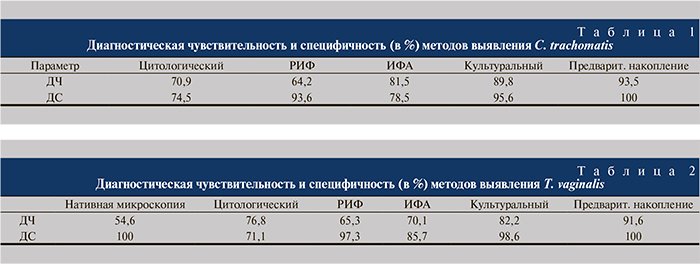
Проведено сравнение диагностической чувствительности (ДЧ) и диагностической специфичности (ДС) различных методов лабораторного выявления T. vaginalis и C. trachomatis. Для диагностики трихомониаза, хламидиоза наиболее эффективной оказалась усовершенствованная методика культурального накопления возбудителя с последующей идентификацией его цитологическим методом и ПЦР. Диагностическая чувствительность и ДС метода ПЦР отдельно нами не определяена, так как он применялся только в комплексе с культуральным накоплением возбудителя. Результаты представлены в табл. 1, 2.
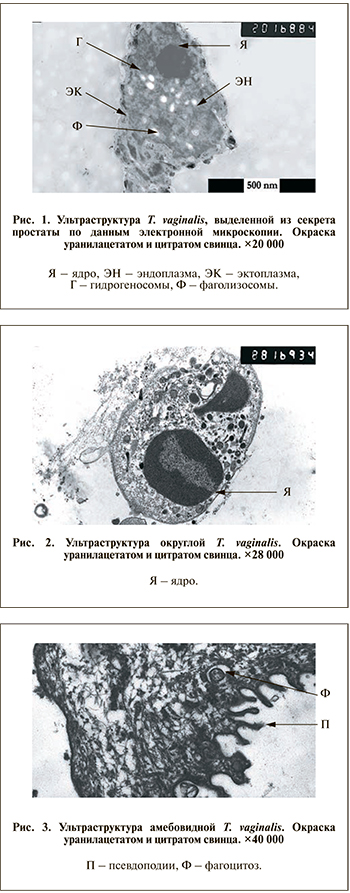
По данным светооптической и электронной микроскопии T. vaginalis была представлена в виде трех основных морфологических форм: жгутиковой, округлой и амебовидной. Жгутики, аксостиль и ундулирующая мембрана у двух последних форм не наблюдались, что значительно затрудняло диагностику трихомониаза методом световой микроскопии мазков. Электронные микрофотографии T. vaginalis, выделенной из секрета предстательной железы, представлены на рис. 1–3.
Обсуждение. За последние годы проводятся исследования, активно обсуждается роль различных микроорганизмов в патологии мочеполовых органов человека. Так, данные большого проспективного исследования указывают на связь между сероположительным статусом на антитела к T. vaginalis и риском распространенного рака простаты [11]. Исследования материала, полученного после аденомэктомии по поводу доброкачественной гиперплазии предстательной железы, показали наличие хламидийного антигена в ткани простаты в 40% случаев [12]. У молодых мужчин с патоспермией выявлены антитела и антигены хламидий в 39,1% случаев, что ассоциировалось со снижением концентрации, подвижности и нарушением морфологии сперматозоидов [13].
До настоящего времени нет четкого определения термина «абактериальный простатит». Анализ данных литературы показал, что под абактериальным в узком смысле понимают простатит, при котором в секрете железы не выявляют патогенных бактерий методом стандартного бактериологического посева. В широком смысле понятие «абактериальный простатит» исключает выявление в простатическом секрете либо другом материале (эякуляте, постмассажной моче, ткани железы) не только бактериальной, но и любой другой инфекции. Таким образом, к возможным причинным агентам бактериального простатита разные авторы относят хламидии, микоплазмы, вирусы, простейшие, хотя все они и не служат таксономически бактериями [1, 10, 14].
К главной проблеме выявления этиологических агентов хронического простатита относится сложность лабораторной диагностики, невозможность идентификации возбудителей стандартными методами. Противоречивость данных о распространенности урогенитальных инфекций можно объяснить применением разных методик обследования, особенностями морфологии микроорганизмов, отсутствием исследования материала из добавочных половых желез (эякулята, секрета простаты).
Исследователи, применившие нерутинные методы обследования, убедительно доказывают этиологическое значение труднокультивируемых микроорганизмов в развитии простатита [15–18]. Обследовав 1352 пациента с хроническим простатитом, V. Skerk и совт. [19] выявили у 324 (24%) из них C. trachomatis в секрете простаты, причем у 89 из них возбудитель определялся только в секрете и отсутствовал в уретре. Методом ПЦР J. Xiao и соавт. [9] обнаружили в секрете простаты различные микроорганизмы, в том числе C. trachomatis, микоплазмы, вирус простого герпеса, цитомегаловирус, вирус папилломы человека, и установили, что тяжесть заболевания, количество лейкоцитов и лецитиновых зерен достоверно зависят от общего количества выявленных микроорганизмов. Используя иммунопероксидазную реакцию, W. Gardner и соавт. [20] доказали наличие T. vaginalis в простатической уретре, подслизистом слое и строме простаты. По данным [21], у 30% мужчин, инфицированных T. vaginalis, возбудитель обнаруживается только в сперме и не обнаруживается в уретре. Проводя ПЦР-диагностику урогенитальных инфекций у пациентов андрологического профиля в группе с клинической картиной уретропростатита, С. А. Костюк и соавт. [22] выявили в уретре и сперме инфекции, передаваемые половым путем, у 73,9% из них, в том числе C. trachomatis – у 50% и T. vaginalis – у 45,4% больных. У трети пациентов возбудитель обнаружен только в эякуляте и отсутствовал в уретре.
Диагностика трихомониаза у мужчин затруднена в связи с низкой чувствительностью микроскопии и отсутствием разрешенных FDA-тестов для проведения ПЦР [23]. Электронно-микроскопические исследования позволили объяснить причины диагностических ошибок, так как изменили представления о строении патогена. Изучению морфологии T. vaginalis с помощью электронного микроскопа был посвящен ряд как отечественных, так и зарубежных работ [24–26]. Все авторы описывают наблюдаемые малоподвижные атипичные формы T. vaginalis, трудно- или не выявляемые при световой микроскопии. S. Rasmussen и соавт. [27] отметили, что трихомонада при посеве становится грушевидной, хотя в действительности паразит имеет амебовидную форму и проявляет адгезию к поверхности клетки и выраженную цитотоксичность по отношению к эпителиальным клеткам половых органов. Наши исследования подтвердили существование мелких амебовидных и округлых морфологических форм T. vaginalis, распознавание которых имеет большое значение в повышении эффективности диагностики трихомониаза [26].
Недостатком многих исследований служит использование только одного метода лабораторной идентификации возбудителей (чаще метода ПЦР) либо узконаправленное выявление одного инфекционного агента. Наши исследования указывают на низкую эффективность использования одного метода обследования на трихомониаз. Наибольшую диагностическую чувствительность и специфичность продемонстрировала методика предварительного культурального накопления возбудителя с последующей идентификацией его цитологическим методом и ПЦР. Высокая частота выявляемости возбудителей урогенитальных инфекций в нашем исследовании объясняется применением комплекса лабораторных методов, идентификацией патогенов в секрете простаты.
Роль выявленных уропатогенов в развитии хронического уретропростатита подтверждают полученные нами результаты этиотропного лечения заболевания. Пациентам последовательно назначали противовирусную, противопротозойную, противохламидийную терапию, в результате которой наблюдалась положительная динамика клинической картины, уменьшение воспалительной реакции. Результаты этиотропного лечения сравнивали с результатами антибактериального лечения по данным рутинного бактериологического посева в контрольной группе больных. После этиотропной терапии рецидивы заболевания в течение года отмечены только у 28,9% пациентов, в то время как после стандартной антибиотикотерапии рецидивы уретропростатита развились у 82,2% больных [28, 29].
Необходимо отметить, что роль выявляемых атипичных микроорганизмов в этиопатогенезе хронического воспаления простаты до конца не ясна. Неизвестны механизмы взаимодействия и вклад каждого из возбудителей сочетанной инфекции в общую картину заболевания.
Возможно, атипичная микрофлора:
- является самостоятельным пусковым фактором развития воспалительного процесса в предстательной железе, который в отсутствие этиопатогенетического лечения обеспечивает столь высокий процент рецидивов заболевания;
- вызывает фоновое заболевание, нарушающее местные механизмы противоинфекционной защиты (способствует нарушению микроциркуляции, питания, развитию фиброзных и других изменений в паренхиме предстательной железы), облегчающее проникновение бактериальной флоры и остающееся после элиминации бактериальных агентов, обеспечивая фон для возникновения рецидивов;
- является активатором аутоиммунных реакций в ткани простаты.
Вызванные атипичной микрофлорой фиброзные изменения в предстательной железе, нарушения гемодинамики, прежде всего венозного оттока, запущенные процессы абактериального неинфекционного воспаления даже после элиминации инфекционного агента могут сопровождаться нарушениями функции органа мочеиспускания, являться причиной болевого синдрома. Лечение заболевания требует применения соответствующих патогенетических методов, а не антибиотикотерапии.
В нашем исследовании лишь у 6,9% пациентов с предварительно установленным диагнозом хронического абактериального уретропростатита не выявлено урогенитальной инфекции, что является патогенетическим обоснованием отказа от антибактериальной терапии этих больных. Таким образом, истинно абактериальным (в широком смысле слова) следует считать только такой простатит, возбудителей которого не удалось выявить методами углубленного, нерутинного микробиологического исследования. Полученные результаты позволяют исключить у большинства больных диагноз «абактериальный простатит» и трактовать его как специфическое воспаление простаты, что имеет ключевое значение в определении тактики лечения хронического рецидивирующего уретропростатита.
Выводы. Атипичная инфекция (хламидийная, герпесвирусная, трихомонадная) играет важную роль в этиологии хронического уретропростатита. Применение углубленных методов лабораторных исследований позволяет диагностировать истинно абактериальный простатит только у 6,9% обследованных больных хроническим уретропростатитом. Лечение хронических простатитов, вызванных атипичной инфекцией, должно предусматривать назначение противовирусных, противотрихомонадных и противохламидийных препаратов по показаниям, а не просто антибиотиков широкого спектра действия.


