Согласно данным литературы, до 70–80% случаев папилломавирусной инфекции (ПВИ) ассоциировано с микробными (условно- и облигатно-патогенными) и вирусными инфекционными агентами, наиболее часто – с вирусами простого герпеса, уреа-, микоплазмами, хламидиями и грибами рода Candida [1–5].
Слизистая оболочка половых органов является пограничным барьером между верхним отделом генитального тракта и внешней средой, постоянно подвергается воздействию повреждающих факторов, среди которых наиболее агрессивное воздействие оказывают инфекции, передаваемые половым путем (ИППП) [6]. Это имеет особое значение при ПВИ, так как ИППП либо способствуют снижению иммунитета, что приводит к активации опухолеродных вирусов, либо предотвращают апоптоз и «допускают» последующую пролиферацию поврежденных клеток [7–9].
Хронический воспалительный процесс, вызванный инфекционными ассоциациями, нарушает деятельность иммунной системы организма, в результате чего снижается уровень интерферонов (ИФН), функциональная активность нейтрофилов, естественных киллеров [10, 11]. Течение ПВИ во многом зависит от состояния иммунного статуса пациента, при этом достичь полной элиминации вируса папилломы человека (ВПЧ) удается не всегда, так как отсутствуют медикаментозные средства, влияющие на этиологический агент заболевания [12–14].
В патогенезе вирусных ИППП, в том числе ПВИ, важное значение имеет система местной иммунной защиты репродуктивного тракта организма, к которой относятся гуморальные факторы, такие как интерлейкины, лизоцим, иммуноглобулины, клеточные факторы (макрофаги, Т-хелперы, В-лимфоциты) и ИФН.
Выделяют два типа ИФН. Тип I, также известный как вирусный, включает ИФН-α (лейкоцитарный), ИФН-β (фибробластный) и ИФН-ω. Тип II, известный как иммунный, представлен ИФН-γ. Продукция вирусных ИФН увеличивается в процессе вирусной инфекции, а синтез ИФН II типа индуцируется мито- или антигенными стимулами. Большинство типов вирусинфицированных клеток способно синтезировать ИФН-α/β в клеточной культуре. Интерферон-γ, напротив, синтезируется только некоторыми клетками иммунной системы, включая естественные киллерные (НК) клетки, CD4 Th1-клетки и CD8-цитотоксические супрессорные клетки.
 Наиболее важное отличие ИФН-γ от других ИФН заключается в иммуномодулирующих свойствах этой молекулы. Он обладает мощным эффектом в отношении активации фагоцитов, не отмеченным для других типов ИФН и включающим генерирование в фагоцитах токсических метаболитов кислорода, способных к внутриклеточному уничтожению микроорганизмов, таких как Staphylococcus aureus, Chlamydia trachomatis, Toxoplasma gondii, Leishmania donovani, Listeria monocytogenes и Mycobacterium avium intracellulare.
Наиболее важное отличие ИФН-γ от других ИФН заключается в иммуномодулирующих свойствах этой молекулы. Он обладает мощным эффектом в отношении активации фагоцитов, не отмеченным для других типов ИФН и включающим генерирование в фагоцитах токсических метаболитов кислорода, способных к внутриклеточному уничтожению микроорганизмов, таких как Staphylococcus aureus, Chlamydia trachomatis, Toxoplasma gondii, Leishmania donovani, Listeria monocytogenes и Mycobacterium avium intracellulare.
Экспериментальные исследования роли ИФН-γ при аногенитальной герпесвирусной инфекции показали, что через 8 ч после внутривлагалищного инфицирования мышей вирусом простого герпеса концентрации ИФН-γ во влагалищных секретах достигли уровней, которые могли быть противовирусными in vitro. Этот быстрый синтез ИФН-γ происходил у иммунокомпетентных мышей, но отсутствовал у иммунокомпрометированных, что указывало на присутствие Т-лимфоцитов памяти. Введение анти-ИФН-γ антител in vivo иммунокомпетентным мышам за 17 ч до вирусного инфицирования блокировало все последующее проявления ИФН-γ и заметно уменьшало иммунитет против повторной инфекции [15, 16].
Кроме того, на уровне отдельных клеток ИФН-γ обладает прямой активностью в отношении другого возбудителя вирусных ИППП – вируса папилломы человека (ВПЧ), ингибируя экспрессию его ранних генов и в целом репликацию. Эта активность проявляется на различных типах клеток и может превосходить антивирусное действие других ИФН. Интерферон-γ активирует такие эффекторные функции клеток, как микробоцидность, продукция цитокинов, супероксидных и нитрооксидных радикалов, а также ингибирует В-клеточный ответ, ИЛ-4, подавляя продукцию IgE и экспрессию CD23-антигена. Препарат блокирует репликацию вирусных ДНК и РНК, синтез вирусных белков и сборку зрелых вирусных частиц, оказывает цитотоксическое воздействие на вирусинфицированные клетки [17, 18].
В настоящее время единственным зарегистрированным в Российской Федерации ИФН-γ является препарат Ингарон, разработанный ООО «НПП “ФАРМАКЛОН”» путем микробиологического синтеза в рекомбинантном штамме E. coli. Показания к применению препарата: генитальная герпесвирусная и папилломавирусная инфекции, опоясывающий лишай (Herpes zoster) – в качестве монотерапии; хронические гепатиты В и С, ВИЧ-инфекция, туберкулез легких, урогенитальный хламидиоз и хронический простатит – в комплексной терапии.
Представляем клиническое наблюдение эффективного и безопасного использования препарата Ингарон в лечении ПВИ, ассоциированной с ИППП.
П а ц и е н т Н. 27 лет обратился с жалобами на отсутствие чувства полного опорожнения мочевого пузыря после мочеиспускания, жжение в мочеиспускательном канале в течение последнего месяца, высыпания на половом члене, сопровождавшиеся ощущением зуда и жжения.
Высыпания на коже полового члена в виде пузырьков пациент впервые обнаружил более 3 лет назад, появление белесоватых пятен в области головки полового члена – 4 мес назад. В связи с самостоятельным исчезновением пузырьковых высыпаний за медицинской помощью не обращался. Появление подобных везикулезных высыпаний больной связывал с половыми контактами и переохлаждением. Высыпания в области головки полового члена в виде пятен в начале их появления не сопровождались субъективными ощущениями, однако в течение последних двух месяцев пациент отмечал появление уплотнения и стягивания кожи в области пятен, дискомфорт во время полового контакта.
Со слов больного, последний половой контакт более 1 мес назад, средства барьерной контрацепции не применяет.
Хронические соматические заболевания пациент отрицает, аллергологический анамнез не отягощен. Общее состояние удовлетворительное. Кожные покровы туловища и конечностей без патологических высыпаний, периферические лимфатические узлы не пальпируются.
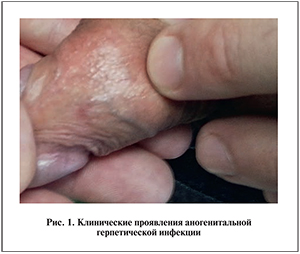
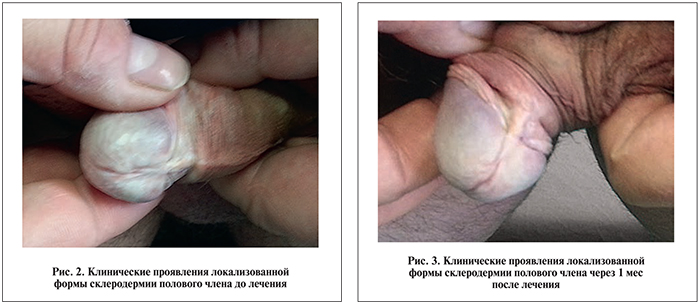
При осмотре половых органов на задней поверхности тела полового члена выявлено округлое гиперемированное, слегка отечное пятно, умеренно болезненное при пальпации; в области головки полового члена – гипопигментированное пятно без четких границ с гиперкератозом на поверхности (рис. 1, 2). Губки уретры отечны, не гиперемированы, отмечается скудное слизистое отделяемое из мочеиспускательного канала. Органы мошонки без видимых патологических изменений. При ректальном исследовании предстательной железы отмечаются умеренная болезненность, пастозность, сглаженность срединной борозды железы.
При микроскопическом исследовании отделяемого из уретры выявлены лейкоциты (7–10 в поле зрения), единичные грамположительные кокки; внутриклеточные диплококки и трихомонады не обнаружены.
Методом ПЦР идентифицированы C. trachomatis, ВПЧ высокого онкогенного риска, вирус простого герпеса 2-го типа (при исследовании соскоба с кожи в области гиперемированного пятна).
По результатам микроскопического исследования секрета простаты обнаружены лейкоциты до 20–25 в поле зрения, по результатам бактериологического исследования – E. сoli в количестве >105 КОЕ/мл.
При трансректальном УЗИ отмечено увеличение размера, объема и диффузное снижение эхогенности предстательной железы.
Исследование интерферонового статуса выявило недостаточность системы ИФН по продукции ИФН-γ: 60 ЕД/мл при норме 128–256 ЕД/мл.
 Пациенту был установлен диагноз «хламидийная инфекция органов малого таза, бактериальный уретропростатит. Аногенитальная герпетическая инфекция, рецидив. Локализованная склеродермия полового члена. Папилломавирусная инфекция, латентная форма» и проведена терапия по схеме: доксициклин 100 мг 2 раза в сутки в течение 14 дней, далее офлоксацин 400 мг 2 раза в сутки в течение 14 дней; ИФН-γ (Ингарон) 500 тыс. МЕ 1 раз в сутки через день подкожно, на курс 5 инъекций; бетаметазон-крем наружно на очаги склероатрофического лихена 2 раза в сутки в течение 14 дней, далее 1 раз в сутки в течение 14 дней.
Пациенту был установлен диагноз «хламидийная инфекция органов малого таза, бактериальный уретропростатит. Аногенитальная герпетическая инфекция, рецидив. Локализованная склеродермия полового члена. Папилломавирусная инфекция, латентная форма» и проведена терапия по схеме: доксициклин 100 мг 2 раза в сутки в течение 14 дней, далее офлоксацин 400 мг 2 раза в сутки в течение 14 дней; ИФН-γ (Ингарон) 500 тыс. МЕ 1 раз в сутки через день подкожно, на курс 5 инъекций; бетаметазон-крем наружно на очаги склероатрофического лихена 2 раза в сутки в течение 14 дней, далее 1 раз в сутки в течение 14 дней.
По результатам контрольного осмотра пациента через 7 дней после завершения терапии клинические проявления генитального герпеса отсутствовали, в области головки полового члена сохранялось гипопигментированное пятно с уменьшением инфильтрата в основании и явлений гиперкератоза на поверхности. Патологических изменений в области наружного отверстия мочеиспускательного канала и органов мошонки не выявлено.
В отделяемом из уретры определялись единичные лейкоциты (1–2 в поле зрения); внутриклеточные диплококки и трихомонады не обнаружены.
После купирования воспалительных явлений в органах мочеполовой системы с целью прогнозирования течения ПВИ пациенту было дополнительно проведено исследование методом ПЦР в реальном времени для идентификации генотипа ВПЧ высокого онкогенного риска и определения вирусной нагрузки. По результатам исследования был идентифицирован ВПЧ 39-го генотипа в количестве 5,2 lg копий ДНК на 100 тыс. клеток.
С учетом сохранения клинических проявлений локализованной склеродермии полового члена пациенту было рекомендовано продолжить терапию по схеме: гиалуронидаза 64 ЕД внутримышечно 1 раз в сутки через день, на курс 20 инъекций; ксантинола никотинат 150 мг перорально 3 раза в сутки в течение 1 мес; аевит 1 капсула 1 раз в сутки в течение 1 мес; такролимус 0,1%-ная мазь наружно на очаги склероатрофического лихена 2 раза в сутки в течение 1 мес.
Лечение пациент перенес хорошо, побочных явлений во время лечения не отмечал.
При осмотре пациента через 1 мес после проведенного лечения в области головки полового члена выявлено гипопигментированное пятно округлой формы без четких границ, эластичное, без признаков инфильтрации в основании и явлений гиперкератоза на поверхности (рис. 3). Патологические изменения в области наружного отверстия мочеиспускательного канала и органов мошонки отсутствовали. При ректальном исследовании предстательной железы болезненность не определялась, консистенция железы эластичная, срединная борозда определялась четко.
При микроскопическом исследовании отделяемого из уретры выявлены единичные лейкоциты; внутриклеточные диплококки и трихомонады не обнаружены. Результаты исследования методом ПЦР на C. trachomatis и вирус простого герпеса – отрицательные, на ВПЧ высокого онкогенного риска 39-го генотипа – 4,0 lg копий ДНК на 100 тыс. клеток.
По результатам лабораторных исследований секрета предстательной железы выявлены лейкоциты (2–3 в поле зрения), скудное количество эпителиальных клеток, обильное количество лецитиновых зерен и амилоидных телец; патогенные и условно-патогенные микроорганизмы в диагностически значимом титре не выявлены.
Ультразвуковых признаков патологии предстательной железы на момент контрольного обследования не выявлено: контур ровный, четкий, симметрия сохранена; размеры: 29х42х39 мм, объем 25 см³; эхогенность равномерная; структура мелкозернистая; васкуляризация без особенностей.
С учетом сохранения клинических проявлений локализованной склеродермии полового члена пациенту было рекомендовано продолжить наружное лечение 0,1%-ной мазью такролимус 2 раза в сутки в течение 3 мес.
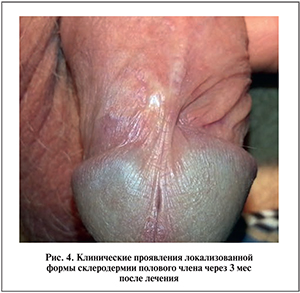
При осмотре пациента через 3 мес после проведенного лечения клинические проявления генитального герпеса отсутствовали, в области уздечки полового члена определялось гипопигментированное пятно линейной формы длиной до 1 см эластичное, без признаков инфильтрации в основании и явлений гиперкератоза на поверхности (рис. 4).
При микроскопическом исследовании отделяемого из уретры патологии не выявлено. Результат исследования методом ПЦР на ВПЧ 39-го генотипа отрицательный.
По данным исследования интерферонового статуса, недостаточности системы ИФН по продукции лейкоцитами крови ИФН-γ не выявлено.
В настоящее время многими учеными доказана роль врожденного и приобретенного иммунитета в патогенезе хронических воспалительных заболеваний урогенитального тракта [19, 20]. Интерфероны представляют собой наиболее изученную группу цитокинов (медиаторов иммунитета). Синтез ИФН-α свойствен большинству клеток и тканей организма, ИФН-β синтезируется фибробластами и макрофагами, в то же время ИФН-γ вырабатывается только клетками иммунной системы, включая натуральные киллеры (NK-клетки), Т-хелперы и Т-супрессоры. Интерферон-γ стимулирует врожденный клеточный иммунитет через NК-клетки, активирует макрофаги, а также специфический цитотоксический иммунитет, основанный на распознавании экспрессированных вирусных антигенов на поверхности клетки в ассоциации с белками главного комплекса гистосовместимости. Это имеет важное значение в противовирусном и антимикробном действиях ИФН-γ.
Сочетание ПВИ с другими ИППП способствует хронизации инфекционно-воспалительного процесса на фоне нарушения общего и местного иммунитета, в связи с чем при выявлении ПВИ клиническими и/или лабораторными методами исследования необходимо исключать сопутствующие ИППП, особенно при наличии воспалительных проявлений урогенитального тракта (уретрит, вульвовагинит, кольпит, эндоцервицит).
Герпетическая инфекция также считается иммунозависимым заболеванием. Основными препаратами, блокирующими репликацию вируса простого герпеса, являются ациклические нуклеозиды, применение которых ускоряет разрешение клинических проявлений и уменьшает выраженность симптомов, однако не приводит к эрадикации вируса и не всегда влияет на частоту и тяжесть развития рецидивов в последующем. Для уменьшения частоты рецидивов генитального герпеса рекомендовано применение ИФН системного действия [21, 22].
Пациенты со склероатрофическими процессами в области половых органов находятся в зоне риска развития онкологической патологии, ассоциированной с ВПЧ высокого онкогенного риска, так как вирус попадает в дистрофические измененные ткани и это может стать пусковым механизмом развития онкологической патологии в участке поражения [23–25].
Известно, что при персистирующей ПВИ снижение количественных показателей содержания ВПЧ высокого онкогенного риска более чем на 1 lg копий ДНК на 100 тыс. клеток является благоприятным прогностическим фактором течения инфекционного процесса, что и было достигнуто в описанном клиническом наблюдении: после проведения комплексной терапии с включением препарата ИФН-γ количественные показатели содержания ВПЧ 39-го генотипа снизились с 5,2 до 4 lg копий ДНК на 100 тыс. клеток с последующей эрадикацией ВПЧ. Кроме того, за время наблюдения у пациента не было зарегистрировано рецидивов аногенитальной герпесвирусной инфекции. Полученные результаты свидетельствуют об эффективности комплексной терапии вирусных ИППП с применением ИФН-γ.
Применение препарата Ингарон в комплексной терапии папилломавирусной инфекции, ассоциированной с инфекциями, передаваемыми половым путем, позволило восстановить исходные иммунные нарушения и повысить эффективность проводимого лечения.



