Анатомическая близость толстой кишки и элементов мочевыделительной системы, общность их иннервации позволяют понять, почему именно здесь происходит пересечение профессиональных сфер интересов урологов о колопроктологов. Именно тесная анатомическая взаимосвязь данных органов во многом предрасполагает к возникновению как органических, так и функциональных осложнений после операций на органах брюшной полости и малого таза.
Риск повреждения мочевыводящих путей существует и при нормальном топографоанатомическом взаимоотношении органов, но значительно увеличивается при наличии выряженного спаечного процесса как результата предшествующих оперативных вмешательств, воспалительных заболеваний толстой и тонкой кишки (язвенный колит, болезнь Крона), изменяющиего анатомические слои [1]. Не меньший вклад в изменение анатомии органов брюшной полости и малого таза вносят онкологические поражения, особенно при местнораспространенных опухолях, предшествующая лучевая терапия, а также наличие аномалий верхних мочевых путей (например, удвоение мочеточника, дистопия почки и т.д.).
Возможные последствия колоректальных пособий для органов мочевыделительной системы могут носить как функциональный, так и органический характер. Нередко больные колопроктологического отделения после выписки становятся пациентами уролога, приходя на прием с жалобами на затрудненное мочеиспускание, эректильную дисфункцию, вызванные повреждением элементов вегетативной нервной системы в ходе оперативного пособия. Кроме того, уже в раннем послеоперационном периоде пациентам колопроктологов может понадобиться консультация уролога. Речь идет об острой задержке мочеиспускания (ОЗМ), причиной которой может быть боль в области послеоперационной раны, ограничивающей возможности самостоятельного мочеиспускания пациента, не получающего адекватного обезболивания. Другой причиной задержки мочеиспускания может быть исходное наличие сопутствующей гиперплазии предстательной железы, симптомов нижних мочевых путей. Эффективными способами предотвращения ОЗМ являются своевременная установка уретрального катетера, адекватное обезболивание и ранняя активизация пациентов. Кроме того, как было показано в научной работе, выполненной в клинике урологии Первого МГМУ им. И.М. Сеченова, назначение α-адреноблокаторов на предоперационном этапе и продолжение их приема пациентом после операции снижают риск развития ОЗМ с 17% до 2,3% [2].
Если говорить об органических осложнениях, то в первую очередь необходимо назвать повреждение мочеточника, частота которого в ходе колоректальных операций варьируется от 1 до 10% [3–5]. По мере накопления статистических данных по результатам лапароскопических вмешательств стали появляться исследования, посвященные сравнению частоты повреждения мочеточника при выполнении открытых и лапароскопических пособий. Так, авторским коллективом из Дании было показано, что наиболее часто интраоперационная травма мочеточника имеет место при лапароскопических пособиях по поводу колоректального рака [6]. Чаще всего мочеточник травмируется при выделении боковой стенки прямой кишки в области тазовых сплетений, в ходе выполнения мезоколонэктомии, выделении ретроцекального аппендикса, несколько реже – при обработке нижней брыжеечной артерии (повреждение в основном средней трети мочеточника).
Предотвратить ятрогенное повреждение мочеточника можно путем его стентирования на дооперационном этапе или непосредственно перед основной операцией. Было показано, что предоперационное стентирование не приводит к возникновению каких-либо дополнительных неблагоприятных последствий в виде инфекционных осложнений, ятрогенной травмы органа или значительного увеличения продолжительности основного оперативного пособия [7, 8]. Более того, в исследовании G. da Silva и соавт. [3] продемонстрировано, что профилактическое стентирование не только является безопасной и экономически оправданной процедурой, но и должно рассматриваться как необходимый этап подготовки пациента к технически сложной продолжительной операции. Профилактическое стентирование мочеточника при лапароскопической операции помогает идентифицировать его визуально, а при открытой операции — не только визуально, но и пальпаторно. Не меньшим достоинством профилактического стентирования является тот факт, что при возникшей травме органа восстановление его целостности также выполняется на стенте.
Если говорить о некоторых правилах, соблюдение которых поможет избегать повреждения мочеточника, то прежде всего следует быть предельно внимательным при пересечении сосудов, находящихся в непосредственной близости от мочеточника, например нижней брыжеечной артерии, — не следует пересекать ее, предварительно не определив ее взаимоотношения с мочеточником. Интраоперационно идентифицировать мочеточник можно по перистальтической волне или «цистоидному сокращению», которое возникает в ответ на бережное зажатие мочеточника между браншами инструмента (признак Келли). Однако, заметим, что данный признак может не выявляться на дилатированном мочеточнике. В целом, для того чтобы избежать повреждения мочеточника во время операции, особенно если планируется значительное по объему и трудное по техническому исполнению оперативное пособие, необходимо определить индивидуальные топографоанатомические особенности пациента, выполнив на предоперационном этапе мультиспиральную компьютерную томографию (МСКТ) с контрастированием, МРТ в режиме урографии. В совокупности с профилактическим стентированием все эти мероприятия призваны уменьшить риск интраоперационной травмы мочеточника.
Диагностика повреждения мочеточника может осуществляться как интраоперационно, так и на послеоперационном этапе. При подозрении на травму органа в ходе операции можно выполнять ревизию забрюшинного пространства с прямым визуальным контролем целостности мочеточника на протяжении, а также ввести внутривенно красящий раствор, например индигокармин, и выявить его истечение из области повреждения мочеточника в среднем через 3–5 мин. После операции важным признаком нарушения целостности полостной системы верхних мочевых путей является увеличение концентрации креатинина и мочевины в биохимическом анализе отделяемого по дренажам. С помощью УЗИ можно выявить расширение чашечно-лоханочной системы, что косвенно указывает на нарушение оттока мочи из почки, которое могло возникнуть, например, при неумышленной перевязке мочеточника на стороне расширения. Клиническими проявлениями травмы мочеточника могут быть следующие:
- боль в пояснице, фланковых областях живота на стороне повреждения (симптом возникает на 0–21-й день после повреждения);
- лихорадка (0–21-й день);
- симптомы раздражения брюшины (0–7-й день);
- анурия (менее 24 ч после травмы);
- формирование свищей (0–30-й день);
- асимптоматическое течение (случайная находка).
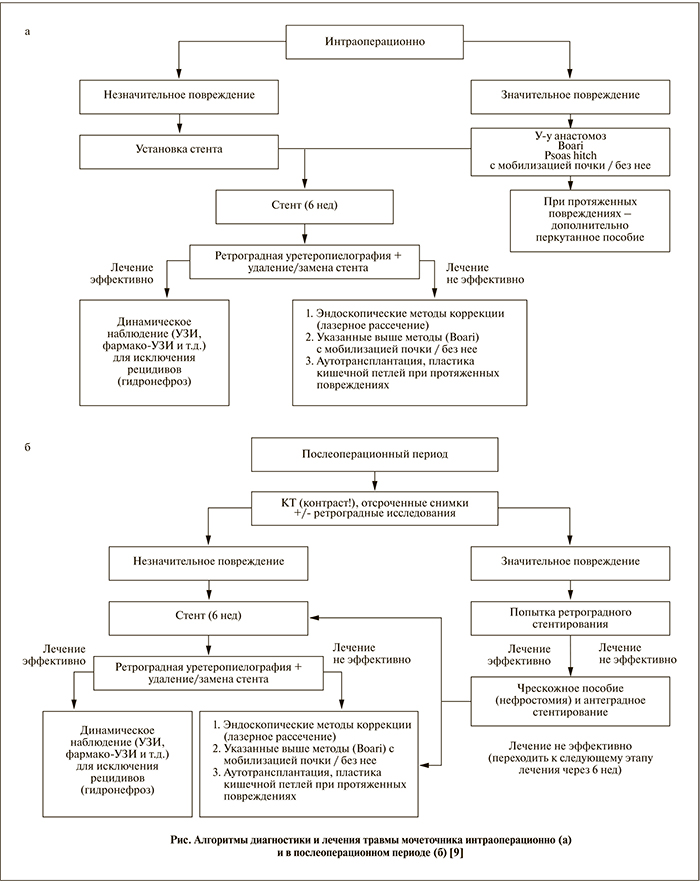
В целом алгоритм диагностики и лечения повреждений мочеточника на разных этапах можно представить следующим образом (см. рисунок).
Для восстановления целостности мочеточника необходимо соблюдать ряд правил [10], которые позволят избежать послеоперационных осложнений, а именно:
- прежде чем выполнять анастомоз, необходимо провести спатуляцию свободных концов, что позволит уменьшить вероятность возникновения стриктуры в области анастомоза;
- непрерывность мочеточника необходимо восстанавливать на стенте;
- использовать рассасывающийся шовный материал 4/0, 5/0, поскольку нерассасывающийся приводит к образованию лигатурных камней;
- при затягивании швов следует избегать натяжения;
- завершающим этапом операции должна быть установка дренажей в область анастомоза.
Интраоперационное повреждение мочеточника может стать следствием пересечения, перевязки, деваскуляризации или использования различных видов энергии. Пересечение мочеточника можно диагностировать интраоперационно и восстановить его целостность путем выполнения первичного уретероуретероанастомоза по типу «конец в конец» с предварительной спатуляцией свободных концов.
Другой вид травмы мочеточника — перевязку — можно диагностировать как интраоперационно, так и на послеоперационном этапе. Если в ходе операции мочеточник был перевязан, достаточно снять лигатуру и провести его стентирование в среднем на 1 мес. По прошествии 3 мес необходимо выполнить УЗИ или урографию для выявления возможной стриктуры данной области. Если стриктура не развилась, то стент извлекают, а за пациентом ведется динамическое наблюдение. В случае формирования стриктуры на месте бывшей лигатуры необходимо оперативное лечение с учетом уровня повреждения мочеточника. В ситуации, когда клинические проявления перевязки мочеточника возникли после операции, можно также провести стентирование верхних мочевых путей или при невозможности последнего выполнить пункционную нефростомию для восстановления оттока мочи из почки, а затем не ранее чем через 3 мес, в «холодном периоде», решать вопрос об оперативном лечении.
Наиболее сложной в плане интраоперационной диагностики является деваскуляризация мочеточника, которая может возникнуть при выделении последнего на протяжении. Такие критерии нарушения кровотока в стенке органа, как ее локальное побледнение, исчезновение перистальтики в данном сегменте и отсутствие кровоточивости в месте деваскуляризации при пересечении, являются весьма субъективными. Наиболее часто о возможном нарушении кровоснабжения в стенке мочеточника говорят ретроспективно, когда появляются клинические признаки нарушения уродинамики по причине развития стриктуры в данной области.
С внедрением в практику хирурга высокотехнологичного оборудования хирурги стали говорить о травме мочеточника в ходе использования различных видов энергии, т.е., по сути, о термическом повреждении. Обычно данный вид травмы диагностируется в послеоперационном периоде и клинически проявляется формированием либо фистулы, либо стриктуры. Вид оперативного пособия в данном случае также подбирают с учетом уровня повреждения, о чем речь пойдет ниже. По причине более высокой вероятности повреждения мочеточника в ходе использования монополярных инструментов в настоящее время все большее число хирургов пытается найти им альтернативу. Несколько более безопасными считаются ультразвуковые диссекторы, однако вероятность травмы мочеточника при их использовании зависит от уровня энергетического воздействия и времени экспозиции. В эксперименте на животных при тестировании ультразвукового диссектора на уровне 3 в течение менее 10 с за один раз было показано, что смежные ткани практически не повреждаются. При повышении уровня до 4–5 продолжительность экспозиции за один раз не должна превышать 5 с, иначе термическое воздействие распространяется за пределы браншей инструмента [11].
Метод восстановления целостности мочеточника определяется уровнем повреждения. В ситуации, когда имеет место травма органа в области верхней трети, выполняют уретероуретеростомию или тансуретероуретеростомию (в последнем случае свободный конец мочеточника проводят через брыжейку кишки кпереди от магистральных сосудов и анастомозируют его с неповрежденным по типу «конец в бок»). При повреждении средней трети допустимо выполнение указанных выше пособий, а также операции Боари, когда дефект мочеточника находится выше 8 см от уровня устья. При этом из мочевого пузыря выкраивают лоскут, тубуляризируют, а мочеточник подшивают к нему не просто конец в конец, а проводят по подслизистому тоннелю пузыря, спатулируют и подшивают к слизистой отдельными узловыми швами. Для восстановления целостности мочеточника при травме на уровне его нижней трети помимо операции Боари можно использовать методику Psoas-hitch (дефект мочеточника расположен ниже 8 см от уровня устья) и уретероцистонеоанастомоз. После мобилизации мочевого пузыря при операции Psoas-hitch осуществляют переднюю цистотомию и его подшивание к мышечно-сухожильной части поясничной мышцы отдельными рассасывающимися швами через серозно-мышечный слой мочевого пузыря. Важно при этом надежно фиксировать пузырь к мышце, не разволокнив ее и не захватив в шов бедреннополовой нерв, расположенный на брюшке мышцы. Затем мочеточник проводят через стенку пузыря и, спатулировав, подшивают к слизистой отдельными узловыми швами.
При непротяженном повреждении дистальной трети мочеточника можно выполнить уретероцистонеоанастомоз. Существует несколько техник выполнения данной операции. По методу Politano—Leadbetter фактически выполняют реимплантацию мочеточника в мочевой пузырь путем проведения дистального конца мочеточника через подслизистый тоннель мочевого пузыря. Кроме восстановления целостности мочеточника при данной операции выполняется формирование антирефлюксного механизма.
У пациентов, перенесших операцию эвисцерации органов малого таза по поводу онкологического заболевания, неизбежно встает вопрос о методе деривации мочи. Существующие методы отведения мочи условно разделяют на неконтинентные (отсутствует механизм удерживания мочи — так называемые влажные уростомы, кондуиты) и континентные (имеется клапанный механизм в резервуаре, к которому подшиты мочеточники, а пациент проводит периодическую самокатетеризацию для опорожнения резервуара). В отдельную группу выделяют метод деривации посредством создания ортотопического мочевого пузыря, который располагают в малом тазу (на месте удаленного мочевого пузыря), анастомозируя его с уретрой. При этом мочеиспускание происходит при натуживании. Данный метод деривации также является континентным. Для отведения мочи можно использовать практически любой участок желудочно-кишечного тракта, начиная от желудка и заканчивая прямой кишкой. Однако наибольшее распространение среди неконтинентных методик получили илеокондуит по Bricker (мочеточники подшивают к изолированному сегменту кишки по типу «конец в бок» раздельно) и Wallace (мочеточники сшивают между собой параллельно (Wallace-I) или антипараллельно (Wallace-II), а затем подшивают к изолированному сегменту кишки по типу «конец в конец»). Стриктурообразование не является аргументом в пользу того или иного оперативного пособия. Было показано, что риск развития сужения анастомоза одинаков при операциях по Bricker и Wallace, однако у пациентов с сопутствующей мочекаменной болезнью предпочтительна первая методика. При операции по Wallace в случае миграции конкремента в область уретероилеоанастомоза возникает обструкция верхних мочевых путей сразу с двух сторон, тогда как при операции по Bricker этого не происходит. Кроме того, если в послеоперационном периоде возникает необходимость реимплантации одного из мочеточников, то технически данную манипуляцию удобнее выполнять после операции по Bricker [12, 13]. Среди континентных резервуаров наиболее популярна пластика сегментом тонкой кишки по Studer для создания ортотопического мочевого пузыря. Выполнение ортотопической пластики является «золотым» стандартом деривации мочи, но может быть использовано только в отношении тех пациентов, которым в послеоперационном периоде не планируется лучевая терапия на органы малого таза.
Существенным является решение вопроса о выборе сегмента кишки, с помощью которого планируется выполнение деривации. Как известно, данные пациенты страдают рядом метаболических расстройств. Такое осложнение, как гиперхлоремический метаболический ацидоз, значительно чаще развивается у пациентов с толстокишечными резервуарами, поэтому больным с исходным снижением функции почек предпочтителен тонкокишечный резервуар. Компенсация низких значений pH крови в том числе происходит посредством мобилизации HCO3- и Ca2+, что постепенно приводит к деминерализации костной ткани. В отдаленном послеоперационном периоде пациенты с тонкокишечными резервуарами страдают гиперхромной мегалобластной анемией, которая развивается из-за нарушения всасывания витамина В12 в резецированном сегменте (особенно при ортотопической пластике, когда используется протяженный участок тонкой кишки). Однако, пожалуй, основной жалобой, нарушающей качество жизни пациентов после тонкокишечной ортотопической деривации, является диарея. Поскольку при ортотопической пластике используется протяженный участок претерминального отдела тонкой кишки, это обусловливает нарушение всасывания солей желчных кислот и жиров, что в свою очередь приводит к тому, что большая их часть поступает в толстую кишку и действует на ее стенку как детергент [14]. Кроме того, у пациентов с кондуитом с континентной деривацией снижается скорость клубочковой фильтрации (СКФ) на 15–20% в среднем через 11 лет после операции [15]. Говоря о качестве жизни пациентов с тем или иным видом деривации, отметим, что на данный момент оценить его трудно, поскольку к этой группе пациентов неприменимо большинство опросных листов по оценке качества жизни после оперативного пособия. В целом в лидирующих онкологических центрах Европы чаще выполняют ортотопическую пластику (около 75% всех ортотопических реконструкций). [16].
Таким образом, хирург должен всегда иметь в виду возможность травмы органов мочевыделительной системы при выполнении колоректальных операций. Не менее важным является тщательное планирование на предоперационном этапе (МСКТ, МРТ и т.д.). Ранняя диагностика и своевременно начатое лечение — ключевые моменты в ведении пациентов с повреждением того или иного отдела мочевыделительной системы. В заключение хотелось бы процитировать высказывание хирурга Чарльза Хиггинса (1967): «Повредить мочеточник — это простительный грех, а не суметь вовремя распознать травму — смертельный». Пожалуй, данное высказывание, как нельзя лучше, раскрывает подход к интраоперационной травме не только мочеточника, но и любого органа в целом [17].



