Введение. Проблема эффективного лечения бактериальных инфекций в урологии, вызванных госпитальными штаммами бактерий, стоит очень остро. При этом одной из наиболее неблагоприятных в этом отношении групп являются пациенты с 5-й стадией хронической болезни почек. Причиной служат стойкие нарушения иммунного гомеостаза, дистрофия и снижение регенеративной способности тканей, длительная анурия, терапия глюкокортикостероидами, а также большой «стаж» антибактериальной терапии в прошлом и частые госпитализации в хирургические и урологические стационары и др. [1–5].
Известно, что в этиологической структуре заболеваний, приводящих к хронической болезни почек, урологические заболевания составляют от 30 до 45% [6–8]. Инфекции остаются одной из основных причин смерти пациентов, получающих различные виды заместительной почечной терапии – гемодиализ, перитонеальный диализ, а также перенесших трансплантацию почки [9]. При этом наиболее часто возбудителем инфекции выступают бактерии [10].
 Инфекции мочевыводящих путей считаются самым частым инфекционным осложнением у больных хронической болезнью почек. Как правило, возбудителями являются кишечная палочка, клебсиелла и стафилококки. При этом у бактерий достаточно часто наблюдается множественная антибактериальная устойчивость. Это значительно ухудшает результаты лечения и налагает на здравоохранение значительное финансовое бремя [11, 12]. Растущая резистентность возбудителей инфекций к антибактериальным препаратам требует постоянного анализа состава и чувствительности микрофлоры [13].
Инфекции мочевыводящих путей считаются самым частым инфекционным осложнением у больных хронической болезнью почек. Как правило, возбудителями являются кишечная палочка, клебсиелла и стафилококки. При этом у бактерий достаточно часто наблюдается множественная антибактериальная устойчивость. Это значительно ухудшает результаты лечения и налагает на здравоохранение значительное финансовое бремя [11, 12]. Растущая резистентность возбудителей инфекций к антибактериальным препаратам требует постоянного анализа состава и чувствительности микрофлоры [13].
Анализ литературы позволил заключить, что изменения микрофлоры в большинстве урологических центров, занимающихся лечением таких пациентов, пусть и не совсем синхронны, но в значительной мере следуют одной тенденции: постепенный, но монотонный рост резистентности к антибиотикам, увеличение доли грамотрицательных бактерий среди возбудителей и др. [14]. Причем ряд работ охватывает большое количество пациентов и значительный временной интервал – до 10 лет [15–18]. Таким образом, периодический анализ особенностей микробного пейзажа может дать объективное представление о современном состоянии проблемы и способствовать улучшению результатов лечения.
Цель: проанализировать микрофлору и ее чувствительность к антибиотикам у пациентов Центра трансплантологии и диализа.
Материалы и методы. Были проанализированы результаты микробиологического исследования 534 пациентов с 5-й стадией хронической болезни почек (реципиенты почечного трансплантата и диализные пациенты), которые находились на лечении в 2011–2015 гг. Исследования были выполнены в связи с подозрением на инфекцию на основании клинических и лабораторных данных. Были диагностированы пиелонефрит, бактериальная пневмония или пневмония смешанной природы, катетерассоциированный ангиосепсис, инфекции послеоперационной раны, неспецифические воспалительные хирургические заболевания и др. Материалом для анализа служили моча (2345 проб), кровь (454), раневое отделяемое и отделяемое из дренажей (далее «раневое отделяемое» – 362 пробы), мокрота и материал, полученный в результате бронхоальвеолярного лаважа (далее «мокрота» – 176 проб).
Взятие проб, первичный посев клинического материала и идентификацию выделенных микроорганизмов осуществляли согласно утвержденным нормативным документам [1, 3]. Первичный посев мочи, раневого отделяемого и мокроты осуществляли количественным методом на плотные питательные среды: агар с 5%-ной кровью барана, желточно-солевой агар по Чистовичу, Эндо, Сабуро, тиогликолиевую. Идентификацию выделенных чистых культур осуществляли общепринятыми методами. Исследование крови проводили качественным методом с использованием аппарата Bactec с прилагающимися к нему стандартизированными питательными средами («Bacton Dickinson», США). Антибиотикочувствительность определяли дискодиффузионным методом. Чувствительность к ряду антибиотиков – линезолиду, ванкомицину, линкомицину, кларитримицину определяли только у грамположительных бактерий.
Результаты. Общая характеристика микрофлоры. Рост возбудителей обнаружен в 57% образцов: 11% посевов крови, 88% – мокроты, 36% – раневого отделяемого, 67% посевов мочи (рис. 1).
Здесь и на рис. 2: Гр- – грамотрицательная флора, Гр+ – грамположительная флора.
Чаще всего (85%) в посевах встречались монокультуры, которые были представлены грамположительными (42%), грамотрицательными (39%) бактериями или грибами (4%). В 15% наблюдений высевались ассоциации микроорганизмов, при этом чаще всего – при бронхолегочных воспалительных заболеваниях (43% всех посевов мокроты; рис. 2).
В половине наблюдений (51% всех ассоциаций) отмечено сочетание грамположительных и грамотрицательных бактерий. Обращает на себя внимание высокая встречаемость различных ассоциаций с участием грибов в посевах мокроты (76% всех ассоциаций в посевах мокроты).
Видовой состав микрофлоры. В крови наиболее часто встречались Staphylococcus spp. (46%), которые в 33% были представлены S. heamolyticus, в 13% – S. aureus. Вторыми по частоте возбудителями в крови были Enterococcus spp. (23%), которые были представлены двумя видами: E. faecium (17%) и E. faecalis (6%). В 4% наблюдений отмечены недифференцированные грамположительные бактерии, а также Micrococcus spp. Грамотрицательные бактерии в крови были представлены Klebsiella pneumoniae (19%), Acinetobacter baumanii (6%) и недифференцированными неферментирующими бактериями (4%).
При развитии бронхолегочных заболеваний в 55% всех положительных посевов мокроты обнаружены Staphylococcus spp. (S. heamolyticus – 33%, S. koag-(Hly+) – 12%, S. aureus – 3%, в 6% вид не был дифференцирован), в 43% – Streptococcus spp. (S. viridans – 23%, стрептококки группы D – 19%), а в 19% – энтерококки (E. faecium (13%) и E. faecalis (5%)). В 1 % посевов мокроты встречались недифференцированные грамположительные бактерии.
Грамотрицательные бактерии в посевах мокроты были представлены Klebsiella pneumoniae (24%), Neisseria spp. (10%; N. perflava – 4%, N. flava – 3%, вид не дифференцирован – 7%), E. coli (5%), Acinetobacter spp. (4%), P. aeruginosa (3%), Enterobacter spp., недифференцированными неферментирующими бактериями, Serratia spp. – по 1%.
Доля грибов как возбудителей инфекционных заболеваний дыхательной системы была очень высокой – 36% всех посевов мокроты. В подавляющем большинстве наблюдений высевались грибы рода Candida с преобладание вида C. albicans (23%). Доля вида C. glabrata составила 10%, вида C. krusei – 1% всех посевов мокроты. В 2% дрожжевые грибы дифференцировать не удалось.
В 40% всех посевов мочи выявлены Enterococcus spp. (E. faecium – 25%, E. faecalis – 14%, E . zymogenes – 1%), в 12% – Staphylococcus spp. (S. heamolyticus и S. koag-(Hly+) – по 6%). Доля стрептококков составила 2% от всех посевов мочи – по 1% на виды S. viridans и стрептококки группы D. Грамотрицательные бактерии в посевах мочи были представлены бактериями Klebsiella spp. – 27% (K. pneumoniae – 26%, K. oxytoca – 1%) и E. coli – 15% (причем в 2% наблюдений лактозонегативная, а в 1% – с гемолитической активностью). На долю Acinetobacter baumanii, Enterobacter spp., Proteus spp. и недифференцированных неферментирующих бактерий пришлось по 2%. В 5% посевов мочи выявлена синегнойная палочка, в 10% – грибы, из них в 6% это были C. albicans, в 2% – C. glabrata, в 2% – C. krusei.
В 47% посевов раневого отделяемого выявлены Staphylococcus spp. (S. heamolyticus – 33%, S. koag-(Hly+) – 5%, S. aureus и S. epidermidis – по 4%).
В 15% отмечены Enterococcus spp. (E. faecalis – 10%, E. Faecium – 5%). Стрепококки выделены в 4% наблюдений и были в равных долях представлены S. viridans и стрептококками группы D. В 4% посевов отмечены недифференцированные грамположительные бактерии. Грамотрицательные бактерии в большинстве (19%) наблюдений были представлены Klebsiella pneumoniae, а также E. coli – 6% (в 1% с гемолитической активностью), Acinetobacter baumanii – 5%, P. aeruginosa – 5%, Proteus spp. и недифференцированными неферментирующими бактериями – по 2%, а также редкими бактериями, на долю которых пришлось менее 1%, – Citrobacter freundii, Flavobacterium brebe и Serratia spp.
Грибы в раневом отделяемом встречались редко – всего в 6% посевов – и были представлены C. albicans,C. glabrataи C. krusei в равных долях.
Таким образом, чаще всего встречались Enterococcus spp. (37% всех посевов) с преобладанием E. faecium (22%) и E. faecalis (13%). В 19% наблюдений отмечены Staphylococcus spp., которые в 11% были представлены S. heamolyticus, а в 5% – S. koag-(Hly+). Streptococcus spp. отмечены в 6% всех посевов (практически в равных долях S. viridans и стрептококки группы D).
Грамотрицательные бактерии преимущественно были представлены Klebsiella pneumoniae (25%), E. coli (13%), а также P. aeruginosa (5%). Грибы рода Candida отмечены в 11% всех посевов. При этом в 7% это были грибы вида C. albicans, а в остальных наблюдениях в равных долях – C. glabrata и C. krusei.
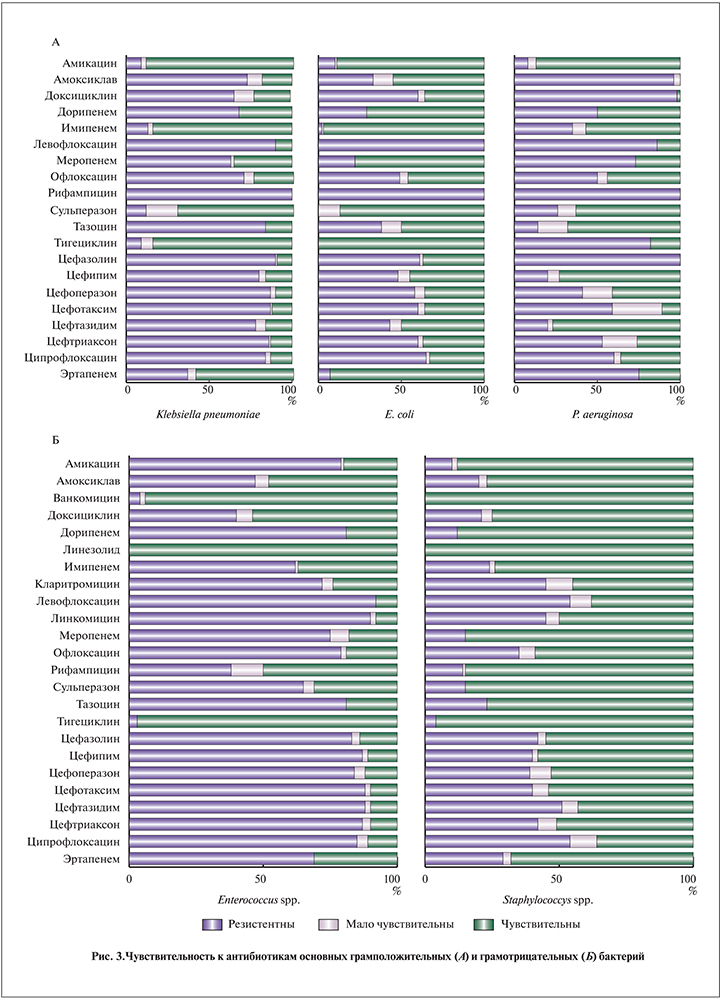
Чувствительность к антибиотикам. Вторым этапом исследования была изучена резистентность к антибактериальным препаратам (рис. 3).
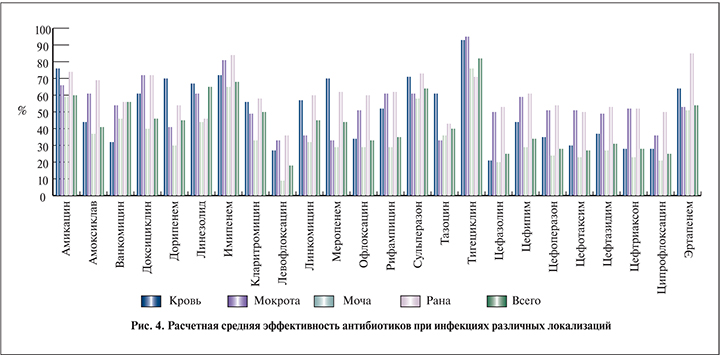
Для специалиста, назначающего эмпирическую антибактериальную монотерапию до получения результатов микробиологического исследования, может быть полезной информация о теоретической эффективности антибиотиков при различной локализации инфекционного процесса (рис. 4). Эти данные основаны на чувствительности отдельных бактерий и также частоте их встречаемости в различных видах биоматериала.
Обсуждение. Периодический анализ микрофлоры, высеваемой у пациентов нашего отделения, выявил значительный рост доли грамотрицательных бактерий. За прошедшие два года (2014 и 2015) их доля уверенно превысила долю грамположительных бактерий. Тем не менее при обобщенном учете результатов за 5 лет доли этих микроорганизмов оказались практически равными. Нам представляется это важным, поскольку несколько сдающие свои позиции энтерококки являются крайне неблагоприятной флорой, характеризующейся множественной антибактериальной устойчивостью. В то же время приходящие им на смену грамотрицательные бактерии – Klebsiella pneumonia – также обладают выраженной резистентностью.
Постепенное снижение доли грамположительных бактерий, по нашему мнению, обусловлено сохраняющейся уже несколько лет высокой чувствительностью к линезолиду и ванкомицину. При этом о растущем удельном весе грамотрицательных бактерий единогласно свидетельствуют и другие исследования [11–13]. В нашем центре подобные изменения произошли несколько позже – ранее доминировала грамположительная микрофлора [6]. Видовой состав микрофлоры также несколько различается – в нашем центре встречаемость Klebsiella и Acinetobacter значительно больше, а E. coli – меньше, чем в зарубежных публикациях.
Обращает на себя внимание высокая резистентность к большинству антибиотиков наиболее распространенных бактерий – Enterococcus spp. и Klebsiella pneumoniae, которая в нашем исследовании значительно превзошла зарубежные показатели. При этом к наиболее часто используемым антибиотикам для эмпирической терапии (цефалоспоринам и ципрофлоксацину) флора устойчива более чем в 80% наблюдений.
В значительной мере осложняет выбор антибактериальной терапии большое число посевов со смешанным характером микрофлоры. При этом перекрестная чувствительность к антибиотикам у самых устойчивых бактерий невысока, что делает монотерапию недостаточно эффективной.
Заключение. В связи с постепенным изменением микробиологического спектра и высокой степенью поливалентной резистентности возбудителей бактериальных инфекций даже к современным антибиотикам принципы эмпирической антибактериальной терапии требуют частичного пересмотра. Мы отметили, что характер, родовой состав, а также чувствительность микрофлоры к антибиотикам существенно зависят от локализации очага инфекционного процесса.
Ежегодный мониторинг и анализ спектра бактериальной микрофлоры, высеваемой у пациентов Центра трансплантологии и диализа, могут способствовать улучшению результатов лечения бактериальных и грибковых инфекций.


