Введение. Хронический рецидивирующий цистит (ХРЦ), несмотря на достижения современной уроинфектологии, остается актуальной и дискутируемой проблемой в практике специалистов, занимающихся диагностикой и лечением данной нозологии [1, 2]. Важным разделом проблемы является изучение этиологической структуры заболевания, от определения которой зависит успех лечения и планируемый объем профилактических мероприятий, данным вопросам посвящен в последние годы ряд клинических исследований, результатом которых является самое большое коллаборационное достижение как в урологии, так и в микробиологии, а в медицине в целом – признание парадигмы о нестерильности мочи [3–5].
Определенным прогрессом в изучении этиологической структуры ХРЦ было признание о возможном участии в развитии цистита не только общепризнанных аэробных микроорганизмов, но и представителей анаэробного микробного сообщества [4, 6].
Изучение таксономической структуры анаэробных микроорганизмов мочевыводящих путей выявило, что данные бактерии могут выявляться в мочевыводящих путях как в норме, так при определенных условиях, и они способны проявлять свои патогенные свойства, вызывать инфекционно-воспалительные заболевания мочевыводящих путей и репродуктивных органов [7]. Возможность участия вирусов в развитии ХРЦ активно обсуждается и изучается [8–10]. Считается, что вирусный цистит различной этиологии, как и грибковой, может регистрироваться у пациентов с осложняющими факторами: первичный или вторичный иммунодефицит, после трансплантологических или обширных реконструктивных операций, лучевой, химиотерапии и др. [11]. Используемые культуральные методы диагностики не выявляют полного спектра патогенов, и в связи с этим рекомендуется выполнять цистоскопию, биопсию мочевого пузыря с целью уточнения генеза ХРЦ. Верификация труднодиагностируемых сложных инфекционных агентов имеет высокую клиническую значимость, направленную не только на лечение, но и на профилактику рецидивирующей инфекции нижних мочевыводящих путей (РИНМП), связанную с данными агентами [12].
Проведенный нами анализ морфологических исследований биопсионного материала мочевого пузыря позволяет провести не только дифференциальную диагностику РИНМП по этиологическому фактору, но и определить тактику ведения, объем обследования и лечения пациентов с данной нозологией.
Цель исследования: изучить патоморфологические изменения уротелия мочевого пузыря пациенток с хроническим рецидивирующим циститом в зависимости от этиологического фактора.
Материалы и методы
Этическое заявление. Исследование спланировано, проведено в соответствии с положениями Хельсинкской декларации (пересмотренной в г. Форталеза, Бразилия, октябрь 2013 г.) и одобрено Локальным независимым этическим комитетом ФГБОУ ВО РостГМУ Минздрава России на основании ознакомления с предоставленными материалами дизайна и плана реализации работы (протокол № 16/17 от 05.10.2017).
Исследование проведено в рамках выполнения диссертационной работы «Оптимизация дифференциальной диагностики и выбора первой линии терапии хронического рецидивирующего цистита у женщин». Исследование не имело спонсорской поддержки.
Пациенты. В проспективное исследование включены 158 сексуально активных пациентов женского пола в возрасте 20–45 лет, которым был ранее установлен диагноз «рецидивирующая инфекция нижних мочевыводящих путей/хронический рецидивирующий цистит (РИНМП/ХРЦ) в период обострения». Критерии включения и невключения пациентов для участия в исследовании приведены в табл. 1.

Инициальное обследование пациентов включало сбор жалоб, анамнеза, бактериологическое исследование утренней средней порции мочи, ПЦР (полимеразная цепная реакция)-исследование утренней средней порции мочи, соскоба из уретры и влагалищ и цитологию суточной мочи. Методология проведения обследования подробно описана в предшествовавшей работе (8). По результатам бактерио-логического и ПЦР-исследований мочи, соскоба уретры и влагалища в зависимости от доминирующего этиологического фактора больные были разделены на четыре группы: группа 1 (n=70) – бактериальная РИНМП/ХРЦ (Б-РИНМП / ХРЦ), группа 2 (n=70) – папилломавирусная РИНМП / ХРЦ (ПВИ-РИНМП / ХРЦ), группа 3 (n=11) – кандидозная РИНМП / ХРЦ (К-РИНМП / ХРЦ), группа 4 (n=7) – туберкулезная РИНМП / ХРЦ (Т-РИНМП / ХРЦ).
Биопсия мочевого пузыря. Всем пациенткам в стадии ремиссии заболевания после премедикации и общего обезболивания стандартно выполняли цистоскопию. Биоптаты для исследования забирались «холодным» путем из измененных участков. Полученный морфологический материал фиксировали в растворе нейтрального 10%-ного забуференного формалина «HistoSafe®» (ООО «ЭргоПродакшн», Санкт-Петербург, Россия) с 24-часовой экспозицией. Гистологическую проводку (обезжиривание и обезвоживание, просветление, парафинирование) производили по стандартной технологии в тканевом гистопроцессоре. Срезы из парафиновых блоков толщиной 3–5 мкм получали с помощью ротационного микротома Leica RM 2265 («Leica Microsystems GmbH», Wetzlar, Germany), окрашивали Hematoxylin-eosin [H&E] («БликМедиклПродакшн», РФ).
Микроскопию препаратов проводили с помощью прямого светового микроскопа Leica DM2000 («Leica Microsystems GmbH», Wetzlar, Germany) в разрешениях x100, x200, х400; фотофиксацию патоморфологических изменений выполняли цифровой камерой Leica DFC295 3 Mpx («Leica Microsystems GmbH», Wetzlar, Germany).
При микроскопии препаратов оценивали состояние уротелия, определяли признаки тканевого воспаления, особенности клеточного состава инфильтратов, признаки ремоделирования и патологической трансформации тканей.
С целью оценки и сопоставления тяжести патоморфологических изменений использовали 4-уровненую аналоговую шкалу, при регистрации изменений в 4 полях зрения на увеличении х200: (-) – отсутствие патологического изменения (признака); (+) – слабовыраженное изменение (признак); (++) – умеренно выраженное изменение (признак); (+++) – максимально выраженное изменение (признак). Регистрацию тканевых изменений осуществляли c помощью смоделированных и особым образом организованных электронных таблиц Microsoft Office Excel 365 («Microsoft Corp.», Redmond, WA, USA).
Результаты. Средний возраст пациентов составил 32,3±7,8 года. По результатам гистологического анализа биопсийных образцов стенки мочевого пузыря (МП) в различных группах выявлены характерные патоморфологические изменения тканей (табл. 2).
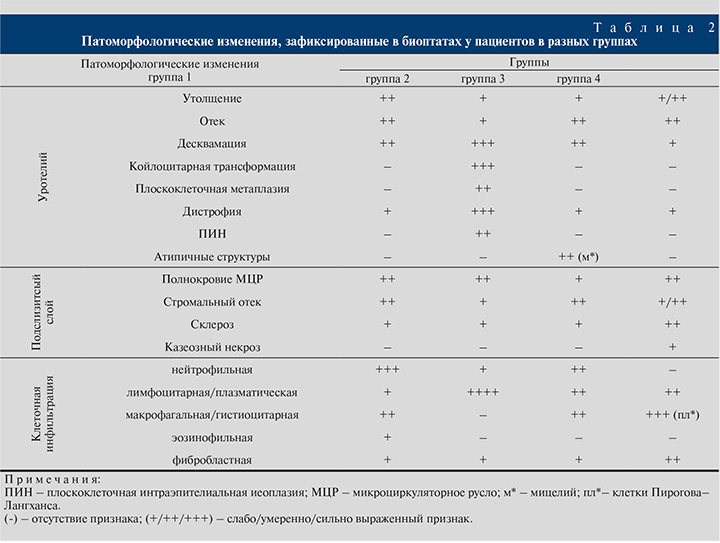
У пациенток группы 1 отмечены утолщение уротелия, отек слизистой оболочки и подслизистого слоя, полнокровие капилляров, с преобладанием в клеточном инфильтрате нейтрофилов с небольшим количеством лимфоцитов, плазматических клеток (рис. 1).
Также на фоне хронического инфекционно-воспалительного процесса была выявлена десквамация уротелия (рис. 2).
У всех пациенток группы 2 с признаками ПВИ поражения в слизистой МП на фоне гиперплазии, плоскоклеточной метаплазии, хронического воспаления, нарушения сосудистой архитектоники и отека доминировала лимфоцитарная инфильтрация с примесью плазматических клеток. Кроме того, у большинства пациенток плоскоклеточная метаплазия уротелия носила характер субтотального или тотального поражения. У всех пациенток была отмечена характерная койлоцитарная трансформация уротелия (рис. 3).

У 65% пациенток койлоцитарная трансформация сопровождалась формированием папиллярных структур за счет выраженной гиперплазии клеток уротелия на фоне ВПЧ-инфекции (вируса папилломы человека), у 15% была регистрирована остроконечная кондилома (рис. 4).
Койлоциты, как правило, располагались в эпителии беспорядочно и характеризовались аномальными, резко увеличенными темными неправильной формы ядрами со складчатым контуром и перинуклеарной зоной или ореолом просветления – «гало». Кроме того, в большинстве измененных клеток уротелия при ВПЧ отмечены выраженные дистрофические изменения ядер: гиперхромия, гипертрофия, кариорексис, кариопикноз.
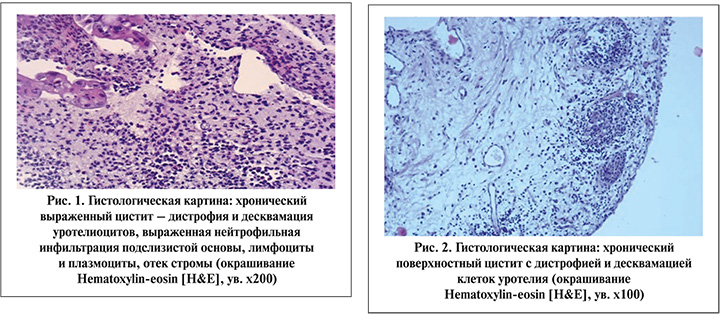
У 35% пациенток на фоне папилломатозной гиперплазии регистрировались участки интраэпителиальной неоплазии 1–2-й степени на фоне ВПЧ (рис. 5).
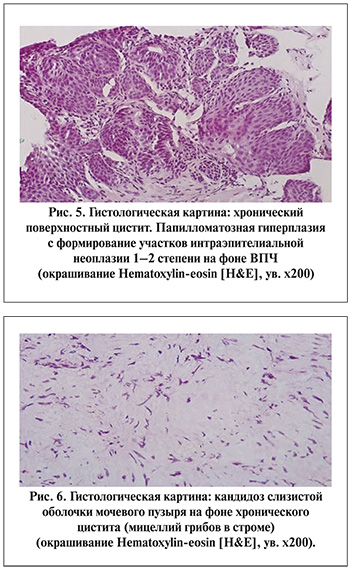
У пациенток группы 3 на фоне хронического воспаления с десквамацией уротелия с умеренной лимфоцитарной и нейтрофильной инфильтрацией регистрировали разрастание мицелия (рис. 6).
У пациенток группы 4 выявлены полнокровие сосудов, отек уротелия и подслизитой разной степени выраженности, элементы склероза, диффузная лимфоидно-гистиоцитарная инфильтрация, характерная для склерозирующего процесса. Воспалительный инфильтрат у всех пациенток состоял из лимфоцитов, плазматических клеток, макрофагов, фибробластов. Кроме того, в стенке МП были зафиксированы признаки гранулематозного воспаления со скоплением многоядерных гигантских клеток типа Пирогова–Лангханса и участками казеозного некроза (рис. 7).

Обсуждение. Основные результаты данного исследования заключаются в том, что различные инфекционные патогены ХРЦ могут по-разному оказывать негативное воздействие на уротелий и на слизистую мочевого пузыря в целом, при этом развивается симптомокомплекс, который характеризуется различными клинико-лабораторными особенностями в зависимости от этиологического фактора. Идентификация инфекционного агента, ответственного за инфекционно-воспалительный процесс мочевого пузыря, является определяющей при назначении этиотропной терапии ХРЦ.
Современные культуральные исследования не всегда выявляют весь таксономический пейзаж возможных микроорганизмов, причастных к развитию ХРЦ, а только ограниченный спектр уропатогенов [5]. Важным является вопрос: какой патоген является триггером инфекционно-воспалительного процесса, приводящим к хронизации заболевания? Верификация и дифференциальная диагностика возбудителя имеют высокую клиническую значимость, направленную не только на профилактику, но и на раннюю диагностику ХРЦ, связанную с данными агентами. Поэтому в последние годы идет поиск маркеров или методов идентификации всех возбудителей, которые могут вызывать инфекционно-воспалительный процесс в МП [12, 13]. Морфологическое исследование биоптатов мочевого пузыря позволяют дифференцировать изменения уротелия при ХРЦ в зависимости от этиологического фактора. Полученные результаты подтверждают наши предыдущие исследования, демонстрирующие важность и точность метода морфологического исследования уротелия, позволяющего с высокой точностью дифференцировать генез ХРЦ [11], однако в предыдущем исследовании мы ограничивались дифференциальной диагностикой бактериального и папилломавирусного цистита. В полученных результатах мы расширяем диапазон возможных этиологических агентов ХРЦ, которые могут быть идентифицированы только морфометрическими исследованиями.
Выводы. Хронический рецидивирующий цистит является полиэтиологическим заболеванием, и идентификация его этиологического фактора является сложной задачей и залогом успешного лечения.
По нашему мнению, одним из ведущих методов дифференциальной диагностики ХРЦ, позволяющим определить генез инфекционно-воспалительного процесса в мочевом пузыре, является морфологическая оценка биоптатов мочевого пузыря, при этом определяются специфические изменения уротелия, характерные для каждого вида воспаления.



