Введение. Восстановление проходимости верхних мочевыводящих путей при обструктивных уропатиях остается одной из самых сложных проблем оперативной урологии [1, 2]. В современной литературе описано много способов хирургического лечения гидронефротической трансформации с целью восстановления уродинамики верхних мочевыводящих путей, однако недостаточно освещены вопросы, касающиеся изучения функционального состояния почек и мочеточников при замещении зоны обструкции аутотрансплантатом.
На стадии изучения находятся методики замещения мочеточника синтетическими материалами, сосудистыми аутотрансплантатами, фаллопиевыми трубами, лиофилизированной твердой мозговой оболочкой при протяженных стриктурах или при тотальном замещении мочеточников. Однако данные трансплантаты не подходят для постоянного замещения ввиду невозможности осуществлять сокращения, подобные перистальтике цистоидов мочеточника, что в свою очередь может стать причиной рецидива уретерогидронефроза [3].
Наиболее широко используемыми методами замещения мочеточника при обширных повреждениях в настоящее время являются использование различных отделов кишечника – тонкой кишки, имеющей схожее с мочеточником строение стенки и обладающей способностью к сократительной деятельности, червеобразного отростка и сегментов толстой кишки [3].
Для реконструкции стриктур мочеточника протяженностью от 3 до 5 см некоторые авторы используют методику буккальной пластики [4–7].
В литературе представлены единичные экспериментальные работы, посвященные изучению проблем восстановления уродинамики верхних мочевыводящих путей. Так, в работе [8] у трех павианов оценивали возможность замены поврежденного сегмента мочеточника протяженностью до 3 см свободным аутотрансплантатом из слизистой оболочки полости рта.
Цель исследования: оценка результатов хирургического лечения путем использования аутотрансплантата (влагалищной оболочки яичка) на верхних мочевыводящих путях у экспериментальных животных.
Материалы и методы. Экспериментальная работа проведена Республиканским научным центром урологии совместно с кафедрой акушерства и хирургии факультета ветеринарной медицины и биотехнологий Кыргызского национального аграрного университета им. К. И. Скрябина и ветеринарной клиникой «Animal planet». Исследование выполнено на 25 беспородных собаках мужских особей. Масса тела 2 особей составила 8 кг, 6 – от 11 до 12 кг, 7– от 12 до 14 кг, 8 особей – от 14 до 16 кг.
Всем животным была выполнена аутопластика мочеточника влагалищной оболочкой яичка. Операция выполнена под внутривенным наркозом с дополнительной инфильтрационной анестезией 2%-ным раствором лидокаина – 50 мл. Операционное поле – поясничная область слева и мошонка – выстригали, обрабатывали йодистым раствором. Длина разреза в поясничной области соответствовала 5–6 см. Межмышечным доступом в забрюшинном пространстве визуализировали мочеточник, брали его на держалку и рассекали продольно на 2,5 см.
В просвет мочеточника устанавливали стент-катетер. Рану прикрывали стерильным материалом. Выполняли разрез кожи мошонки длиной 1,5–2 см.
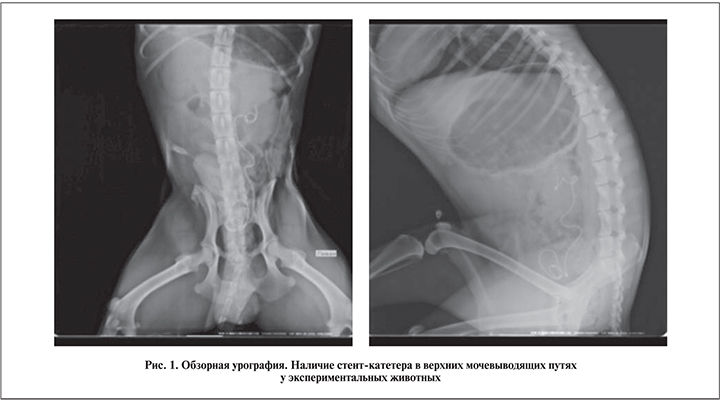
Выделяли и вскрывали влагалищную оболочку яичка, из которой выкраивали лоскут размером 2,5×0,5 см, ушивали ее. На кожу накладывали рассасывающие (полидиоксанон) швы, асептическую повязку. Аутоимплантат фиксировали внутренней поверхностью к просвету мочеточника и ушивали непрерывным вворачивающимся швом полигликолида 4–0. Мочеточник подводили к позвоночному краю раны и чресфасциально закрепляли к ней. В рану устанавливали дренажную страховую трубку. Послойно ушивали рану. На кожу налагали рассасывающиеся (полидиоксанон) швы, асептическую повязку. Выполняли катетеризацию мочевого пузыря катетером Нелатона. Собак переводили в послеоперационный вольер. Осуществляли динамическое наблюдение с контролем температуры тела и диуреза. Назначали антибактериальную терапию: цефтриаксон 0,5 г 2 раза в сутки, раствор метронидазола 50 мл 2 раза в сутки внутривенно капельно в течение 2 дней. С целью контроля установки мочеточникового стента-катетера выполняли обзорную урографию в прямой и боковой проекциях (рис. 1).
Забор биопсийного материала для морфогистологического исследования осуществлен через 1 мес. у 7 особей, через 3 – у 8 и через 6 мес. – у 10 собак. Вмешательство проведено под аналогичной ранее анестезией. Выполнен продольный разрез длиной 2–3 см по старому послеоперационному рубцу, ближе к позвоночному углу. Межмышечным доступом в забрюшинном пространстве находили фиксированный мочеточник, производили краевое иссечение фрагмента аутотрансплантата и ткани мочеточника размером около 0,4×0,3 см. Удаляли стент-катетер. Дефект мочеточника ушивали узловыми швами полигликолида 4–0. На кожу накладывали рассасывающиеся швы полидиоксанона, асептическую повязку.
В послеоперационном периоде осуществляли динамическое наблюдение за температурой тела и суточным диурезом.
Назначали антибактериальную терапию в виде цефтриаксона 0,5 г однократно внутримышечно и раствора метронидазола 50 мл однократно внутривенно капельно.
Стент-катетер был установлен 10 особям, из них у 3 он был удален через 1 мес., у 3 – через 3, у 4 – через 6 мес. Пятнадцати собакам установка стента не производилась.
Для гистологического исследования готовили парафиновые срезы на санном микротоме толщиной 5–6 мкм, окрашивали гематоксилином и эозином.
 Сравнительная оценка результатов хирургической коррекции проведена до и после операции путем анализа данных экскреторных урограмм, УЗИ, гистологического исследования аутотрансплантата.
Сравнительная оценка результатов хирургической коррекции проведена до и после операции путем анализа данных экскреторных урограмм, УЗИ, гистологического исследования аутотрансплантата.
Все животные обследованы в раннем послеоперационном периоде на 7-е сутки и далее через 1–3–6 мес. Четырем особям произведен забор биопсийного материала (мочеточник+аутотрансплантат и лоханка+аутотрансплантат) через 1 мес., 5 – через 3, 6 – через 6 мес.
Работа с животными при проведении эксперимента проведена в соответствии гуманным отношением и нравственными нормами по защите животных для биомедицинских исследований.
Результаты. Во всех случаях жизнеспособность аутотрансплантата полностью сохранялась, отсутствовали признаки вторичного инфицирования, некроза и нарушения проходимости в зоне анастомоза.
В послеоперационном периоде у одной особи наблюдалось вторичное заживление раны, связанное с постоянными расчесами вокруг нее. У 4 особей со стент-катетрами в первые 7 дней отмечена дизурия, которая в последующем купировалась.
В отношении 9 животных в послеоперационном периоде в течение 2–3 сут. регистрировалось повышение температуры до 38,3–39°С (норма при ректальном измерении 37,5°С).
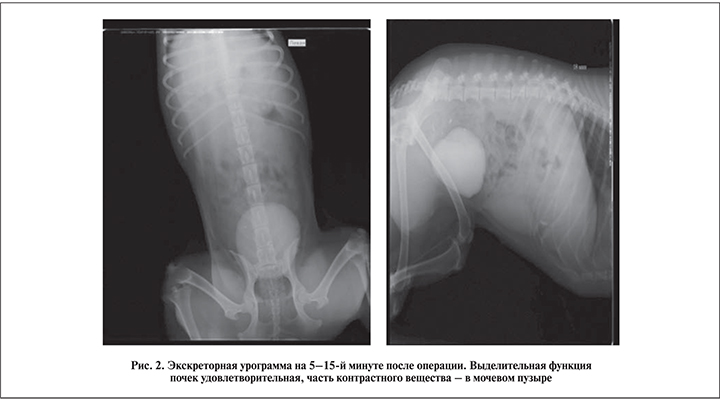
Нарушения пассажа мочи, по данным экскреторной урографии, не выявлено ни у одного животного (рис. 2).
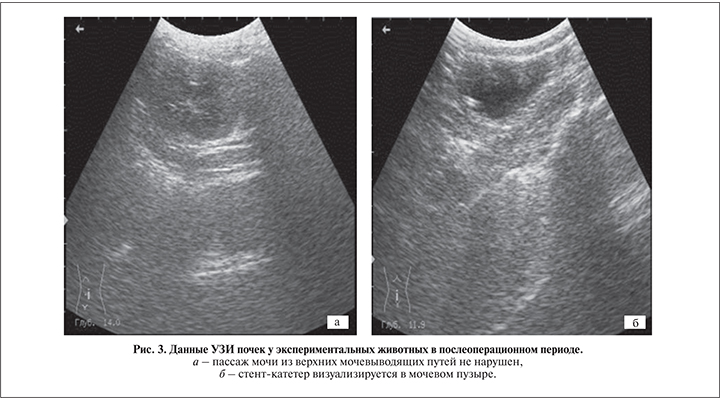
По данным проведенного УЗИ в послеоперационном периоде, нарушения уродинамики в мочевыводящих путях не выявлено (рис. 3 а, б).
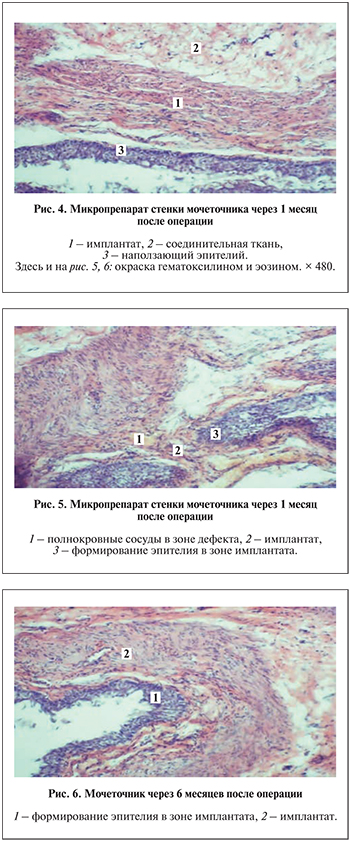
При гистологическом исследовании препаратов через 1 мес. наблюдались признаки эпителизации в зоне транплантации. Отчетливо определены зона транформации, признаки гистиолимфоцитарной инфильтрации, адгезия имплантата (рис. 4).
Результаты гистологического исследования через 3 мес. выявили признаки соединительнотканного замещения имплантата. Зона трансформации была стертой. Определены признаки восстановления микроциркуляторного русла с полнокровными сосудами, что характеризовало снижение лимфоцитарной инфильтрации (рис. 5).
Через 6 мес. после операции констатировано соединительнотканное замещение в зоне имплантации. Наблюдались признаки эндотелизации и неоваскулогенеза: клетки заместительной соединительной ткани хорошо выражены, с крупными ядрами. Отмечено восстановление структурной архитектоники соединительнотканных клеток зоны трансплантата (рис. 6).
Выводы
- Аутотрансплантат влагалищной оболочки яичка приживляется в течение 30–60 дней и герметично закрывает дефект мочеточника, не вызывая нарушения уродинамики верхних мочевыводящих путей.
- На биопсийном материале подтверждено, что аутотрансплантат влагалищной оболочки яичка является своего рода «матрицей», представляющей соединительную ткань, внутреннюю поверхность которой выстилает слизистый эпителий, исходящий из мочеточника.
- Данные экспериментальной работы можно использовать как метод выбора хирургического лечения мужчин, страдающих нарушениями уродинамики верхних мочевыводящих путей, с целью увеличения диаметра мочеточника и лоханочно-мочеточникового сегмента.


