Введение
Аденома предстательной железы (АПЖ) – одно из самых частых заболеваний, развивающихся с возрастом. По данным отечественных и зарубежных исследователей [1, 2], встречаемость АПЖ среди мужчин в возрасте до 50 лет составляет около 50%, а к 80 годам увеличивается до 80%. При АПЖ характерны специфические гистологические изменения. Начальная трансформация тканей может происходить уже в возрасте 35–40 лет. В связи с этим первые симптомы заболевания могут появляться в том же возрасте. По данным C. Roehrborn и соавт. [3], симптомы, характерные для АПЖ в возрасте 40 лет, развиваются у 18% мужчин, в 50 лет – у 29%, в 60 – у 40%, в 70 лет — у 56%. Аденома предстатель-ной железы является медленно прогрессирующим хроническим заболеванием, характеризующимся “синусоидным” типом течения и может проявляться периодами симптоматического ухудшения или стабилизации. В связи с тем что АПЖ – это возрасто зависимый недуг [1, 4, 5], у пациентов дополнительно повышается риск развития различных хронических заболеваний, таких как метаболический синдром, сахарный диабет (СД) 2 типа, болезни сердечно-сосудистой системы и т.д., значительно осложняющих курацию этой категории больных [6]. В консервативной терапии АПЖ удалось достичь значимых успехов, однако операция остается единс-твенным радикальным методом лечения. Согласно Рекомендациям совещания совета экспертов по лечению аденомы предстательной железы (2009), оптимальным вариантом оперативного вмешательства при размерах простаты от 30 до 80 см3является ее трансу-ретральная резекция (ТУР), а при бóльших размерах – открытая аденомэктомия [1]. Выбор метода лечения АПЖ обычно зависит от соматического состояния пациента, и часто возможность проведения оперативного пособия ограничивается высоким операционно-анестезиологическим риском. Необходимо также учитывать увеличение сроков нахождения в стационаре и последующей реабилитации в случае развития послеоперационных осложнений. С появлением лазерных технологий и внедрением диодного лазера Дорнье Уробим стало возможным эндоскопическое лечение АПЖ, значительно превышающей в объеме 80 см3. Однако при этом всегда следует иметь в виду, что с увеличением размеров предстательной железы и объема оперативного вмешательства также увеличивается риск развития осложнений на разных этапах лечения [7]. В связи с этим особую значимость в лечении АПЖ приобретают другие малоинвазивные оперативные методы с минимальными рисками развития возможных осложнений и отсутствием необходимости общей анестезии, использование которых позволяет сокращать сроки пребывания в стационаре, что в конечном итоге повышает безопасность лечения и как следствие – улучшает качество жизни пациентов. В отделении андрологии и урологии Эндокринологического научного центра внедрен малоинвазивный метод лечения пациентов с объемом АПЖ более 80 см3, высоким операционно-анестезиологическим риском, которым не показано стандартное оперативное лечение. Принцип метода рентгеноэндоваскулярной окклюзии артерий простаты (РЭВОАП) заключается в редукции артериального притока к предстательной железе, что приводит к быстрому уменьшению объема  предстательной железы и выраженности симптоматики заболевания. Использование данной методики,
предстательной железы и выраженности симптоматики заболевания. Использование данной методики,
разработанной на основе достижений отечественных ученых [8–10], позволяет исключить риск развития типичных осложнений, характерных для вмешательств, выполняемых по поводу АПЖ, повысить качество жизни пациента в ближайшем и отдаленном послеоперационном периоде. Разработка метода стала возможной при взаимодействии двух дисциплин – урологии и ангиохирургии. Разрешение на проведение данного исследования получено на Ученом совете ФБГУ ЭНЦ МЗ СР (протокол заседания от 24.03.09).Целью исследования явилось изучение эффективности и безопасности малоинвазивного оперативного лечения аденомы предстательной железы больших размеров методом РЭВОАП.
Материалы и методы
Данную методику лечения мы применяем с 2009 г. На начальном этапе работы обследованы 166 мужчин общей группы с АПЖ в возрасте 67±11 лет. По выводам обследования получены следующие данные: оценка по шкале IPSS составила 23±9 баллов, объем остаточной мочи — 110±90 мл, частота ноктурии — 4,2±3,1 раза, уровень общего простатспецифического антигена (ПСАобщ) 2,1±1,8 нг/мл, максимальная скорость потока мочи по данным урофлоуметрии 8,5±6,1 мл/с. Все пациенты были разделены на четыре группы. В 1-ю группу вошли 38 больных с объемом простаты более 80 см3, для которых единственным методом лечения была избрана РЭВОАП. Во 2-ю группу включили 40 больных с объемом простаты более 80 см3, которые в анамнезе перенесли открытую аденомэктомию (ОАЭ) (проведен ретроспективный анализ). Третью группу составили 43 больных с объемом простаты более 80 см3, принимающих ингибиторы 5α-редуктазы. Пациенты 4-й группы (n=45) с объемом простаты менее 30 см3, не имеющие симптомов АПЖ, находились под динамическим наблюдением. В 1-й, 2-й и 3-й группах размер простаты достоверно не различался и составлял в среднем 152±64 см3.Критерии включения в группу РЭВОАП: объем предстательной железы больше 80 см3; противопоказания к проведению стандартных оперативных вмешательств на предстательной железе; высокий анесте-зиологический риск; уровень ПСАобщменее 4 нг/мл; уровень ПСАобщвыше 4 нг/мл при отрицательном
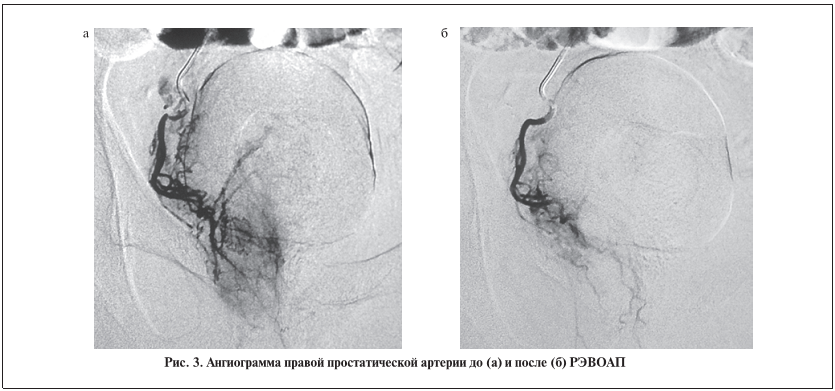
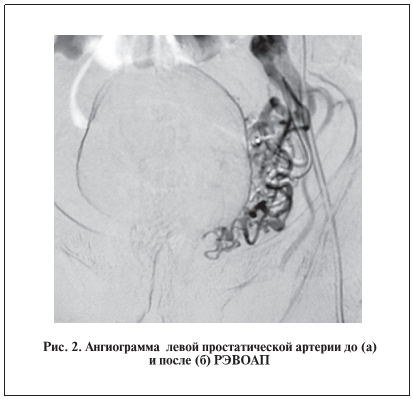
 результате пункционной биопсии предстательной железы. Предоперационная подготовка к РЭВОАП не отличается от таковой при стандартных ангиографических исследованиях. Обязательны исследования функции почек, печени (креатинин, мочевина, АСТ, АЛТ, калий в крови). Процедура РЭВОАП проводится в специализированной ангиохирургической операционной под контролем рентгеноскопии в положении больного на спине под местной анестезией. Выполняется пункция общей бедренной артерии. Далее через просвет иглы интралюминально проводится металлический проводник, покрытый тефлоном, по которому устанавливается интродьюсер 5F c катетером 5F. Выбор типа катетера в основном зависит от ангиографической анатомии сосудов. Катетер устанавливается в устье простатической артерии, затем продвигается максимально дистально. Артериография проводится с использованием контрастного неионного препарата (рис. 1–3). После анализа полученных ангиограмм выполняется селективная эндоваскулярная эмболизация простатических артерий. Для РЭВОАП оптимальным препаратом остается поливинилалкоголь (PVA, фирма Сook) с размерами микросфер от 300 до 500 мкм. Окончательно выбор размера эмболизирующего материала определяется интраоперационно в зависимости от архитектоники визуализируемого сосудистого русла. Ангиографическим критерием успеш-но проведенной манипуляции является отсутствие контрастирования дистального русла и появление рефлюксного выброса контраста из основного ствола эмболизируемой артерии (рис. 2, б; 3, б). После по-очередного (справа и слева) выполнения двусторонней эмболизации катетер и интродьюсер удаляются. Проводится гемостаз места пункционного отверстия давящей повязкой в течение 24 ч. Пациент в течение этого времени соблюдает строгий постельный режим. У больных до начала лечения и далее каждые 3 мес определяли уровень ПСАобщв крови, проводили пальцевое ректальное и ультразвуковое исследование (УЗИ) предстательной железы. УЗИ осуществляли на аппарате Pro Focus 2202 B-K Medical(Дания). Все мужчины заполняли информированное согласие на операцию.УЗИ предстательной железы и органов мочевой системы в ходе динамического наблюдения выпол-няли ежедневно после РЭВОАП в период пребывания в стационаре, затем еженедельно в течение 1-го месяца, далее 1 раз в месяц на протяжении 3 мес, затем 1 раз в 6 мес (на протяжении до 2 лет).
результате пункционной биопсии предстательной железы. Предоперационная подготовка к РЭВОАП не отличается от таковой при стандартных ангиографических исследованиях. Обязательны исследования функции почек, печени (креатинин, мочевина, АСТ, АЛТ, калий в крови). Процедура РЭВОАП проводится в специализированной ангиохирургической операционной под контролем рентгеноскопии в положении больного на спине под местной анестезией. Выполняется пункция общей бедренной артерии. Далее через просвет иглы интралюминально проводится металлический проводник, покрытый тефлоном, по которому устанавливается интродьюсер 5F c катетером 5F. Выбор типа катетера в основном зависит от ангиографической анатомии сосудов. Катетер устанавливается в устье простатической артерии, затем продвигается максимально дистально. Артериография проводится с использованием контрастного неионного препарата (рис. 1–3). После анализа полученных ангиограмм выполняется селективная эндоваскулярная эмболизация простатических артерий. Для РЭВОАП оптимальным препаратом остается поливинилалкоголь (PVA, фирма Сook) с размерами микросфер от 300 до 500 мкм. Окончательно выбор размера эмболизирующего материала определяется интраоперационно в зависимости от архитектоники визуализируемого сосудистого русла. Ангиографическим критерием успеш-но проведенной манипуляции является отсутствие контрастирования дистального русла и появление рефлюксного выброса контраста из основного ствола эмболизируемой артерии (рис. 2, б; 3, б). После по-очередного (справа и слева) выполнения двусторонней эмболизации катетер и интродьюсер удаляются. Проводится гемостаз места пункционного отверстия давящей повязкой в течение 24 ч. Пациент в течение этого времени соблюдает строгий постельный режим. У больных до начала лечения и далее каждые 3 мес определяли уровень ПСАобщв крови, проводили пальцевое ректальное и ультразвуковое исследование (УЗИ) предстательной железы. УЗИ осуществляли на аппарате Pro Focus 2202 B-K Medical(Дания). Все мужчины заполняли информированное согласие на операцию.УЗИ предстательной железы и органов мочевой системы в ходе динамического наблюдения выпол-няли ежедневно после РЭВОАП в период пребывания в стационаре, затем еженедельно в течение 1-го месяца, далее 1 раз в месяц на протяжении 3 мес, затем 1 раз в 6 мес (на протяжении до 2 лет).
Результаты
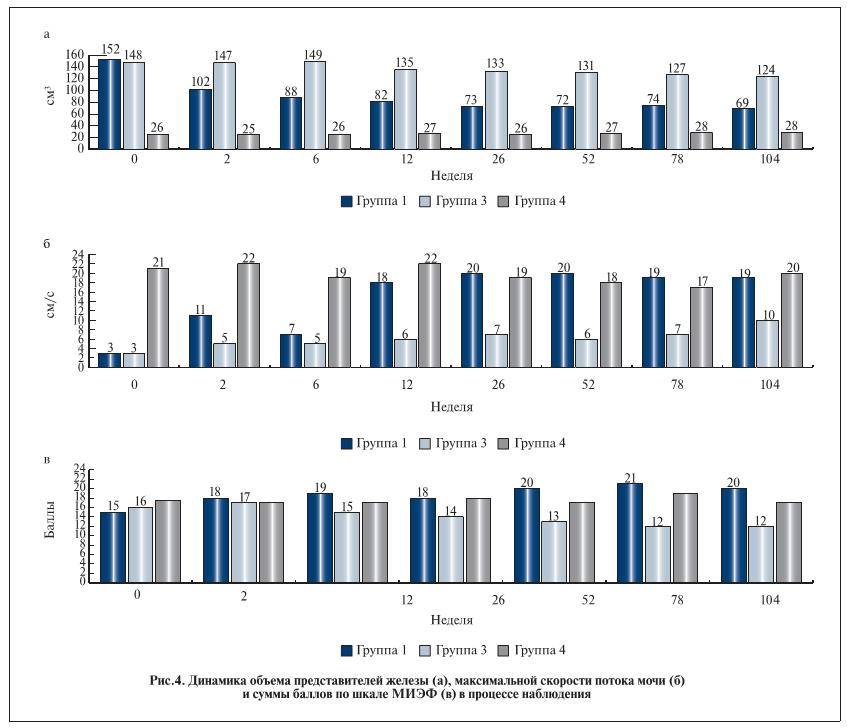
Шесть пациентов основной группы в течение первых суток после операции жаловались на слабовыраженные боли в области промежности. Острой почечной недостаточности (ОПН), гипер-термии, гематурии, острой задержки мочеиспускания, кровотечения из прямой кишки ни у одного пациента зафиксировано не было. Больных выписывали под амбулаторное наблюдение, как правило, через 1–3 дня после вмешательства. В 2-й группе перенесших открытую аденомэктомию в послеоперационном периоде у 18,2% пациентов развились осложнения (кровотечение, острый пиелонефрит, недержание мочи, склероз шейки мочевого пузыря, эректильная дисфункция). Достоверное уменьшение объема предстательной железы за первые 3 мес после операции было зарегистрировано у всех больных 1-й группы и составило 39±14%. Характерно, что положительную динамику наблюдали уже через 2–3 дня после окклюзии артерий. Интенсивность изменения размера простаты была достоверно выше в группе РЭВОАП по сравнению с группой получавших терапию ингибитором 5α-редуктазы (рис. 4, а). Все пациенты отмечали уменьшение дизурии в течение первых 3–5 дней после РЭВОАП, а спустя 2 мес наблюдали еще более существенное улуч-шение расстройств мочеиспускания (средний балл по шкале IPSS – 7,3±2,1). Через 12 мес в группе РЭВОАП средний балл по шкале IPSS составил 5,2±1,7, что было достоверно лучше, чем до лечения (p<0,001). Динамика максимальной скорости потока мочи в 1-й группе оказалась более выраженной, чем в 3-й (рис. 4, б).Продолжительность госпитализации в 1-й группе была существенно меньше, чем во 2-й, – 2,3 дня против 19,7 соответственно (р<0,001).В отдаленном послеоперационном периоде в сроки от 6 мес до 1 года после проведения РЭВОАП 4 больным в связи с сохранением затрудненного мочеиспускания обструктивного типа выполнена типичная ТУР простаты. Второй этап лечения стал технически возможным вследствие уменьшения объема железы (до 88–69 см3). В ходе операции во всех этих наблюдениях при выполнении ТУР было отмечено существенное уменьшение кровоточивости из ткани простаты. Послеоперационный период протекал без особенностей. Гистологическое исследование удаленных фрагментов ткани подтвердило типичную структуру аденоматозной ткани.
Обсуждение
На современном этапе развития высокотехнологичной медицинской помощи выбор метода лечения должен быть основан прежде всего на балансе безопасности и эффективности терапии. По данным зарубежных ученых, большинство пациентов предпочитают более медленное (до 6 мес) наступление эффекта от консервативной терапии быстрому результату оперативного лечения, сопровождающегося соответствующими рисками [11]. С другой стороны, все больше пациентов желают быстрее решить имеющиеся проблемы минимально травматичным способом, по возможности без традиционного оперативного вмешательства и наркоза. С нашей точки зрения, малоинвазивная технология РЭВОАП, рассматриваемая как альтернативная либо дополнительная методика лечения АПЖ, в полной мере отвечает данным требованиям. Сравнение полученных нами результатов лечения с таковыми при использовании стандартных операций и консервативных методов демонстрирует преимущество РЭВОАП. Данная технология позволяет добиваться желаемого результата при значительном снижении риска осложнений и требует меньших сроков госпитализации. Кроме того, ангиохирургический способ уменьшения объемов предстательной железы позволяет гораздо быстрее достигать требуемого улучшения качества мочеиспускания по сравнению с терапией ингибиторами 5α-редуктазы.Однако в ходе курации пациентов необходимо помнить, что проведение любого ангиографического исследования сопряжено с риском развития контрастиндуцированной нефропатии (КИН) – состоя-ния, при котором уровень креатинина в сыворотке крови повышается на 44 мкмоль/л, или на 25% от начального уровня, в течение 48 ч после введения контрастного вещества в отсутствие аллергических причин. Распространенность КИН в общей популяции не превышает 2%. В группах высокого риска (СД 1 и 2 типов, хроническая почечная и сердечная недостаточность, анемия, дегидратация, длительное/регулярное применение нестероидных противовоспалительных средств) КИН занимает 3-е место среди причин развития ОПН, ее доля составляет 20–30%. В связи с этим следует обращать особое внимание на возможный риск развития КИН в послеоперационном периоде [10].Дополнительным поводом обсуждения полученных результатов явился не только факт отсутствия снижения эректильной функции в 1-й группе, но даже ее улучшение у ряда пациентов. Так, через год после выполнения РЭВОАП пациенты отметили улучшение качества эрекции, оцененное с помощью опросника МИЭФ-5 с 15,3±3,5 (11–25) до 19,9±3,2 (13–25) балла (р=0,48). Объяснение данного обстоятельства мы склонны видеть в возможном перераспределении притока крови в малом тазу с усилением его в пудендальных артериях. В то же время в группе больных, получавших ингибиторы 5α-редуктазы, отмечено ожидаемое снижение сексуальной функции (рис. 4, в). Что касается частоты развития послеоперационных осложнений и сроков госпитализации, то метод РЭВОАП выявил неоспоримые преимущества по сравнению с ОАЭ.В настоящее время РЭВОАП расценивается нами с точки зрения трех возможных тактик лечения:
1. Окончательный вид медицинской помощи, не требующий дополнительной медикаментозной терапии.
2. Возможность поддержания в дальнейшем достигнутой положительной динамики уменьшения размеров АПЖ после РЭВОАП с помощью консервативной терапии.
3. РЭВОАП является первым этапом подготовки пациента к эндоскопическим оперативным вме-шательствам в случае неэффективности консервативной терапии.
Заключение
Таким образом, использование представленной инновационной технологии расширяет возможности выбора метода лечения АПЖ, что в конечном итоге способствует улучшению результатов терапии данного заболевания в каждом конкретном случае. РЭВОАП отражает концепцию инновационного развития отечественной медицины и делает возможным более глубоко изучить самое распространенное урологическое заболевание, что позволит в будущем улучшить оказание медицинской помощи мужчинам пожилого и старческого возраста в Российской Федерации


