Введение. В развитых странах рак предстательной железы (РПЖ) является второй по частоте диагностируемой злокачественной опухолью и третьей среди причин смерти от рака у мужчин [1]. С учетом неблагоприятного прогноза запущенного РПЖ лечение на ранних стадиях может препятствовать прогрессированию небольшой локальной карциномы до большого метастатического поражения, способствуя снижению числа смертельных исходов. Введение в клиническую практику теста на простатспецифический антиген (ПСА) в сыворотке крови способствовало повышению выявляемости РПЖ. Однако зачастую тест дает ложноположительные и ложноотрицательные результаты [2], особенно в так называемой серой зоне (4–10 нг/мл), когда затруднена дифференцировка РПЖ от аденомы предстательной железы (АПЖ), простатита, при которых часто
увеличивается уровень ПСА в сыворотке крови. Выполнение пациентам манипуляций на простате и
уретре также могут повышать уровень этого маркера [3]. В то же время отмечено значительное количество диагностированных случаев РПЖ при уровне ПСА ниже 4 нг/мл (около 20–30%) [4].
Все это диктует необходимость поиска новых маркеров для улучшения ранней диагностики РПЖ
и уменьшения необходимости проведения биопсий предстательной железы. Новой парадигмой
для увеличения чувствительности и специфичности диагностических тестов становится использование
комбинации нескольких маркеров. В связи с этим наблюдается повышенный интерес к применению
протеомики в исследовании в области клинической диагностики и прогностической медицины. Одна из
основных целей протеомики – поиск и идентификация белков, дифференциально экспрессированных
(ДЭ) в биообразцах, полученных от больных и здоровых индивидов.
Сыворотка/плазма крови человека содержит тысячи пептидов, большинство из которых, как считают,
являются фрагментами больших белков, частично разрушенных эндогенными протеолитическими
ферментами [5, 6]. Сложным пептидом, который они создают, однако, можно обеспечить новый и
надежный отпечаток биологических событий во всем организме.
Масс-спектрометрия (MS) – новая технология, обеспечившая быстрый прогресс в области протеомных исследований. С помощью MS можно получить профили экспрессии белков в биологических образцах человека и обнаружить потенциальные биомаркеры рака. Недавние исследования показали эффективность профилирования протеомов в качестве диагностического или прогностического теста для больных РПЖ, используя MS с усиленной поверхностью лазерной десорбцией/ионизацией (SELDIMS) [7]. Технологию SELDI-MS одну из первых применили в качестве профилирования низкомолекулярного протеома (НМП) клинических образцов сыворотки крови для идентификации потенциальных биомаркеров многих видов злокачественных
опухолей человека, включая рак предстательной железы [7–11], толстой кишки [12], мочевого пузыря [13], молочной железы [14], яичников [15, 16] и др. Однако возникли серьезные проблемы с воспроизводимостью технологии SELDI-MS и появилась необходимость в новых масс-спектрометрических стратегиях поиска биомаркеров для раннего обнаружения рака.
Целью данного исследования явились разработка и апробирование новой методологии поиска потенциальных биомаркеров РПЖ. Данный подход включил три основных компонента: предварительное фракционирование образцов плазмы крови магнитными микрочастицами со слабой катионообменной поверхностью [17–21], анализ полученной субфракции низкомолекулярного протеома (НМП) с помощью времяпролетной масс-спектрометрии с активированной матрицей лазерной десорбцией/ионизацией (MALDI-TOF-MS), биоинформационную обработку данных. Продемонстрированы возможности разработанного подхода к обнаружению потенциальных маркеров РПЖ. Выполнен скрининг 46 образцов плазмы крови больных РПЖ и 26 контрольных образцов. В результате проведенного исследования обнаружены пептиды/полипептиды, которые могут в перспективе использоваться в качестве детектирования этого заболевания.
Материалы и методы. Образцы крови больных РПЖ получали из урологического отделения ФГБУ
“РОНЦ им. Н.Н. Блохина” РАМН. В качестве контрольной группы (КГ) использовали образцы от практически здоровых мужчин.
Забор крови проведен в пробирки Vacuta натощак у больных до оперативного вмешательства или
до начала применения противоопухолевой терапии. Кровь центрифугировали в течение 10 мин при 3000 об/мин (1600 g), полученную плазму аликвотировали по 100 мкл и хранили при -80°С. Перед использованием образцы размораживали при комнатной температуре в течение 15 мин и немедленно обрабатывали. Исследовали плазму крови, полученную от 46 больных с гистологически подтвержденным РПЖ (II стадия – 29 больных, III стадия – 17) и 26 практически здоровых мужчин КГ. Возраст больных РПЖ варьировался от 41 года до 70 лет, индивидов КГ – от 25 до 66 лет.
Для предварительного фракционирования НМП плазмы крови, основанного на ионообменных свойствах молекул, использован набор реактивов Profiling Kit 100 MB-WCX “Bruker Daltonics”, содержащий
магнитные микрочастицы со слабой катионообменной поверхностью. Эта процедура выполнялась по
протоколу производителя “Bruker Daltonics” и была необходима из-за присутствия большого разнообразия пептидов/полипептидов в НМП плазмы, а также для снижения эффекта влияния сопутствующих веществ на масс-спектрометрический анализ. Часть полученной фракции пептидов/полипептидов (2 мкл) наносили на стальную полированную 384-луночную MALDI-мишень (Bruker MTP 384 target plate polished steel TF) в 2 повторах, после высушивания на воздухе образец покрывали раствором матрицы (2 мкл). В качестве матрицы применена смесь 2,5-дигидроксибензойной (3 мг/мл) и α-циано-гидрокси-коричной (2,4 мг/мл) кислот в смеси метанол–ацетонитрил–вода в соотношении 5:4:1 [17].
Протеомный анализ проведен на времяпролетном масс-спектрометре Ultraflex II “Bruker Daltonics” по
методике, разработанной нами ранее [21]. В результате был получен сигнал суммарной интенсивности
ионов не менее 106.
Для процессирования и генерации масс-фингерпринта с помощью биоинформационного пакета
ClinProToolsTM 2.0 “Bruker Daltonics” (CPT) обработаны все спектры с отношением сигнал/шум более
3 и разрешением 800 в диапазоне m/z 1000–17 000 Да. При построении классификационных моделей
(процесс обучения) с помощью ClinProToolsTM 2.0 и внешней проверки их дискриминационной способности образцы больных РПЖ и контроля делили пополам, при этом одну часть использовали при
построении модели (обучение), вторую – при ее валидации. В результате получена серия нормализованных площадей пиков в каждом спектре, которые использовались ClinProToolsTM 2.0 при формировании средних масс-спектров каждого класса и построении моделей, различающих образцы больных РПЖ и индивидов КГ.
Наряду с методами классической статистики программа CPT использовала различные алгоритмы построения классификационных моделей, такие как генетический алгоритм (ГА), метод опорных векторов (МОВ), нейронные сети с учителем (НСУ), алгоритм быстрой классификации (АБК).
Разделительную способность модели оценивали перекрестной и внешней валидацией.
Результаты. В настоящем исследовании мы проверили гипотезу, согласно которой НМП плазмы
крови больных РПЖ отличается количественно или качественно от НМП индивидов без рака и это различие можно использовать для поиска кандидатных опухолевых маркеров. Сравнение спектральных профилей, полученных CPT из серии данных в обучающей фазе эксперимента, показало, что ряд ионов, отвечающих молекулам пептидов/полипептидов, имеют различные интенсивности для двух популяций (табл. 1).
Таблица 1. Часть результатов статистического анализа усредненных масс-спектров плазмы крови пациентов двух групп (РПЖ/контроль) после обработки программой ClinProToolsTM 2.0.
Анализ показал, что пики масс-спектров представляли в основном однозарядные ионы протонированных пептидов/полипептидов. В обучающем тесте детектировали 211 различных пиков/спектр при отношении сигнал/шум более 3 в диапазоне масс-ионов от 1000 до 17 тыс. Да (200 для 1–10 кДа, 11 для 10–17 кДа), что давало матрицу из 211х38 интенсивностей (площадей) пиков для двух классов. Данные статистической обработки, часть из которых представлена в табл. 1, показали, что 114 пиков имели достоверно различающиеся уровни сигнала (р<0,01) в масс-спектрах образцов плазмы больных РПЖ и здоровых индивидов КГ. Из анализа усредненных масс-спектров видно, что интенсивность 28 пиков у больных РПЖ увеличивалась, а 86 пиков – уменьшалась (p<0,01). Все эти ионы относились к дифференциально экспрессированным пептидам/белкам, которые можно рассматривать в качестве потенциальных маркеров РПЖ. Для иллюстрации различий в усредненных масс-спектрах двух изучаемых групп на рис. 1 представлен отдельный участок спектра в диапазоне масс 4920–6240 Да. Пики с m/z5723 и 6101 имеют различные интенсивности для двух классов (больных РПЖ и здоровых мужчин) и соответствуют пептидам/полипептидам с повышенным уровнем экспрессии у больных.
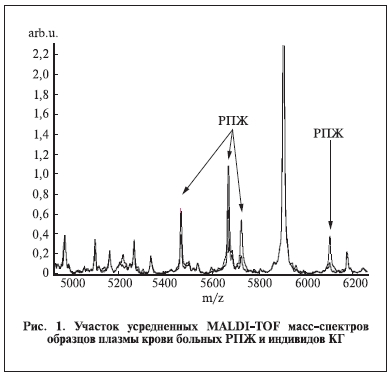
Наибольший интерес заслуживают ДЭ пептиды/полипептиды, представленные в масс-спектре протонированными ионами со значениями m/z 5723, 6101, 2821, 2788 Да, и некоторые другие (табл.
1), интенсивности которых более чем в 1,5 раза с наибольшей статистической достоверностью различались между двумя классами. Эти пики расположены в верхней части табл. 1 и имеют высокие
значения площади (AUC) под ROC-кривой (receiver operating characteristic – операционная характеристика приемника), характеризующей их дискриминационную способность.
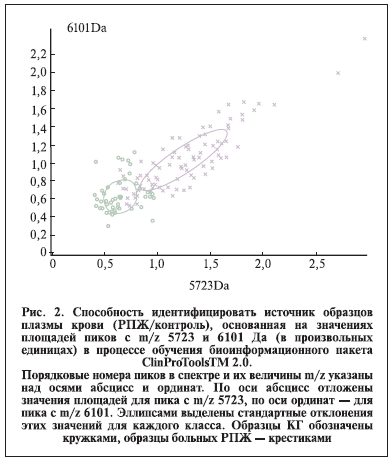
Для иллюстрации дискриминационной способности комбинации из двух таких пиков масс-спектра на рис. 2 представлено двумерное распределение ихплощадей (в произвольных единицах) для каждого
образца (РПЖ/КГ), используемого в процессе обучения CPT. Как видно из приведенного графика,
большая часть значений площадей этих пиков в образцах КГ меньше, чем в образцах больных РПЖ.
Генерация моделей проведена в диапазоне массспектра от 1000 до 17 тыс. Да. Для предварительной оценки их дискриминационной способности использован протокол перекрестной проверки, в котором программа ClinProToolsTM 2.0 случайно выбрала 2/3 данных в качестве набора обучения и 1/3 – как испытательный набор, чтобы определить, насколько правильно данная модель могла предсказать РПЖ. В табл. 2 представлены результаты перекрестной проверки, которые демонстрируют высокую дискриминационную способность (более 96%) моделей, построенных методом ГА, МОВ и НСУ.
Таблица 2. Результаты перекрестной проверки дискриминационных моделей, построенных с помощью различных классификаторов.
Полученные при анализе обучающей серии образцов наборы пиков, отличающие образцы плазмы
крови больных РПЖ от КГ, далее использовали для внешней проверки в независимой серии из 34 образцов. На основе результатов испытательной серии вычисляли чувствительность и специфичность построенных дискриминационных моделей. Как видно из табл. 3, наивысшее значение этих параметров имели наборы пиков, выявленные методом МОВ.
Анализ качественного состава модели МОВ, представленного в табл. 4, показал, что она состояла из
19 пиков, 17 из которых имели достоверно различающиеся уровни сигнала (p<0,01) для двух классов
(AUC>0,6). Данная модель разделяла образцы плазмы крови пациентов РПЖ и контроля с чувствительностью 97% и специфичностью 99% (см. табл. 3). Для сравнения в табл. 5 приведены подобные параметры для модели, построенной с помощью метода ГА, состоящей из 5 пиков, в которой 3 пика имели достоверно различающиеся уровни сигнала (p<0,01) для двух классов (AUC>0,6). Эта дискриминационная модель разделяла образцы плазмы крови пациентов РПЖ и контроля с чувствительностью 91% и специфичностью 97% (см. табл. 3).
Таблица 3. Чувствительность и специфичность (в %) построенных дискриминационных моделей
(данные внешней проверки с помощью дополнительной серии образцов).
Таблица 4. Качественный состав дискриминационной модели, построенной с помощью метода опорных векторов.
Таблица 5. Качественный состав дискриминационной модели, построенной с помощью генетического алгоритма.
Обсуждение. Технология SELDI-MS была одной из первых, которую стали применять при профилировании клинических образцов сыворотки/плазмы крови для идентификации потенциальных биомаркеров РПЖ. Е. Petricoin и соавт. [9] идентифицировали набор белков сыворотки крови, который успешно обнаружил 36/38 больных РПЖ и 177/228 – АПЖ. Другие исследователи также использовали диагностические наборы протеинов для выявления РПЖ и получили многообещающие результаты. При обучении двух различных биоинформационных алгоритмов – классификатора AdaBoost и классификатора Boost Decision Stump Feature Selection – на данных, полученных методом SELDI-MS от 197 больных РПЖ, 92 АПЖ и 96 контрольных индивидов, Y. Qu и соавт. [8] достигли 100 и 97% чувствительности и специфичности соответственно для тестовой серии из 30 больных РПЖ, 15 АПЖ и 15 доноров. D. Ornstein и соавт. [22] использовали биоинформационную программу Proteome Quest beta version 1.0 вместе с методом SELDI-MS на масс-спектрометре QSTAR Pulsar при профилировании протеома образцов сыворотки крови с уровнями ПСА между 2,5 и 15 нг/мл. Полученный набор протеинов продемонстрировал 100%-ную чувствительность и 67%-ную специфичность на тестовых образцах. Это означает, что 67% пациентов, возможно, избежали ненужных биопсий, не опасаясь при этом остаться с невыявленным раком. Kohli и соавт. [23] нашли специфический профиль биомаркеров, достоверно (p<0,05) связанный с прогнозом поздней стадии РПЖ, который лечили с использованием андрогенной депривации. Авторы применяли метод SELDIMS в сочетании с тестами Краскелла–Уоллиса для определения различий между группами и оценили не зависимую от ПСА связь каждого индивидуального пика с полной выживаемостью.
Предложен ряд усовершенствований для повышения надежности и воспроизводимости SELDI-MS
[24, 25]. Другой подход предусматривает использование более чувствительного MALDI-TOF-MS-метода. А. M’koma и соавт. [26] нашли, что 130 сигналов масс-спектра в диапазоне m/z 1000–5000 Да отличали РПЖ от АПЖ со специфичностью 71,2% и чувствительностью 67,4%. Они также различили образцы АПЖ и высокодифференцированной интраэпителиальной неоплазии предстательной железы (ВИHПЖ) со специфичностью 73,6% и чувствительностью 69,2%, а РПЖ и ВИНПЖ – со специфичностью 80,8% и чувствительностью 81%. J. Al-Ruwaili и соавт. [7] использовали SELDI-MS-анализ с целью идентифицировать ДЭ белков сыворотки крови, сравнив образцы больных РПЖ с вялотекущим и
агрессивным течением заболевания (согласно шкалы Глисона). Авторы идентифицировали 26 дифференциально экспрессированных белков (p<0,05), из которых 20 были найдены с 99%-ной достоверностью. В общей сложности 18 дифференциально экспрессированных белков (p<0,05) различали группы больных с рецидивами и без. Чувствительность и специфичность в пределах группы с учетом шкалы Глисона составили 73,3 и 60% соответственно, а для групп с рецидивами – 70 и 62,5% [7].
В отличие от этих исследований мы использовали технологию MALDI-TOF-MS, в настоящее время
разработанную значительно лучше, чем SELDIMS. При профилировании плазмы больных РПЖ
и представителей КГ мы обнаружили ряд ионов, которые отвечали ДЭ протонированным пептидам/
полипептидам (например, с m/z 1179, 1505, 1553, 1607, 2803, 6376 Да). По нашему мнению, они представляют собой циркулирующие пептиды/белки или их фрагменты, уровни концентраций которых
модулируются опухолевым процессом. После предварительного фракционирования плазмы крови на
магнитных частицах MB-WСX, MALDI-TOF-MS, анализа и обработки полученных данных с помощью
ClinProToolsTM 2.0 были обнаружены потенциальные маркеры, различные комбинации которых позволяли разделять образцы больных РПЖ и КГ с чувствительностью более 83% и специфичностью свыше 93%. С большой долей вероятности можно утверждать, что отобранные маркеры обладают высокой дискриминационной способностью. Тем не менее число проанализированных нами образцов плазмы крови больных РПЖ относительно невелико, что может сказаться на проверке качества представленных моделей. В связи с этим необходимы дальнейшие исследования для подтверждения и уточнения полученных результатов. После идентификации и синтеза ключевых белков могут быть созданы антитела для разработки высокопроизводительных дешевых тест-систем. В дальнейшем эти наборы могут быть включены в проспективные испытания для оценки прогнозирующего значения этих белков в распознавании рака.
Заключение. Разработана и апробирована новая методология поиска биомаркеров РПЖ – профилирование НМП плазмы крови. Данный подход включал предварительную подготовку образцов,
времяпролетную масс-спектрометрию с активированной матрицей лазерной десорбцией/ионизацией, биоинформационную обработку данных. Продемонстрированы возможности разработанного подхода к обнаружению потенциальных маркеров РПЖ. Осуществлен скрининг 46 образцов плазмы крови больных РПЖ и 26 контрольных образцов. В результате проведенного исследования обнаружены пептиды/полипептиды, которые могут в перспективе использоваться в качестве детектирования этого
заболевания.


