Введение. Развитие тубулоинтерстициального фиброза является закономерным исходом хронического воспалительного процесса в мочевыводящих путях (МВП), возникающего на фоне нарушения уродинамики функционального или органического генеза, ремоделирования почечного кровотока, присоединения ишемического и инфекционного повреждающего фактора [1, 2]. Именно длительность и выраженность стадии альтерации в условиях тканевой гипоксии и предопределяют вектор развития воспалительного процесса в почечной паренхиме [3, 4]. Однако до настоящего времени недостаточно изучена степень участия различных биологически активных веществ в развитии и прогрессировании поражения почек при хроническом обструктивном пиелонефрите (ХОП) у детей. Остаются открытыми
вопросы ранней диагностики, мониторирования и прогнозирования течения ХОП в условиях врожденной обструкции МВП [5–7]. Не получил широкого распространения мониторинг уровня различных цитокинов в целях оценки эффективности комплексной терапии заболевания.
Целью настоящего исследования явилась разработка новых чувствительных диагностических и прогностических критериев оценки тяжести течения ХОП в периоперационном периоде у детей на основании сравнительного анализа изменений содержания биологически активных веществ в различных биологических средах (сыворотке крови, моче, биоптате тканей МВП и почки).
Материалы и методы. Были обследованы 349 пациентов с различными вариантами врожденной обструкции МВП. В зависимости от уровня и степени обструкции все больные были разделены на три группы. Первая включала 155 пациентов с гидронефрозом (108 детей) и уретерогидронефрозом (47 детей). Вторую группу составил 171 ребенок с пузырно-мочеточниковым рефлюксом (ПМР). В 3-ю группу вошли 23 больных с инфравезикальной обструкцией. В каждой группе выделялись подгруппы в соответствии с фазой течения ХОП: подгруппа А – больные ХОП в фазу латентного воспаления;
подгруппа Б – больные ХОП в фазу активного воспаления. Средний возраст пациентов составил 5,1±4,6 года. В группу сравнения вошли 30 детей с хирургическими заболеваниями легкой степени тяжести (пупочной или паховой грыжей) в предоперационном периоде, стратифицированных по полу и возрасту.
Стандартный комплекс обследования проведен всем пациентам до коррекции обструкции и на 3–5-е сутки после оперативного вмешательства по унифицированным методикам. Использованы клинико-лабораторные (общий анализ периферической крови, общий анализ мочи, бактериологический анализ мочи и анализ мочи по Нечипоренко), ультразвуковые, рентгеноурологические и эндоскопические методы исследования. Бактериологическому исследованию подвергли мочу, полученную при естественном мочеиспускании и при катетеризации мочевого пузыря, а также смывы с эндоскопического оборудования (n=28) и биоптаты (n=35) пиелоуретерального, уретеровезикального и мочеточникового сегментов, взятые интраоперационно.
Для уточнения механизмов развития ХОП в периоперационном периоде и выявления роли различных факторов в его поддержании у 167 пациентов с различными вариантами врожденной обструкции МВП и 30 детей группы сравнения было выполнено количественное определение биологически активных веществ (острофазных белков (высокочувствительного С-реактивного белка [СРБ], церулоплазмина [ЦП]), провоспалительных (интерлейкин [ИЛ]-1β, ИЛ-6, -8, ФНО-α) и противовоспалительных (ИЛ-4, -10) цитокинов, молекул межклеточной адгезии (sЕ-селектина) в различных биологических средах (сыворотка крови, моча). Весь биоматериал собирался до начала лечения обструктивной уропатии (при установленном урологическом
диагнозе), а также на 3–5-й день после операции. При открытых реконструктивно-пластических операциях интраоперационно произведен забор фрагментов пиелоуретерального, уретеровезикального сегментов; при нефрэктомии исследованию подвергли участки почечной паренхимы.
Цитокины в сыворотке крови, биоптате и моче определены методом твердофазного иммуноферментного анализа с помощью тест-систем “Вектор-Бест” (Россия, Новосибирск) (ИЛ-1β, -6, -8, ФНО-α, ИЛ-4), молекулы межклеточной адгезии (селектины – sЕ) и ИЛ-10 с применением наборов “Bender Medsystems” (Австрия) на иммуноферментном анализаторе Stat Fax 2010 (“Stat Fax”, США).
Определение СРБ осуществлено с помощью CRP U-hs универсального/высокочувствительного теста, рекомендованного для диагностики воспаления и кардиоваскулярных с использованием наборов фирмы “DiaSys Diagnostics Systems GmbH”. Для определения уровня ЦП применены наборы фирмы “Sentinel Diagnostics”. Результаты. На момент начала исследования большинство больных 1-й и 2-й групп находились в стадии ремиссии (62,6 и 67,3% соответственно), тогда как все пациенты 3-й группы имели признаки воспалительного процесса в мочевой системе. При базисном лабораторном обследовании пациентов с ХОП в фазе активного воспаления во всех группах больных были отмечены
изменения состава периферической крови – лейкоцитоз, изменение индексов клеточной реактивности; биохимические сдвиги в сыворотке крови: диспротеинемия, гипоальбуминемия. Значимые изменения были обнаружены в общем анализе мочи и анализе мочи по Нечипоренко: снижение плотности мочи, микрогематурия, лейкоцитурия, незначительная протеинурия.
Изменение размеров почек, толщины и структуры паренхимы по результатам ультразвукового метода
исследования в большей степени отражало морфологические изменения в почках при пиелонефрите и не всегда могло служить ранними диагностическими критериями выявления заболевания.
Важным в диагностике ХОП было микробиологическое исследование с идентификацией возбудителя
в МВП. При гидронефрозе микроорганизмы в моче были обнаружены у 75% пациентов, при уретерогидронефрозе — у 83%, при ПМР — у 81,5%. У 100% детей с инфравезикальной обструкцией зарегистрирована бактериурия. Наиболее часто у детей с обструктивными уропатиями выделяли E. coli (32–42,6%). При нарушении уродинамики в нижних отделах МВП (ПМР и инфравезикальная обструкция) возрастала частота идентификации грамотрицательной микрофлоры (Proteus spp.,
Klebsiella spp., Pseudomonas spp.). У 20% детей с обструктивными уропатиями в отсутствие бактериурии выявлены микроорганизмы в биоптате МВП или в смывах с одноразовых игл, с помощью которых осуществлена эндоимплантация биоматериала в подслизистый слой устья мочеточника. Микрофлора 25% пациентов, выделенная из биоптата и мочи, различалась.
Таким образом, проведенный стандартный комплекс клинико-лабораторных, микробиологических, вспомогательных методов исследований исходно позволял устанавливать форму обструкции МВП и констатировать фазу активного воспаления ХОП. Значимых объективных критериев оценки тяжести течения воспалительного процесса в МВП в фазе латентного воспаления ХОП не выявлено. Данные стандартного комплекса клинико-лабораторного обследования пациентов всех групп, имевших исходно ХОП в фазе активного воспаления, на 3–5-е сутки после операции достоверно не отличались от показателей до коррекции вне зависимости от уровня обструкции и выбора метода лечения.
Результаты обследования детей без заболевания мочевыделительной системы (группа сравнения) были приняты за норму (табл. 1).
Таблица 1. Сравнительный анализ показателей острофазных белков и цитокинового профиля у больных в фазе латентного воспаления ХОП до операции.
Исходно у больных ХОП в фазе латентного воспаления на фоне гидро- или уретерогидронефроза отмечено умеренное повышение содержания СРБ (р<0,004), провоспалительных цитокинов (ИЛ-6, ИЛ-8) как в сыворотке крови (р<0,02), так и в моче (р<0,001), что свидетельствовало о наличии очага хронического вялотекущего воспаления в почках (см. табл. 1). Имелся выраженный параллелизм изменений цитокинового профиля в моче и биоптатах мочевого тракта (табл. 2). Кроме того,
увеличение содержания провоспалительных фракций цитокинов в биоптате и моче коррелировало с количественными (по числу клеток) и качественными (по клеточному составу) характеристиками воспалительных инфильтратов мочевыводящей системы, обнаруженных при морфологическом исследовании.
Таблица 2. Уровень цитокинов и молекул межклеточной адгезии в биоптате пиелоуретерального
и уретеровезикального сегментов у больных 1-й группы (М±SD).
В раннем послеоперационном периоде (3–5-е сутки после операции) у этих больных выявлены признаки активации ХОП: повышение содержания ИЛ-1β (р<0,04), ИЛ-6 (р<0,001), ИЛ-8 (р<0,0001) (табл. 3). Однако отмечено сбалансированное повышение содержания как про-, так и противовоспалительных цитокинов (ИЛ-4 (р<0,02), ИЛ-10 (р<0,05)).
Таблица 3. Сравнительный анализ показателей острофазных белков и цитокинового профиля у больных в фазе латентного воспаления ХОП на 3–5-е сутки после операции.
У пациентов с ХОП в фазе активного воспаления на фоне гидро- и уретерогидронефроза, подтвержденных результатами стандартного клинико-лабораторного обследования, исходно были зафиксированы диагностически значимые сдвиги основных биологических маркеров воспаления по отношению к группе сравнения — острофазных белков (СРБ [р<0,001], ЦП [р<0,02]), провоспалительных цитокинов (ИЛ-1β, -6, -8, ФНО-α) и молекул межклеточной адгезии (sЕ-селектина) в отсутствие достоверных изменений со стороны противовоспалительных интерлейкинов (ИЛ-4, -10) (табл. 4).
В раннем послеоперационном периоде проявления системного воспалительного ответа купировались, что подтверждено снижением уровня острофазных белков, основных провоспалительных цитокинов и молекул межклеточной адгезии в сыворотке крови (табл. 5). Однако локальные проявления воспалительного процесса в МВП сохранялись, о чем свидетельствовали высокие концентрации основных провоспалительных медиаторов в моче.
Для детей с ПМР и ХОП в фазе латентного воспаления в отсутствие клинических проявлений были характерны следующие изменения: умеренное повышение содержания СРБ (р<0,05) до операции; снижение концентрации ЦП (р<0,04) к 3–5-м суткам после операции; повышение уровня провоспалительных ИЛ-6 (р<0,01), ИЛ-8 (р<0,01) в сыворотке крови с одновременным однонаправленным изменением уровня противовоспалительного ИЛ-10 (р<0,008); значительное увеличение содержания ИЛ-8 в моче на протяжении всего периода наблюдения; умеренное повышение концентрации ИЛ-6 в моче на фоне снижения уровня противовоспалительного ИЛ-10 на 3–5-е сутки после коррекции рефлюкса (см. табл. 1, 3). Несмотря на ликвидацию ПМР, в раннем послеоперационном периоде сохранялись признаки воспалительного процесса в МВП, которые требовали дальнейшего динамического наблюдения.
Для больных подгруппы 2Б с ХОП в фазе активного воспаления на фоне ПМР было характерно повышение уровня СРБ, провоспалительных цитокинов (ИЛ-6, -8) в сыворотке крови при одновременном однонаправленном нарастании содержания противовоспалительного ИЛ-10 в предоперационном периоде; увеличение содержания всех провоспалительных цитокинов в моче. При
этом уровень противовоспалительных цитокинов был неизменным на протяжении всего периода наблюдения (см. табл. 4, 5).
Таблица 4. Сравнительный анализ основных биологических маркеров воспаления у больных
в фазе активного воспаления ХОП до операции (М±SD).
Таблица 5. Сравнительный анализ содержания основных биологических маркеров у больных в фазе активного воспаления ХОП на 3–5-е сутки после операции (М±SD).
Детальное изучение основных биологических маркеров воспаления в 3-й группе больных с инфравезикальной обструкцией и ХОП в фазе активного воспаления выявило резкое повышение уровня острофазных белков в сыворотке крови до ликвидации уретеральной непроходимости с последующим снижением показателей в раннем послеоперационном периоде (см. табл. 4, 5). Наибольшую чувствительность и специфичность для диагностики активного воспалительного процесса в мочевом тракте, как и в предыдущих группах больных, проявили такие биомаркеры, как СРБ (р<0,05) в сыворотке крови, ИЛ-6 (р<0,05), ИЛ-8 (р<0,05) и в сыворотке крови, и в моче.
При сравнительном межгрупповом анализе содержания различных биологических маркеров в зависимости от уровня обструкции и вида оперативного вмешательства при условии одинаковой фазы воспаления ХОП получены данные относительно исходного состояния воспалительного процесса у пациентов различных групп. В сыворотке крови больных 1-й группы с ХОП в фазе латентного воспаления на фоне гидро- и уретерогидронефроза изначально были более высокие уровни СРБ (р<0,01) и провоспалительного ИЛ-1β (р<0,0001) (см. табл. 1). Однако у пациентов 2-й группы с ПМР имело место достоверно более высокое содержание провоспалительного ИЛ-8 (р<0,01). В моче отличия касались только концентрации sЕ-селектина (р<0,05). Как видно, значимых различий выявить не удалось, поэтому сделать однозначный вывод о влиянии уровня обструкции на течение воспалительного процесса в МВП нельзя.
В раннем послеоперационном периоде в этих группах больных зарегистрированы более существенные
различия в содержании основных биомаркеров (см. табл. 3). Так, в сыворотке крови пациентов 1-й группы отмечены более высокие уровни СРБ (р<0,001), ИЛ-1β (р<0,0005) и более низкий уровень ЦП (р<0,02). В моче имелось достоверное повышение концентрации провоспалительных ИЛ-1β (р<0,007), ИЛ-8 (р<0,04), ФНО-α (р<0,04) и противовоспалительного ИЛ-10 (р<0,002), а также sЕ-селектина (р<0,04). По всей видимости, коррекция обструкции в верхних отделах мочевого тракта путем открытого оперативного вмешательства приводила к временному обострению локального воспалительного процесса, что проявлялось в изменении уровней основных биологических маркеров воспаления.
Сравнительный межгрупповой анализа выявил, что в фазу разгара воспалительного процесса ни уровень обструкции, ни вид оперативного вмешательства существенно не влияли на уровень исследуемых биомаркеров (см. табл. 4, 5).
Для оценки диагностической значимости исследования цитокинов в моче был проведен ROC-анализ с
построением характеристических кривых при разных точках разделения значений показателей. Было установлено, что наибольшей чувствительностью и специфичностью для регистрации степени выраженности воспаления и его мониторинга в мочевом тракте в процессе развития ХОП при различных уровнях обструкции имеет исследование содержания СРБ в сыворотке крови и ИЛ-6, -8 в моче (см. рисунок).
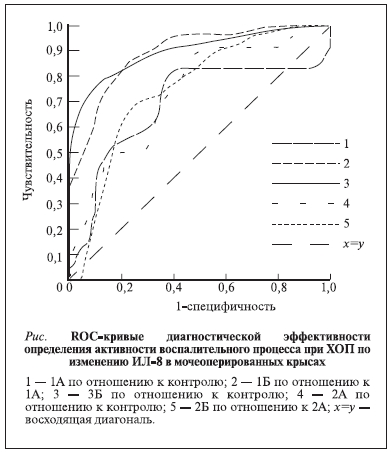
Поскольку с точки зрения основных закономерностей развития воспалительного процесса имеют значение не абсолютные значения уровней цитокинов, а баланс между провоспалительными и противовоспалительными фракциями, нами был предложен интегративный показатель – индекс активности воспаления (ИАВ). Данный индекс рассчитан как соотношение концентраций провоспалительного ИЛ-8, показавшего высокую чувствительность и специфичность диагностики воспалительного процесса в МВП, к противовоспалительному ИЛ-10, ингибирующему функциональную активность макрофагов, синтез моноцитами и макрофагами провоспалительных цитокинов, колониестимулирующих факторов, молекул межклеточной адгезии (табл. 6).
Таблица 6. Динамика ИАВ у детей с ОУ в периоперационном периоде.
С помощью многофакторного логистического регрессионного анализа построена математическая модель, согласно которой установлено, что вероятность обострения ХОП в раннем послеоперационном периоде напрямую зависела от исходного уровня ИАВ в моче (р<0,0081).
Обсуждение. Воспалительный процесс, развившийся в мочевой системе на фоне обструктивной уропатии, долгое время носит локальный характер, принимая при этом хроническое рецидивирующее течение. Даже в отсутствие клинических проявлений ХОП имеются достоверные изменения уровня различных биологических маркеров как в сыворотке крови, так и в моче, которые отражают степень выраженности воспалительного процесса в МВП.
Доказано, что обострение ХОП происходит на фоне нарушения баланса цитокинов, сопровождающегося недостаточностью противовоспалительных фракций (ИЛ-10) и избыточной продукцией провоспалительных медиаторов (ИЛ-6, -8). Изменение этих показателей определяет, по существу, вектор течения воспалительного процесса в мочевыводящей системе детей с обструктивными уропатиями, что позволяет рекомендовать определение данных маркеров в качестве скринингового метода для объективизации тяжести течения у них ХОП. Полученные нами результаты позволяют дополнить представления о механизмах развития ХОП. В фазе обострения ХОП происходит значительное увеличение содержания провоспалительных цитокинов не только в моче, но и в крови, что отражает распространенность воспалительного процесса, тяжесть течения и прогрессирование заболевания.
Заключение. Полученные в ходе работы результаты дали возможность выявить следующие закономерности формирования и прогрессирования ХОП у детей:
1. Для ранней диагностики и объективной оценки тяжести воспалительного процесса в мочевой системе в комплексное обследование детей с ХОП наряду с традиционными клинико-лабораторными методами целесообразно включать мониторирование содержания основных биологических маркеров воспаления (СРБ, ИЛ-6, -8, -10) как в сыворотке крови, так и в
моче.
2. Прогностически неблагоприятными критериями, свидетельствующими об обострении воспалительного процесса в МВП, являются резкое повышение содержания острофазных белков и цитокинов в сыворотке крови, нарушение баланса цитокинов, сопровождающееся недостаточностью противовоспалительных фракций (ИЛ-10) и избыточной продукцией провоспалительных медиаторов (ИЛ-6, -8).
3. Для прогнозирования и объективизации тяжести течения ХОП у детей необходимо рассчитывать ИАВ в моче как соотношение ИЛ8/ИЛ10. Увеличение данного показателя позволяет прогнозировать вероятность обострения ХОП в послеоперационном периоде.
4. Для прогнозирования течения ХОП у детей целесообразно использовать математическую регрессионную модель вероятности обострения ХОП в раннем послеоперационном периоде с учетом изменения ИАВ в моче и уровня обструкции.
Таким образом, расчет ИАВ может быть включен в алгоритм диагностики и ведения больных с обструкивными уропатиями для прогнозирования течения периоперационного периода и риска обострения хронического пиелонефрита, что чрезвычайно важно для педиатрической практики.
Исследование выполнено при поддержке Гранта Президента РФ МД-2767.2008.7.


