Введение. Лапароскопическая резекция почки – одна из активно обсуждаемых операций в урологии.
Первая лапароскопическая трансперитонеальная резекция почки была произведена H. Winfield и соавт. в 1993 г., а в 1994 г. I. Gill и соавт. произвели первую ретроперитонеальную резекцию почки [1, 2].
Показания к резекции почки делятся на абсолютные и относительные. К абсолютным показаниям относятся опухоль единственной почки или выраженное снижение функции контралатеральной почки и наличие заболеваний, приводящих к угнетению функции почек. К относительным показаниям относятся опухоль почки менее 5 см при наличии здоровой контралатеральной почки, а также другое неопухолевое поражение почки: удвоение почки с нефункционирующей половиной, нагноившийся дивертикул чашечки и т.д.
Внедрение в клиническую практику и совершенствование данной операции происходили благодаря клиническим наблюдениям, при которых больные добились абсолютных показаний к сохранению непораженной части почки. Однако в последнее время показания к проведению резекции почки значительно расширились. Накопленный опыт свидетельствует, что результаты радикальной нефрэктомии сопоставимы с таковыми резекции почки при опухолях не только менее 4 см, но и при больших – до 7 см [3, 4]. Многократные ретроспективные исследования не выявили различий между резекцией почки и радикальной нефрэктомией относительно частоты выживаемости больных и отдаленного метастазирования, но при этом после резекции почки больных была сохранена почечная функция [4, 5].
Риск местного рецидива при резекции почки по поводу рака также низок. Риск же возникновения новой опухоли на стороне поражения составляет 5%, что соответствует риску развития опухоли в контралатеральной почке [6].
Кроме того, несколько ретроспективных исследований демонстрирует лучшую общую выживаемость пациентов, перенесших резекцию почки, по сравнению с нефрэктомией, а также благоприятный долгосрочный прогноз в отношении почечной и сердечнососудистой функций [7, 8]. Радикальная нефрэктомия является признанным фактором развития и прогрессирования хронической почечной недостаточности. В ряде исследований была показана связь между снижением скорости клубочковой фильтрации менее 60 мл/ мин и риском развития ряда сердечно-сосудистых заболеваний. Помимо этого увеличивается срок госпитализации и риск смертности при снижении клубочковой фильтрации менее указанного уровня [9], в то время как органосберегающая операция на почке может улучшить эти показатели [10].
При наличии соответствующего опыта лапароскопическая операция служит альтернативой открытой резекции почки при опухоли почки стадии Т1, обладая всеми преимуществами минимально инвазивной хирургии [11]. В сравнительном исследовании [12] было показано, что пациенты, оперированные лапароскопическим способом, в течение более короткого периода находились в стационаре, требовали назначения меньшего количества наркотических анальгетиков, быстрее выздоравливали и социально адаптировались.
Целью исследования явилась оценка собственных результатов лапароскопической резекции почки.
Материалы и методы. С 2006 по 2011 г. лапароскопическая резекция почки по поводу различных заболеваний почек и верхних мочевыводящих путей была выполнена 38 пациентам в возрасте от 28 до 73 лет (средний возраст – 53,7 года). Мужчин было 17, женщин – 21. Пациенты условно разделены на две группы. Тридцать пациентов 1-й группы были оперированы по поводу опухоли почки, а 8 больных, оперированных по поводу других заболеваний (гидронефроз удвоенной половины – 5, мочекаменная болезнь – 2, L-образная почка – 1) составили 2-ю группу.
Всем пациентам проведено стандартное урологическое обследование, включившее лабораторные исследования, экскреторную урографию, УЗИ, а также спиральную компьютерную томографию (СКТ) с контрастированием. СКТ с болюсным контрастированием в сосудистом режиме позволяет выполнять непрямую ангиографию и отказываться от выполнения традиционного ангиографического исследования.
Помимо стандартного набора инструментов для лапароскопии использовали биполярные коагуляторы LigaSure и EnSeal, ультразвуковые скальпели Harmonic, SonoSurg, а также аргонплазменный коагулятор.
При выполнении лапароскопической резекции почки мы руководствовались принципами подобных открытых операций. Все операции проходили с контролем почечных сосудов и пережатием либо всей сосудистой ножки, либо только ветви почечной артерии, что выглядит предпочтительней. Техника обнажения сосудов почки аналогична таковой при нефрэктомии.
Пациента укладывали на операционный стол на бок, противоположный стороне оперативного вмешательства. Пневмоперитонеум создавали при помощи иглы Вереша. В ряде наблюдений (например, у пациентов, перенесших вмешательства на брюшной полости или страдающих ожирением) использовали открытую методику доступа через разрез длиной 2–3 см. Данная методика считается даже более безопасной и позволяет избегать осложнений, связанных с пункцией иглой Вереша. Видеокамеру устанавливали латеральнее и выше пупка (параректально). В ряде наблюдений у худых пациентов видеокамеру устанавливали в параумбиликальной области. Первый инструментальный троакар устанавливали в эпигастрии на 3–5 см ниже мечевидного отростка, второй – по переднеподмышечной линии на уровне гребня подвздошной кости. Мы предпочитали использовать троакары 10 мм, что обеспечивало удобство манипуляций и возможность применения 10 мм инструментов с любой стороны.
При операциях на правой почке дополнительно использовали троакар 5 мм для ретракции печени. Последний порт можно устанавливать в подреберье по переднеподмышечной линии или в эпигастрии на 2–3 см выше 10 мм троакара.
После ревизии брюшной полости производили мобилизацию толстой кишки, для чего рассекали брюшину вдоль латерального канала по линии Тольда. Важен момент правильного попадания в «слой», т.е. необходимо войти в межфасциальное пространство между фасцией Герота и мезоколон. При правильном выборе слоя мобилизация толстой кишки проходит практически бескровно.
При операции на правой почке после мобилизации восходящего отдела толстой кишки проводили мобилизацию двенадцатиперстной кишки по Кохеру, после чего обнажали нижнюю полую вену. Далее вскрывали фасцию, покрывающую нижнюю полую вену. Для этого, по нашему мнению, лучше использовать ультразвуковой диссектор, позволяющий работать на сосудах прецизионно. Особенно важно тщательно коагулировать мелкие коллатеральные вены, идущие к почечной и нижней полой венам. Выделение нижней полой вены проводили на несколько меньшем протяжении, чем при нефрэктомии. Достаточно обнажить участок ренокавального соустья.
После выделения полой вены необходима тщательная мобилизация почечной вены. На этом этапе повреждение окружающих сосудов малого калибра может приводить к кровотечению, затрудняющему визуализацию магистральных почечных сосудов, и ставить под сомнение возможность продолжения вмешательства лапароскопически.
Сместив почечную вену, можно визуализировать и выделить почечную артерию, расположенную дорсальнее, используя тупой изогнутый ретрактор. Процесс освобождения почечной артерии из окружающей клетчатки должен сопровождаться тщательной коагуляцией мелких сосудов. Для этой цели мы также используем ультразвуковой диссектор. С учетом возможности селективного сегментарного выключения кровотока целесообразно осуществлять выделение почечной артерии на протяжении от основного ствола (для возможности полного выключения кровотока) до сегментарного деления.
После выделения сосудистой ножки производили выделение почки из паранефральной клетчатки. Для удобства манипуляции (ротации почки) мы предпочитали освобождать почку от клетчатки полностью, особенно это важно при сложно расположенных для резекции опухолях (верхний сегмент, задняя поверхность почки). Далее в брюшную полость помещали все составляющие для осуществления гемостаза (гемостатический материал, игла с ниткой). И только после окончания приготовлений к резекции и фиксации почки в наиболее удобном для резекции и наложения швов положении пережимали сосудистую ножку – сначала артерию, потом вену при необходимости. Пережатие сосудов осуществлялось при помощи зажимов типа «бульдог».
Резекцию почки, как правило, проводили холодными ножницами в пределах здоровых тканей, отступя 0,5 см от опухоли. Наш опыт показывает, что удобнее начинать резекцию с ближнего края опухоли и далее, осуществляя тракцию опухоли вверх под визуальным контролем, углубляться в почку. Последней отсекали от почки дистальную поверхностную часть опухоли. Резецированную ткань и клетчатку, покрывавшую опухоль, помещали в контейнер, который извлекали позднее. Далее осуществляли гемостаз. При вскрытии полостной системы ее герметичность восстанавливали наложением швов. Для этого использовали моносин или викрил 3/0. Далее поверхность резекции обрабатывали с помощью аргонплазменной коагуляции. В ложе резекции укладывали гемостатический материал. Сопоставление краев резецированной поверхности осуществляли непрерывным швом паренхимы. С целью сокращения времени ишемии вместо завязывания узлов на концы нити в местах вколов накладывали титановые клипсы либо клипсы Hem-o-Loc. Важным моментом считаем наложение швов без избыточного натяжения, так как это позволит избежать прорезывания нити после включения почки в кровоток. После снятия зажимов с почечной ножки проводили оценку гемостаза. При необходимости накладывали дополнительные швы. Затем почку укладывали в физиологическое положение. К зоне резекции подводили дренажную трубку. Контейнер с опухолью удаляли через один из портов.
Результаты и обсуждение. Несмотря на преимущества, лапароскопическая резекция почки остается технически сложной операцией с более высоким уровнем интраоперационных осложнений и более длительным временем тепловой ишемии по сравнению с открытой резекцией почки. В ряде исследований получена значимая корреляция между временем ишемии и потерей почечной функции. Однако недавно некоторые авторы поставили под сомнение традиционные убеждения, будто время ишемии является определяющим фактором в сохранении дальнейшей функции почки. Было показано, что ишемия почки при выполнении ее резекции обусловливает возникновение острых нарушений почечной функции, но не влияет на долгосрочный прогноз функционирования оставшейся части органа, т.е. количество и качество сохраненной паренхимы гораздо более важны, чем продолжительность ишемии, для сохранения функции почки в отдаленном послеоперационном периоде [13].
Таким образом, при выполнении резекции почки стремление сократить время ишемии не должно достигаться в ущерб сохранению ее паренхимы и онкологическим принципам. Однако это не означает, что время ишемии должно быть полностью проигнорировано.
Существует несколько стратегий, направленных на уменьшение времени ишемии во время лапароскопической резекции почки. Одна из них заключается в отсроченном выключении почечного кровотока, когда зажим на почечную ножку накладывается только после обработки малокровоточащей (поверхностной) зоны резекции [14]. Возможно также применение биполярных и ультразвуковых коагуляторов. Указанные инструменты минимально влияют на повреждение краев раны, но и качество создаваемого ими гемостаза зачастую не всегда адекватно. Применение же аппарата «Хабиб» с целью гемостаза при лапароскопической резекции почки позволяет осуществлять надежный гемостаз, но и значительно ухудшает гистологическую интерпретацию краев резекции.
Одной из методик уменьшения ишемии почки является сжатие паренхимы почки, что особенно удобно при опухолях, расположенных в верхнем и нижнем сегментах. Для этого можно использовать руки хирурга при мануально ассистированных операциях или специальный зажим при полностью лапароскопических операциях [15].
Для улучшения прогноза функциональной способности почки после лапароскопической резекции использовали также холодовую ишемию, которая активно применяется при открытых операциях. Ретроспективный анализ показал, что при одинаковых функциональных результатах продолжительность холодовой ишемии существенно превышала продолжительность тепловой ишемии [13]. Так, если для тепловой ишемии почки оптимальным считается время от 20 до 30 мин, то в холодовом варианте допустимое время ишемии составляет от 35 до 50 мин [16]. Холодовая ишемия может осуществляться путем наружного охлаждения с помощью специального контейнера [17], ретроградного введения охлаждающего агента [18], а также внутриартериального введения охлажденных растворов [19].
Тем не менее, несмотря на попытки сократить продолжительность ишемии почки, надежность гемостаза остается одной из приоритетных задач. Наложение швов на резецированную поверхность почки – самый эффективный метод гемостаза и гермитичности полостной системы почки, однако в лапароскопическом варианте данная манипуляция требует владения сложной техникой наложения шва и занимает значительное количество времени. С целью сокращения времени наложения шва в настоящее время используются титановые или пластиковые клипсы Hemo-lock, доказавшие свою эффективность и безопасность, а также помогающие избегать прорезывания нити. С той же целью с хорошим эффектом используется синтетическая нить с насечками (V-Loc), обеспечивающая довольно эффективный гемостаз.
Использование кровоостанавливающего материала (губки, сетки и т.д.) также улучшает качество гемостаза и позволяет выполнять технически более сложные лапароскопические резекции почки. Они способствуют быстрому формированию плотного фибринового сгустка и образованию герметичной прослойки. Однако провести сравнительную оценку различных гемостатических материалов при лапароскопической резекции почки крайне затруднительно, так как в основном интраоперационно используют сочетание разных способов гемостаза [20].
Что касается методики лапароскопической резекции почки, то в настоящее время не суще-ствует рандомизированных исследований на эту тему. Выбор оперативного вмешательства в каждой конкретной клинической ситуации остается за хирургом и, как правило, зависит от особенностей клиники, ее оснащения и принятых подходов к лечению. Однако при всех минимально инвазивных оперативных вмешательствах хирург должен хорошо владеть открытой резекцией почки с соблюдением онкологических принципов, а также стремиться к максимальному сохранению паренхимы почки. Сложные лапароскопические операции, в том числе резекция почки, не должны быть уделом небольших клиник, техническое оснащение которых недостаточно для их выполнения [21].
Хорошим способом освоения лапароскопической резекции почки является мануально ассистированная операция. По описанию ряда авторов срок обучения данному оперативному вмешательству значительно короче, а удовлетворительный эффект достигается уже после четвертой операции. Преимуществом данной операции является также возможность мануального сжатия почечной паренхимы на этапе непосредственной резекции и как следствие – уменьшение ишемии почки [22].
Одной из новых технологий лапароскопии является технология единого доступа. В настоящее время идет активное накопление опыта проведения подобных вмешательств. Основным преимуществом операции является косметический эффект, в то время как потеря инструментами триангуляции делает эту операцию еще более трудной в освоении. Использование специального изогнутого инструментария, а также опыт хирурга позволяют частично компенсировать эти недостатки. Тем не менее, кроме положительного косметического эффекта, остальные показатели данной лапароскопической методики нуждаются в изучении.
С учетом вышеизложенного независимо от выбранной лапароскопической методики резекции почки при возникновении технических трудностей во время операции предпочтительнее проводить конверсию в открытую резекцию почки, а не в лапароскопическую нефрэктомию.
В наших наблюдениях конверсия в лапаротомию потребовалась 3 больным, что составило 7,9%. Отметим, что все эти пациенты были оперированы по поводу опухоли почки. Возможно, это связано с более активным кровоснабжением зоны резекции, в то время как у пациентов со склерозом сосуды не развиты и зачастую имеют очень маленький диаметр. Одновременно с этим при операциях на почках с аномалией развития (подково-, L-образная почка и т.д.) резекция напоминает нефрэктомию. После пересечения сосудов измененной половины почки отчетливо видна демаркационная линия, что значительно облегчает резекцию почки, делая ее практически бескровной. Однако следует помнить, что у данной категории пациентов аномалия развития может проявляться множеством вариантов кровоснабжения, что требует большей, чем обычно, прецизионности на этапе выделения сосудов.
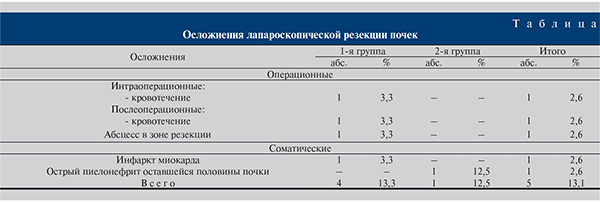
Все осложнения мы разделили на общесоматические и операционные (см. таблицу).
В нашей серии наблюдений зарегистрировано 5 (13,1%) серьезных осложнений. Среди интраоперационных осложнений в 1 наблюдении развилось кровотечение из почечной вены, что потребовало конверсии в лапаротомию и ушивание дефекта.
У 1 больного на 9-е сутки констатировано кровотечение с поверхности резекции, потребовавшее нефрэктомии. Еще у 1 больного в зоне резекции возник абсцесс, диагностированный через 2 нед после операции. Пациент повторно госпитализирован, произведено перкутанное дренирование абсцесса с последующим выздоровлением.
Смерть одного тяжелого соматического пациента в 1-е сутки после операции вероятнее всего стала следствием недооценки тяжести кардиального статуса. У 1 больного диагностирован острый пиелонефрит оставшейся половины резецированной почки. С целью исключения более серьезного осложнения произведена лапароскопия, дренирование брюшной полости. Последующая консервативная антибактериальная терапия обеспечила выздоровление.
Длительность операций составила в среднем 225 (110–330) мин, что согласуется с данными других исследований [11]. В отличие от лапароскопической нефрэктомии время операции по мере накопления опыта оставалось одинаковым. Это может быть обусловлено тем, что оперативные вмешательства осуществлены хирургами с большим опытом выполнения лапароскопических вмешательств и время операции зависело в основном от сложности расположения опухоли и особенностей кровоснабжения почки. По нашему мнению, на длительность операции также влияет инструментальное оснащение клиники и состав операционной бригады.
Время тепловой ишемии не превышало 36 мин, в среднем составив 28 мин. На начальных этапах освоения метода в нескольких наблюдениях из-за нехватки времени мы восстанавливали почечный кровоток на 7–10 мин в условиях локального тугого тампонирования поверхности резекции, после чего завершали гемостаз в условиях более кратковременной ишемии. Средний объем кровопотери составил 230 (50–1400) мл. Как правило, кровопотеря (даже выраженная) была контролируемой и не являлась поводом для конверсии. Конверсия в лапаротомию из-за кровопотери осуществлена только однажды – при повреждении почечной вены. На ранних этапах освоения метода нами было проведено 2 конверсии в лапаротомию из-за трудностей выделения почки, обусловленных спаечным процессом после предшествующих операций в одном случае на той же почке по поводу мочекаменной болезни, в другом – на органах брюшной полости.
Наркотические анальгетики в послеоперационном периоде не применялись. Через сутки больные начинали самостоятельно ходить по отделению, посещать процедурный кабинет и т.д. Средний послеоперационный период составил 8,7 дня.
Для иллюстрации возрастающих возможностей лапароскопической операции приводим наше клиническое наблюдение.
Больная В. 36 лет поступила в стационар в декабре 2008 г. с диагнозом «опухоль правой почки». По данным обследования (УЗИ, МРТ, сцинтиграфия почек), слева анатомо-функциональное состояние почек и верхних мочевыводящих путей удовлетворительное, справа в нижнем сегменте почки определяется солидное образование округлой формы, не распространяющееся за почечную капсулу, размером 5,6х6,7 см. В декабре 2008 г. произведена лапароскопическая резекция правой почки. По результатам срочного и планового гистологических исследований констатирована онкоцитома почки; в крае резекции опухолевого роста не выявлено. Время операции составило 250 мин, время тепловой ишемии – 36 мин, кровопотеря – 650 мл (350 мл во время операции и 300 мл по дренажу в течение первых двух суток после операции), в связи с чем перелито 330 мл эритроцитарной массы и 960 мл свежезамороженной плазмы. Послеоперационный период протекал без особенностей. Выписана в удовлетворительном состоянии через 7 дней.
В дальнейшем жалоб не предъявляла. При контрольном обследовании (УЗИ, СКТ) в августе 2009 г. диагностирована опухоль нижнего сегмента правой почки размером 3,4х2,6х2,2 см с бугристыми контурами неоднородной структуры, интенсивно неравномерно накапливавшая контрастный препарат. В октябре 2009 г. при обследовании в динамике (УЗИ, СКТ) картина прежняя. Для определения характера образования – рубец или опухоль – и дальнейшей тактики произведена пункционная биопсия опухоли. По данным иммуногистохимического исследования – онкоцитома почки. В ноябре 2009 г. выполнена повторная лапароскопическая резекция правой почки. При гистологическом исследовании – онкоцитома почки; в крае резекции опухолевого роста не выявлено. Время операции составило 275 мин; время тепловой ишемии – 20 мин; кровопотеря – 50 мл. Послеоперационный период без особенностей. Выписана через 4 дня.
В ходе дальнейшего динамического наблюдения по данным УЗИ, СКТ в 2010-м, 2011-м и в мае 2012 г. опухолевого роста не выявлено. Результаты исследований свидетельствовали о наличии адекватного почечного кровотока и достаточной функциональной способности оставшейся части резецированной почки.
Заключение. Результаты, полученные в нашем исследовании, а также данные литературы свидетельствуют, что лапароскопическая резекция почки является альтернативой открытой операции и позволяет соблюдать необходимые онкологические принципы при ее выполнении. Несмотря на технические трудности, возникающие при освоении и выполнении лапароскопической резекции почки, преимущества минимально инвазивных методик очевидны и постоянно стимулируют использовать и совершенствовать данную методику. Наш опыт выполнения лапароскопической резекции почки позволяет также считать, что при решении вопроса о способе оперативного лечения при заболеваниях почки, в том числе онкологических, предпочтение необходимо по возможности отдавать минимально инвазивным методикам и не считать потенциальную потребность этих операций в конверсии аргументом, дискредитирующим данный метод лечения.



