Введение. Современная комбинированная терапия α-адреноблокаторами и блокаторами 5α-редуктазы приводит к замедлению прогрессирования аденомы предстательной железы (АПЖ) [1]. Наряду с наблюдаемым увеличением продолжительности жизни больные, требующие выполнения оперативного лечения по поводу АПЖ, становятся старше в среднем на 10 лет, а объем оперируемой простаты увеличивается [2]. Пациенты пожилого и старческого возраста, имеющие показания к оперативному лечению АПЖ, нередко отягощены множеством сопутствующих заболеваний, в том числе сердечно-сосудистой системы, требующих непрерывного приема антикоагулянтов. Трансуретральная резекция (ТУР) простаты, впервые выполненная в 1932 г., до настоящего времени остается «золотым» стандартом лечения инфравезикальной обструкции, обусловленной АПЖ, объемом от 30 до 80 см3, обеспечивая продолжительные благоприятные результаты; есть длительные наблюдения от 8 до 22 лет [3]. Частота кровотечений при ТУР простаты, требующих гемотрансфузии, составляет 1,3–11% [4]. В последнее время происходит снижение доли ТУР простаты среди оперативных вмешательств при АПЖ за счет роста минимально инвазивных процедур. В США в 1999 г. доля ТУР простаты составила 81% всех операций по поводу АПЖ, в 2005-м она сократилась до 39% [5].
Методом выбора оперативного лечения АПЖ в ряде клинических ситуаций может стать лазерная вапоризация простаты, которая столь же эффективна, что и ТУР простаты, но лишена присущих этой операции осложнений – даже у пациентов с нарушенным гемостазом [6].
Целью исследования явилась оценка эффективности и безопасности применения диодного лазера Dornier UroBeam в лечении АПЖ.
Материалы и методы. С января 2011 по декабрь 2012 г. в клинике медицинского центра «Авиценна» с использованием диодного лазера UroBeam производства «Dornier MedTech» прооперированы 72 пациента в возрасте от 45 до 86 лет (средний возраст – 67,05± 8,22 года). Операции выполняли по абсолютным (хроническая или рецидивирующая острая задержка мочеиспускания, камни мочевого пузыря, развитие хронической почечной недостаточности [ХПН], рецидивирующая гематурия, наличие эпицистостомы) и относительным показаниям (выраженные расстройства мочеиспускания в отсутствие эффекта от консервативной терапии). Всех больных перед операцией обследовали амбулаторно. Проводили оценку жалоб пациентов с использованием шкалы IPSS, опросника оценки качества жизни (QoL), изучали анамнез пациентов, оценивали сопутствующие заболевания, проводили общий осмотр, пальцевое ректальное исследование (ПРИ), выполняли общий анализ крови и мочи, определяли уровень креатинина, мочевины в крови и уровень простатспецифического антигена (ПСА). Выполняли ультразвуковое исследование (УЗИ) почек, мочевого пузыря, простаты, определяли объем остаточной мочи. Объем простаты оценивали при трансректальном УЗИ простаты. При повышении уровня ПСА свыше 4 нг/мл или при наличии подозрительных очагов при ПРИ выполняли биопсию простаты для исключения рака предстательной железы. Другие дополнительные исследования выполняли по показаниям. Больных перед операцией осматривали терапевт, анестезиолог. Госпитализацию осуществляли в день операции. Лазерную вапоризацию АПЖ выполняли два хирурга-уролога с опытом работы свыше 10 лет. Операцию осуществляли преимущественно под перидуральной анестезией в литотомическом положении больного, как при стандартной ТУР простаты, при постоянной ирригации физиологическим раствором. Профилактику инфекционных осложнений осуществляли внутривенным введением амоксиклава (1,2 г) за 30 мин до операции с последующим приемом того же антибиотика по 1 г в сут внутрь до удаления уретрального катетера. В качестве альтернативы и при наличии указаний в анамнезе на аллергические реакции на препараты пенициллинового ряда назначали фторхинолоны.
Резектоскоп вводили в мочевой пузырь при помощи оптического обтуратора, проводили уретроцистоскопию, после чего заменяли оптический обтуратор на специальную лазерную вставку. При наличии камней в мочевом пузыре операцию начинали с цистолитотрипсии при помощи гольмиевого лазера Dornier Medilas H-20 с последующим выполнением вмешательства на простате диодным лазером. На первом этапе операции выставляли мощность лазера 175 Вт, циркулярными вращательными движениями выпаривали ткань простаты, начиная с шейки мочевого пузыря. В результате создавали «воронку», основанием обращенную в мочевой пузырь, для свободного отхода пузырьков газа, образующихся при вапоризации ткани простаты. Вторым этапом продолжали выпаривание ткани простаты лазерным излучением более высокой мощности (200–225 Вт) вглубь с продвижением к паракалликулярной зоне. На завершающем этапе выпаривали ткань апикальной зоны простаты при максимальной мощности лазера 250 Вт. При комбинированном вмешательстве лазерную вапоризацию дополняли монополярной ТУР аденоматозных тканей до капсулы простаты. Операция заканчивалась установкой 3-ходового катетера Фолея No 20 Ch. Всем больным после операции осуществляли орошение мочевого пузыря на протяжении первых суток после операции стерильным физиологическим раствором. Больным разрешалось принимать пищу через 2 часа после операции. Активизация больных осуществлялась после восстановления двигательной активности в нижних конечностях.
На следующий день после операции выполняли контрольный общий анализ крови, уделяя особое внимание уровню эритроцитов и гемоглобина.
Выписка из стационара осуществлялась на 2–3-е сутки после операции с уретральным катетером. Катетер удаляли преимущественно на 5-е сутки после операции в амбулаторных условиях. Плановое наблюдение после выписки осуществляли в поликлинике через 2 нед после удаления уретрального катетера, затем через 1, 3, 6 и 12 мес после операции. Во время визитов оценивали жалобы больного, общее самочувствие, проводили ПРИ. Через 3 мес выполняли УЗИ почек, мочевого пузыря, простаты, оценку жалоб по шкале IPSS, опроснику QоL, урофлоуметрию.
Результаты. Оперированы 72 пациента в возрасте от 45 до 86 лет (средний возраст – 67,05±8,22 года). «Чистая» лазерная вапоризация простаты выполнена 19 (26,4%) пациентам, 53 (73,6%) больным лазерную вапоризацию дополняли монополярной ТУР простаты. Объем предстательной железы колебался от 32 до 149 см3, в среднем составив 67,3±26,7 см3. На момент обращения 13 (18%) пациентам установлена эпицистостома, у 10 (13,9%) больных обнаружены камни мочевого пузыря. У 35 (48,6%) оперированных была остаточная моча от 50 до 506 мл, составив в среднем 181,6±78,62 мл. Таким образом, по абсолютным показаниям были оперированы 80,5% больных. Остальные больные были оперированы ввиду выраженных расстройств мочеиспускания, не поддающихся консервативной терапии α-адреноблокаторами в сочетании с блокаторами 5α-редуктазы.
Уровень ПСА в сыворотке крови в среднем составил 4,8±2,3 (от 0,46 до 32) нг/мл. 21 (29,1%) пациенту с уровнем ПСА свыше 4 нг/мл выполняли биопсию предстательной железы: патоморфологических признаков злокачественной опухоли не было выявлено ни в одном наблюдении. Средняя продолжительность лазерной вапоризации составила 69,2±23,7 (от 30 до 125) мин. Увеличение времени операции было у 10 больных, у которых наряду с АПЖ были обнаружены камни мочевого пузыря; им одномоментно была выполнена контактная литотрипсия гольмиевым лазером, что, естественно, увеличило длительность оперативного вмешательства в среднем на 43,7±17,6 мин. Кровопотеря была минимальной, после операции снижения уровня гемоглобина крови более 10 г/л не отмечено, ни в одном наблюдении пациентам не потребовалась гемотрансфузия, однако 18 (25%) пациентам в связи с геморрагическим окрашиванием промывных вод мы сочли необходимым оставить постоянное орошение мочевого пузыря на сутки. Длительность постоянного дренирования мочевого пузыря уретральным катетером колебалась от 2 до 7 дней, составив в среднем 4,6 дня. Тринадцати пациентам, поступившим с эпицистостомой, ее удалили по окончании операции, за исключением 3 (23%) больных с ХПН 2-й стадии. Этим пациентам эпицистостомический дженаж перекрывали после удаления уретрального катетера на 6-е сутки и удаляли после восстановления самостоятельного мочеиспускания, а также в отсутствие остаточной мочи, гипертермии и нарастания уровня креатинина крови. Для заживления эпицистостомы катетер не устанавливали, мочепузырный свищ закрывался самостоятельно в первые сутки после удаления цистостомического дренажа.
Стабильным оставалось состояние сердечнососудистой системы у всех пациентов – ни в одном наблюдении не развилось ухудшения состояния по интеркуррентному заболеванию.
 Мы наблюдали ряд осложнений. Наиболее серьезным из них в раннем послеоперационном периоде была перфорация мочевого пузыря у 1 (1,38 %) больного, потребовавшая выполнения лапаротомии, ревизии, санации и дренирования брюшной полости, эпицистостомии. Внебрюшинная перфорация стенки мочевого пузыря, возникшая во время выполнения цистолитотрипсии гольмиевым лазером, осталась незамеченной интраоперационно и в послеоперационном периоде проявилась возникновением болей в животе, перитонеальной симптоматикой, а при УЗИ выявлена жидкость в брюшной полости. При ревизии была обнаружена внебрюшинная перфорация мочевого пузыря, а жидкость пропотела в брюшную полость. Больной был выписан на 7-е сутки после операции. У 2 (2,8%) больных, оперированных с эпицистостомой, была гипертермия до 39 градусов после удаления уретрального катетера, которая купировалась повторной установкой уретрального катетера и проведением антибактериальной терапии тиенамом 1,5 г в сут внутривенно до нормализации температуры и еще в течение 3 дней после ее нормализации. После удаления уретрального катетера гипертермия не рецидивировала.
Мы наблюдали ряд осложнений. Наиболее серьезным из них в раннем послеоперационном периоде была перфорация мочевого пузыря у 1 (1,38 %) больного, потребовавшая выполнения лапаротомии, ревизии, санации и дренирования брюшной полости, эпицистостомии. Внебрюшинная перфорация стенки мочевого пузыря, возникшая во время выполнения цистолитотрипсии гольмиевым лазером, осталась незамеченной интраоперационно и в послеоперационном периоде проявилась возникновением болей в животе, перитонеальной симптоматикой, а при УЗИ выявлена жидкость в брюшной полости. При ревизии была обнаружена внебрюшинная перфорация мочевого пузыря, а жидкость пропотела в брюшную полость. Больной был выписан на 7-е сутки после операции. У 2 (2,8%) больных, оперированных с эпицистостомой, была гипертермия до 39 градусов после удаления уретрального катетера, которая купировалась повторной установкой уретрального катетера и проведением антибактериальной терапии тиенамом 1,5 г в сут внутривенно до нормализации температуры и еще в течение 3 дней после ее нормализации. После удаления уретрального катетера гипертермия не рецидивировала.
После удаления уретрального катетера самостоятельное мочеиспускание сразу не восстановилось у 5 (26,3%) из 19 больных после «чистой» лазерной вапоризации простаты. Этим больным мы повторно устанавливали уретральный катетер сроком от 5 до 7 дней, после удаления катетера самостоятельное мочеиспускание восстановилось. Задержку мочеиспускания мы связываем с отеком ткани простаты после высокоэнергетического воздействия. У всех больных при комбинированном вмешательстве восстановление мочеиспускания произошло сразу после удаления катетера.
У 9 пациентов в период от 2 нед до 6 мес после операции развилась острая задержка мочеиспускания, связанная с отхождением участков некротизированной ткани простаты, в связи с чем им был установлен на двое суток уретральный катетер, после удаления которого восстановилось нормальное мочеиспускание. Недержание мочи было у 7(9,7%) больных, которое постепенно исчезло в срок от нескольких недель до 3 мес. У одного больного после комбинированной лазерной вапоризации простаты недержание мочи было стойким и не купировалось через 4 мес, ему была выполнена фиброуретроцистоскопия, при которой обнаружили остаточную ткань в ложе простаты; после ее удаления при помощи ТУР недержание мочи больше не отмечалось. У 2 (2,8%) больных после комбинированной лазерной вапоризации простаты через 6 мес развился склероз шейки мочевого пузыря – им было выполнено рассечение шейки при помощи гольмиевого лазера.
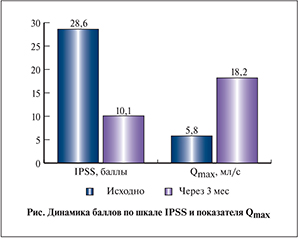
У 59 больных отслежены результаты операции через 3 мес. Произошло снижение симптомов по шкале IPSS c 28,6±5,2 до 10,1±3,7 балла, увеличение масимальной скорости мочеиспускания (Qmax) – с 5,8±2,8 до 18,2±3,6 мл/с, результаты представлены на рисунке.
Как видно на рисунке, лазерная вапоризация АПЖ при помощи диодного лазера Dornier Medilas D UroBeam с длиной волны 940 нм приводит к трехкратному снижению выраженности расстройств мочеиспускания и таковому же увеличению Qmax.
Обсуждение. Применение консервативной терапии позволяет избавлять от оперативного вмешательства многих пациентов с АПЖ. Однако ни α-адреноблокторы, ни ингибиторы 5α-редуктазы не являются панацеей, избавляющей всех больных от заболевания. У значительной части пациентов все же возникают показания к оперативному лечению, но в более позднем возрасте, когда уже имеются различные сопутствующие заболевания, отягчающие состояние больного и в ряде случаев препятствующие выполнению операции. Средний возраст оперированных нами больных был 67,05±8,22 года, максимальный – 86 лет. Существующая стандартная методика ТУР простаты позволяет эффективно и безопасно оперировать пациентов с объемом простаты до 80 см3. Ограничением в применении ТУР простаты в лечении АПЖ большего размера служат удлинение времени операции, риск интраоперационного кровотечения и развития ТУР-синдрома. При мета-анализе эффективности стандартной ТУР и фотоселективной лазерной вапоризации АПЖ шести контролируемых рандомизированных исследований и пяти исследований случай–контроль с общим числом пациентов 1398 с идентичным исходным баллом по шкале IPSS, QoL, уровнем Qmax обнаружено, что, хотя лазерное вмешательство длилось дольше, чем ТУР, общая продолжительность госпитализации и дренирования мочевого пузыря в этой группе больных была короче, равно как и число осложнений, типичных для ТУР (ТУР-синдром, перфорация капсулы простаты, кровотечение после отторжения струпа и удаления катетера) [7].
Лазерная вапоризация АПЖ – разумная альтернатива существующим методикам лечения этого заболевания и хорошо зарекомендовала себя среди больных пожилого возраста с интеркуррентными заболеваниями, постоянно принимающих антикоагулянты, т.е. среди пациентов высокого анестезиологического и операционного риска. Поскольку медикаментозно таким пациентам восстановить мочеиспускание невозможно, до создания лазерных аппаратов у них был единственный выход – установка эпицистостомы, что снижает качество жизни и чревато угрозой развития инфекционно-воспалительных и других осложнений. Это подтверждено рядом исследований. В работе C. H. Chen [8] проанализирован собственный опыт применения GreenLight лазера 132 больными АПЖ. Пациенты были распределены на несколько групп в зависимости от возраста, размеров простаты и выраженности симптомов заболевания. Во всех группах получены хорошие результаты, что позволило сделать вывод о высокой эффективности и безопасности выполнения лазерной вапоризации простаты даже для пациентов высокого риска.
Высказывается мнение, будто применение лазерных технологий (энуклеация аденомы при помощи гольмиевого лазера, фотоселективная вапоризация) однозначно предпочтительнее ТУР для определенных категорий пациентов, в первую очередь получающих антикоагулянты [9]. 188 больных АПЖ с сопутствующими заболеваниями сердечно-сосудистой системы и болезнями легких, непрерывно в течение длительного времени получавших антикоагулянты, были подвергнуты лазерной вапоризации (KTP-лазер мощностью 120 Вт). Средний размер простаты составил 66±23,1 см3, продолжительность операции – 50,8±15,5 мин. Несмотря на высокий риск кровотечения, ни в одном наблюдении не возникло необходимости в гемотрансфузии. В послеоперационном периоде только 14 (7,4 %) пациентов нуждались в постоянном орошении мочевого пузыря; срок катетеризации не превышал 5 дней (в среднем 1,9±1,5 дня). Опасаясь осложнений, трем больным с большими размерами АПЖ на первом этапе была выполнена вапоризация части железы, а в последующем – повторная операция с целью удаления резидуальной части аденомы. При контрольном обследовании через 3, 6, 12 мес и 2 года средняя скорость потока мочи увеличилась с 8±3,6 до 19,1±5,6, 19,2±4,7, 19,1±4,6 и 19,2±4,3 мл/с соответственно. Количество баллов по шкале IPSS через 2 года снизилось с дооперационных 25,6±5,1 до 6,2±1,3. Сделан вывод, что вапоризация АПЖ при помощи KTP-лазера является высокоэффективным и безопасным методом лечения пациентов высокого операционного риска [10]. F. Schroeck и соавт. [11] проанализировали базу данных больных АПЖ, оперированных с 2001 по 2009 г. За это время количество лазерных операций увеличилось с 25 до 114 на 10 тыс. мужчин, составив к 2009 г. половину всех трансуретральных вмешательств. В работе [12] фотоселективная вапоризация АПЖ у мужчин пожилого и старческого возраста продолжалась от 40 до 60 мин.
В послеоперационном периоде устанавливали постоянный катетер на 1–2 дня. Интраоперационно у одного пациента развилось кровотечение, остановленное путем электрокоагуляции; гемотрансфузия не понадобилась. У другого пациента после удаления катетера возникла острая задержка мочеиспускания, потребовавшая интермиттирующей катетеризации в течение двух дней. У 5 пациентов в раннем послеоперационном периоде развился острый простатит, купированный антибактериальной терапией. Срок госпитализации не превысил 5 дней.
В настоящее время имеются данные по отдаленным трехлетним результатам; после фотоселективной вапоризации при помощи 120W GreenLight у 68 пациентов было констатировано сохранение достигнутых после операции параметров мочеиспускания [13].
Сравнивались различные существующие лазеры, применяемые в лечении АПЖ. При сопоставлении эффективности и безопасности фотоселективной вапоризации АПЖ при помощи GreenLight (длина волны – 532 нм) у 197 больных и KTP-лазера с той же длиной волны у 91 пациента не было обнаружено достоверных различий в результатах. У пациентов, оперированных при помощи KTP-лазера, средний размер простаты составил 45,6±22 см3; число баллов по шкале IPSS снизилось на 59,1%, а средняя скорость потока мочи (Qave)) возросла на 140,7%. В группе оперированных при помощи GreenLight (исходные размеры простаты – 39,6±15,2 мл) те же показатели улучшились на 61,8 и 118,4% соответственно. Частота осложнений также не различалась: в отдаленном послеоперационном периоде у 3,4% больных после КТР-лазера и у 2,1% после GreenLight развился склероз шейки мочевого пузыря [14]. Однако увеличение мощности лазера ожидаемо приводит к увеличению скорости выполнения вмешательства; так Y. Zang и соавт. [15] сравнили результаты применения GreenLight лазера мощностью 80 и 120 Вт (соответственно 220 и 70 пациентов, сопоставимых по исходному состоянию). Обнаружено, что лазер большей мощности позволил достоверно сократить время операции и, соответственно, время наркоза, что особенно важно для пациентов высокого операционного риска; при этом эффективность осталась прежней и частота осложнений не увеличилась.
В настоящее время появился высокоэнергетический диодный лазер мощностью 250 Вт с длиной волны 940 нм. П.В. Глыбочко и соавт. [16], анализируя результаты лазерной вапоризации с помощью аппарата Dornier Medilas D UroBeam на основе диодного лазера с длиной волны 940 нм, пришли к выводу, что этот метод лечения обеспечивает минимальный риск развития жизненно опасных осложнений, прежде всего выраженного кровотечения в интраи послеоперационном периодах. Тем не менее непосредственно после вмешательства у 31,5% больных отмечена выраженная дизурия, обусловленная наличием некротического струпа, который после лазерной вапоризации отходит длительное время. Кроме того, у 7,4% больных имело место развитие воспалительных осложнений, у 5,6% – транзиторное недержаниемочи.
Первый наш опыт показал, что при вапоризации сложно определить границы воздействия, в послеоперационном периоде длительно отходят кусочки некротических тканей, что создает предпосылки к развитию осложнений (острая задержка мочеиспускания, инфицирование), поэтому в дальнейшем лазерную вапоризацию завершали стандартной ТУР – меняли рабочий элемент на электрическую петлю и производили ТУР некротических масс по классической методике. Такой подход позволил избежать осложнений, процесс заживления проходил быстрее и с большим комфортом для пациента; кровопотеря при ТУР как завершающем этапе лазерной вапоризации сопровождалась значительно меньшим кровотечением, чем при ТУР как самостоятельной операции. Больных с субкомпенсацией сердечно-сосудистой деятельности и принимавших антикоагулянты все же ограничивались только лазерной вапоризацией. У больных, принимавших антикоагулянты, также использовали комбинированную методику; только лазерную вапоризацию применяли к пациентам с кардиостимулятором, ограничивающим использование электрического тока.
Обострение хронического простатита после этой операции, что наблюдали и другие авторы [12,16], является показанием к санации простаты, назначению антибактериальной терапии непосредственно перед операцией и в раннем послеоперационном периоде. Лазерная вапоризация возможна и при большом объеме предстательной железы. Мы прооперировали 1 пациента с объемом простаты 149 см3, а В. В. Когут и соавт. [17] выполнили данное пособие 6 пациентам с размерами простаты свыше 120 см3. В такой ситуации особенно важно удаление большого массива коагулированной аденоматозной ткани при помощи резектоскопа.
Заключение. Лазерная вапоризация при помощи диодного лазера – один из самых перспективных методов лечения АПЖ, особенно для пациентов пожилого и старческого возраста, при наличии сопутствующих заболеваний, а также для неотягощенных пациентов с объемом простаты свыше 60 см3. Накопленный совокупный опыт позволяет рекомендовать электрорезекцию струпа в качестве завершающего этапа операции.



