Введение. Согласно международной статистике, аденома предстательной железы (АПЖ) диагностируется в среднем у 80% мужчин в возрасте 60 лет и старше [1]. По данным ООН к концу ХХ в. население в возрасте 60 лет увеличилось по сравнению с серединой века более чем в 3 раза. Согласно прогнозам, в связи со старением населения проблемам лечения АПЖ во всем мире будет уделяться все больше внимания [1, 2].
Острая задержка мочеиспускания (ОЗМ) представляет собой одно из самых распространенных и серьезных осложнений АПЖ у пожилых мужчин [3]. Результаты эпидемиологических исследований показали, что риск развития ОЗМ возрастает по мере увеличения объема предстательной железы [4].
Оптимальная стратегия терапии ОЗМ при АПЖ включает комплекс консервативных мер, направленных на восстановление мочеиспускания: катетеризация мочевого пузыря, применение α-адреноблокаторов (предпочтительно селективных, поскольку они не требуют подбора дозы и наиболее безопасны) с одновременным обследованием пациента [5, 6]. В настоящее время в арсенале урологов есть широкий диапазон лекарственных препаратов группы α-адреноблокаторов. Недавно в России зарегистрирован новый препарат этой группы – силодозин, который имеет ряд характеристик, выгодно отличающих его от других препаратов этого класса. Сродство силодозина к подтипу α1A-адренорецепторов намного выше (в 162 раза), чем к α1B-адренорецепторам [7–11]. Именно поэтому гипотензивный потенциал силодозина сведен к минимуму. Значительное терапевтическое преимущество силодозина состоит в том, что нет необходимости в подборе дозы. Силодозин можно (с осторожностью) применять одновременно с препаратами, снижающими артериальное давление. В американских и европейском исследованиях III фазы по силодозину 32% пациентов одновременно принимали силодозин и антигипертензивные препараты (блокаторы ренин-ангиотензиновой системы, β-адреноблокаторы, блокаторы кальциевых каналов и диуретики). Не было выявлено статистически значимой разницы в частоте возникновения ортостатической гипотензии между группами, получавшими силодозин, одновременно силодозин и антигипертензивные препараты и плацебо (1,4%, 1,2% и 1% соответственно) [13].

Уменьшение выраженности расстройств мочеиспускания происходит уже в первые дни приема силодозина [12], что имеет особое значение для лечения ОЗМ, связанной с АПЖ.
Целью данного исследования было изучение эффективности и безопасности силодозина в дозе 8 мг в сутки для лечения пациентов с ОЗМ на фоне АПЖ.
Для достижения цели исследования нами поставлены следующие задачи:
- оценка влияния силодозина 8 мг в сутки на восстановление естественного опорожнения мочевого пузыря у пациентов с ОЗМ, связанной с АПЖ; • оценка динамики симптомов АПЖ по Международной шкале оценки симптомов заболеваний простаты (IPSS) на фоне лечения силодозином 8 мг в сутки;
- определение выраженности инфравезикальной обструкции, обусловленной АПЖ, на основании данных трансректальной эхографии, урофлоуметрии, определения объема предстательной железы и остаточного объема мочи на фоне лечения силодозином 8 мг в сутки;
- оценка переносимости силодозина на основании анализа зарегистрированных нежелательных эффектов и изменений лабораторных параметров в клиническом и биохимическиом анализах крови и клиническом анализе мочи.
Материалы и методы. Исследование состояло из двух фаз. В первую фазу были включены 120 пациентов старше 50 лет (60 пациентов получали силодозин 8 мг в сутки, 60 пациентов – доксазозин 4 мг в сутки) с диагностированной АПЖ, у которых впервые развилась ОЗМ, объем мочи при катетеризации мочевого пузыря составил от 500 до 1500 мл. Вторую фазу исследования продолжили пациенты, у которых восстановилось естественное опорожнение мочевого пузыря после его катетеризации и применения α-адреноблокатора (доксазозина или силодозина) и которые соответствовали следующим критериям: количество баллов по шкале IPSS≥12, умеренно выраженная инфравезикальная обструкция (5<Qmax ≤ 15 мл/с) и уровень ПСА≤4 нг/мл. Во второй фазе исследования пациенты, у которых после ОЗМ восстановилось самостоятельное мочеиспускание, получали силодозин или доксазозин.
Критерии исключения из первой фазы исследования:
- пациенты, нуждавшиеся в оперативном вмешательстве или получавшие какое-либо другое лечение по поводу АПЖ;
- пациенты с недиагностированными ранее заболеваниями почек, мочевого пузыря, предстательной железы (кроме АПЖ и простатита), уретры и другими заболеваниями, способными вызывать нарушения мочеиспускания;
- пациенты с тяжелыми декомпенсированными заболеваниями печени и/или почек и/или других жизненно важных органов;
- пациенты, которые были не в состоянии адекватно отвечать на вопросы исследователя, заполнять необходимые документы и применять препараты.
Пациенты были рандомизированы методом типологического отбора на две равные группы, аналогичные по возрасту, клиническим проявлениям, результатам лабораторных и инструментальных исследований. Типологический отбор – это способ формирования групп, сопоставимых по возрасту, тяжести клинических проявлений, сопутствующим заболеваниям, продолжительности ОЗМ и остаточному объему мочи. Пациенты основной группы получали силодозин 8 мг по 1 капсуле 1 раз в день, пациенты группы сравнения – доксазозин 4 мг по 1 таблетке 1 раз в день.
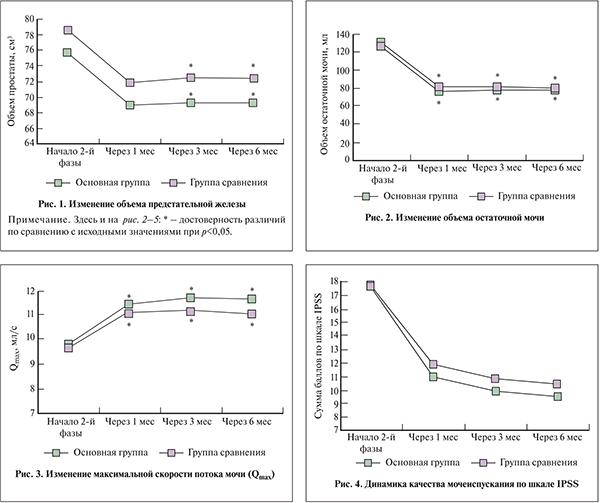
Пациенты, успешно завершившие первую фазу, т.е. те, у которых восстановилось естественное опорожнение мочевого пузыря, были включены во вторую фазу наблюдения. Для всех пациентов учитывалось количество баллов по шкале IPSS в отношении расстройств мочеиспускания и качества жизни; кроме того, были проведены дополнительные обследования: пальцевое ректальное предстательной железы, трансректальная эхография предстательной железы с определением остаточного объема мочи и урофлоуметрия. Также был проведен анализ мочи и определен уровень простатспецифического антигена (ПСА) в сыворотке крови. Эти обследования проводились при включении во вторую фазу наблюдения, через 1, 3 и 6 мес после начала лечения.
Во второй фазе исследования конечными точками эффективности были следующие:
- терапевтический эффект;
- тяжесть симптомов АПЖ по шкале IPSS.
Для оценки терапевтического эффекта использовали данные, полученные при пальцевом ректальном исследовании предстательной железы, трансректальной эхографии предстательной железы с определением объема остаточной мочи, урофлоуметрии. Продолжительность последующего наблюдения и лечения в обеих группах составила 6 мес.
Результаты и обсуждение. Основные характеристики пациентов, вошедших в первую фазу исследования, представлены в табл. 1.
Всем пациентам для купирования ОЗМ была выполнена катетеризация мочевого пузыря, затем назначены α-адреноблокаторы. Основные данные, свидетельствующие о восстановлении мочеиспускания у пациентов, были получены в течение 8–10 ч после приема α-адреноблокаторов (в процессе накопления мочи в мочевом пузыре). В дальнейшем характер мочеиспускания отслеживался в течение 5 дней. В эти сроки естественное опорожнение мочевого пузыря восстановилось у 47 (78,3%) пациентов основной групп и у 38 (63,3%) – группы сравнения. Этот факт имеет важное значение и объясняется быстрым действием силодозина в первые несколько часов после его приема [6].
Пациентам, у которых самостоятельное мочеиспускание не восстановилось, была произведена троакарная, или открытая, цистостомия с последующей подготовкой к операции – трансуретральной резекции предстательной железы или аденомэктомии.
Во вторую фазу исследования вошли 78 пациентов, из них 43 из основной группы, 35 из группы сравнения. В дальнейшем 7 пациентов выбыли из исследования (4 – из основной и 3 – из группы сравнения). На данном этапе терапевтический эффект используемых лекарственных препаратов оценивали на основании результатов трансректальной эхографии предстательной железы, которые использовали в качестве конечных точек эффективности.
При втором посещении у пациентов обеих групп отмечено умеренное уменьшение объема предстательной железы за счет уменьшения отека (рис. 1). Кроме того, констатировано значительное уменьшение объема остаточной мочи, который при последующих контрольных посещениях не изменялся (рис. 2). По-видимому, этот факт объясняется уменьшением инфравезикальной обструкции на фоне приема α-адреноблокаторов.
Методом урофлоуметрии проведена оценка основных параметров мочеиспускания и при этом было выявлено увеличение среднего значения максимальной скорости потока мочи в обеих группах (рис. 3).
Общее количество баллов по шкале IPSS использовалось для оценки тяжести симптомов инфравезикальной обструкции, обусловленной АПЖ, при этом уменьшение абсолютного значения этого показателя свидетельствует об эффективности лечения. Результаты проведенного наблюдения представлены на рис. 4.
Анализ результатов второй фазы исследования показал, что средняя сумма баллов по шкале IPSS снизилась в обеих группах уже при втором посещении и в процессе лечения сохранялась на достигнутом уровне. Это подтверждает известный факт: влияние всех α-адреноблокаторов на мочеиспускание примерно сопоставимо [6].
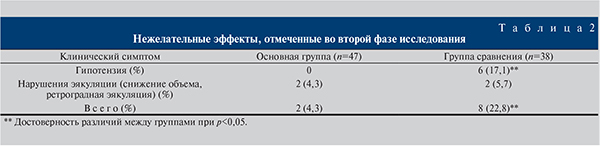
 Неблагоприятные изменения общего состояния пациентов, появление новых жалоб, отклонения лабораторных параметров (клинический и биохимический анализы крови и клинический анализ мочи) рассматривались как нежелательные эффекты лечения.
Неблагоприятные изменения общего состояния пациентов, появление новых жалоб, отклонения лабораторных параметров (клинический и биохимический анализы крови и клинический анализ мочи) рассматривались как нежелательные эффекты лечения.
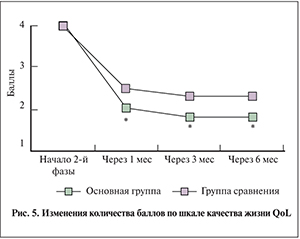
Как следует из табл. 2, частота нежелательных эффектов на фоне приема доксазозина была выше, чем у больных, принимавших силодозин; нежелательные эффекты чаще всего проявлялись в виде снижения артериального давления, что существенно влияет на качество жизни пациентов. В основной группе этого нежелательного эффекта не наблюдалось (рис. 5).
Выполненное наблюдение показало, что в связи с быстрым началом действия силодозина его применение позволяет эффективно восстанавливать естественное опорожнение мочевого пузыря пациентов с ОЗМ на фоне АПЖ. Поскольку по этому вопросу не выявлено каких-либо опубликованных данных, следовательно, и решение провести данное исследование связано с тем, чтобы показать эффект силодозина в отношении тонуса гладкой мускулатуры нижних отделов мочевыводящих путей и что он развивается достаточно быстро.
Выводы
- α1А-адреноблокатор силодозин является безопасным препаратом, который помогает восстанавливать естественное опорожнение мочевого пузыря у 78,3% пациентов с ОЗМ, возникшей на фоне АПЖ;
- прием силодозина после успешного купирования ОЗМ у пациентов с АПЖ служит профилактикой ОЗМ в будущем; это лечение облегчает и устраняет расстройства мочеиспускания.
- силодозин характеризуется быстрым началом действия и высокой эффективностью, что способствует использованию его при возникновении ОЗМ. Результаты данного исследования позволяют нам рекомендовать силодозин как для восстановления мочеиспускания у пациентов с ОЗМ, возникшего на фоне АПЖ, так и для рутинного лечения пациентов с АПЖ. В ходе исследования снижения артериального давления на фоне приема силодозина в дозе 8 мг в сутки не отмечено, что говорит о безопасности его применения пациентами с ОЗМ, обусловленной АПЖ.



