Введение. Под бессимптомной бактериурией (ББ) понимают выделение одного и того же вида микроорганизма в титре ≥105 КОЕ/мл в двух последовательных образцах мочи у лиц, не имеющих симптомов инфекции мочевыводящих путей (ИМП) [1]. Бессимптомная бактериурия широко распространена в популяции, ее частота зависит от возраста, пола, наличия аномалий органов мочевого тракта и ряда других факторов [2]. Так, у здоровых женщин частота ББ значительно варьируется в зависимости от возраста: от 1% в 5–14 лет до 20% у женщин старше 80 лет [2]. На сегодняшний день доказано, что ББ в большинстве случаев не требует лечения; исключение составляют беременные и пациенты, которым планируется проведение оперативного вмешательства на органах мочевой системы [1].
Показатель распространенности ББ среди беременных колеблется в широких пределах – от 2,5 до 26,0% [3–5]. Необходимо отметить, что, несмотря на отсутствие какой-либо клинической симптоматики, ББ является одним из основных факторов риска возникновения ИМП у беременных [4]. Было показано, что на ранних сроках беременности ББ в 20–30 раз повышает риск развития пиелонефрита [1, 6]. Наряду с этим ББ сопровождается рядом серьезных акушерских осложнений, таких как преждевременные роды, рождение детей с низкой массой тела и инфекционные осложнения у родильницы [7]. Проведение адекватной противомикробной терапии позволяет уменьшить риск развития пиелонефрита у беременных с ББ с 20–35 до 1–4% [8]. Также в ряде клинических исследований и мета-анализов доказано, что назначение противомикробных препаратов беременным с ББ позволяет добиваться снижения риска рождения детей с низкой массой тела и преждевременных родов [9, 10]. Однако, несмотря на всю важность проблемы, число рандомизированных исследований, в которых бы изучалась эффективность и безопасность различных противомикробных препаратов при лечении ББ у беременных, ограничено [11].
Целью настоящей работы было сравнить эффективность и безопасность 7-дневных курсов цефиксима и амоксициллина/клавуланата при лечении ББ у беременных.
Материалы и методы. В 2009–2011 гг. на базе трех центров (женские консультации при ОГБУЗ КБ № 1 Смоленска, Курском государственном медицинском университете и Кировской государственной медицинской академии) было проведено многоцентровое проспективное рандомизированное исследование эффективности и безопасности 7-дневных курсов цефиксима (супракс солютаб®, «АстелласФармаЮроп Б.В.») и амоксициллина/клавуланата (амоксиклав®, «Сандоз/Лек»). В исследование включили беременных при наличии письменного информированного согласия, у которых в двух последовательных образцах мочи, собранных с интервалом 24 и более часов, был выделен один и тот же вид бактерий в титре ≥105 КОЕ/мл.
Критерии исключения из исследования: отсутствие критериев включения; наличие клинических симптомов ИМП; непереносимость цефалоспоринов или пенициллинов; установленные мочевые катетеры; прием антибактериальных средств или иммуномодуляторов; тяжелые сопутствующие заболевания: иммунодефицит, сахарный диабет, злокачественные опухоли, в том числе мочевой системы; почечная или печеночная недостаточность тяжелой степени. Также в исследование не включили пациенток, которые не могут точно придерживаться требований протокола. До начала исследования протокол, регистрационная карта, форма письменного информированного согласия получили одобрение Межрегионального независимого этического комитета.
В ходе исследования каждая пациентка была осмотрена врачом-акушером-гинекологом; были собраны анамнестические и демографические данные. Дизайн исследования предполагал проведение трех визитов. На визите 1 (при обращении) пациентка подписывала форму информированного согласия; проводились сбор средней порции свободно выпущенной мочи для бактериологического исследования, оценка критериев включения/исключения. Пациентки, соответствующие этим критериям, были рандомизированы в соотношении 1:1 в две группы. Рандомизацию проводили с помощью таблицы случайных чисел, которая была подготовлена с использованием List Randomizer (www.random.org) до начала исследования. Рандомизационные коды были предоставлены исследователям в непрозрачных пронумерованных конвертах до начала исследования, для рандомизации пациентки в 1-ю или 2-ю группу исследователь каждый раз вскрывал конверт с наименьшим номером. Пациентки 1-й группы получали цефиксим в дозе 400 мг 1 раз в сутки в течение 7 дней, 2-й группы – амоксициллин/клавуланат в дозе 625 мг 3 раза в сутки 7 дней. На визите 2 (день 10±1) и визите 3 (день 35±2) проведено физикальное обследование пациенток, оценены жалобы, сведения о нежелательных реакциях, выполнен бактериологический анализ мочи.
Данные из индивидуальных регистрационных карт с помощью метода двойного ввода внены в компьютерную базу данных (MS ACCESS). После окончания исследования все полученные данные были просуммированы и проанализированы. Статистический анализ выполнен в системе статистического анализа SAS (программный пакет SAS Institute, США, версия 8.02 для Windows XP). Описание количественных признаков, соответствующих нормальному распределению, представлено в виде среднего значения±стандартное квадратическое отклонение.
Результаты. Всего были обследованы 1080 беременных женщин, ББ была выявлена у 128 (11,9%) женщин, из которых 112 соответствовали всем критериям включения в исследование. Из 112 женщин 58 были рандомизированы в 1-ю группу (терапия цефиксимом), 54 – во 2-ю (терапия амоксициллином/клавуланатом). Средний возраст пациенток 1-й группы составил 25,2±6,6, 2-й – 26,6±5,8 года. Все визиты исследования прошли 94,8% (55/58) пациенток 1-й группы и 98,2% (53/54) – 2-й.
Эрадикация возбудителя на визите 2 была констатирована у 55 (94,8%) пациенток 1-й группы и у 53 (98,2%) – 2-й (p=0,35, метод сравнения выборок χ2); на визите 3 – у 51 (92,7%) и 49 (92,5%) пациенток соответственно (p=0,96, метод сравнения выборок χ2).
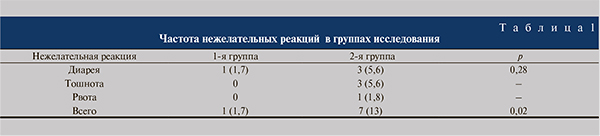
В ходе исследования были выявлены статистически значимые различия в общей частоте нежелательных реакций (табл. 1). Следует отметить, что в обеих группах нежелательные реакции не носили тяжелого характера, не требовали отмены препаратов и назначения дополнительной лекарственной терапии.
Обсуждение. В настоящее время ББ у беременных представляет важную медико-социальную проблему в связи с ее широкой распространенностью и значимыми последствиями как для самой беременной, так и для новорожденного [1].
Данные о частоте ББ у беременных значительно варьируются. Так, наибольшая частота ББ у беременных была выявлена в исследованиях, проведенных в Бразилии (12,3%) [12], Нигерии (10,7%) [13], Турции (8,5%) [14] и США (6,8%) [15], а наименьшая – в Таиланде (5,1%) [16], Новой Зеландии (4,7%) [17], Канаде (4,7%) [18] и Испании (4,1%) [11].
В нашем исследовании указанный показатель составил 11,9%, что сопоставимо с результатами, полученными в Бразилии и Нигерии.
На сегодняшний день установлено, что беременность является значимым фактором риска развития ББ. По данным зарубежных исследователей, в популяции здоровых молодых небеременных женщин частота ББ значительно меньше и колеблется в пределах 1–5% [19]. По результатам исследования, проведенного нами в 2011 г. в Смоленске с участием 100 молодых небеременных женщин (средний возраст – 20,4±0,2 года), частота ББ оказалась достоверно ниже, чем в популяции беременных (3 против 11,9%, p=0,007), что согласуется с результатами зарубежных исследований.
При выявлении ББ у беременных рекомендовано проведение противомикробной терапии, при этом следует отметить, что к этим препаратам предъявляется ряд требований: высокая природная активность в отношении потенциальных возбудителей ББ; низкий уровень популяционной антибиотикорезистентности уропатогенов; способность создавать высокие концентрации в моче и органах мочевой системы; безопасность для плода; благоприятный профиль безопасности, хорошая переносимость и возможность приема внутрь.
На сегодняшний день в полной мере всем перечисленным требованиям отвечают ингибиторозащищенные аминопенициллины, пероральные цефалоспорины III поколения [19].
К сожалению, на данный момент проведено недостаточно клинических исследований эффективности и безопасности противомикробных препаратов при лечении ББ у беременных. Так, в отечественной и зарубежной литературе опубликованы результаты единичных рандомизированных контролируемых исследований эффективности и безопасности амоксициллина/клавуланата, фосфомицина, нитрофурантоина, пероральных цефалоспоринов II поколения и сульфаниламидов при лечении ББ у данной категории пациентов [11, 20] (табл. 2).
В нашем исследовании высокую эффективность продемонстрировали оба режима терапии. Частота эрадикации уропатогенов составила 94,8% для цефиксима и 98,2% для амоксициллина/клавуланата в отсутствие статистически достоверных различий. В подобном исследовании испанских ученых эффективность аналогичного курса амоксициллина/клавуланат была несколько ниже – 80,4% [11]. В доступной литературе не опубликовано исследований цефиксима при ББ у беременных, однако накоплен определенный опыт, позволяющий подтвердить высокую эффективность пероральных цефалоспоринов II поколения при лечении данной инфекции. Так, в исследовании [22] показано, что 5-дневный курс цефуроксимаксетила в дозе 250 мг 2 раза в сутки обеспечивал эрадикацию уропатогенов в 95% случаев. Таким образом, полученные в нашем исследовании данные о высокой эффективности цефалоспоринов III поколения при ББ у беременных согласуются с существующими оценками пероральных цефалоспоринов при данном виде инфекции.
Вероятно, высокая эффективность цефиксима и амоксициллина/клавуланата, выявленная в нашем исследовании, помимо хороших фармакокинетических параметров обоих препаратов во многом обусловлена их высокой активностью in vitro в отношении основного возбудителя ИМП – уропатогенной E. coli. По данным эпидемиологического исследования, проведенного в ряде регионов России, не было выделено устойчивых к цефиксиму штаммов E. coli, полученных от амбулаторных пациенток с неосложненными ИМП [25]. Наряду с этим уровень устойчивости уропатогенной E. coli к амоксициллину/клавуланату в России несколько выше, чем к цефиксиму, и составляет 4,9% [26].
При сопоставимой эффективности исследуемые препараты значительно различались по частоте развития нежелательных реакций. Так, удалось установить, что прием амоксициллина/клавуланата сопровождался достоверно более высокой частотой развития нежелательных реакций со стороны ЖКТ (тошнота, рвота и диарея), чем цефиксим (1,7 против 13%, p=0,02), что согласуется с результатами исследования, выполненного испанскими учеными [11]. В ходе него установлено, что назначение амоксициллина/клавуланата в дозе 625 мг 3 раза в сутки в течение 7 дней беременным с ББ в 19,6% наблюдений сопровождалось развитием нежелательных реакций, при этом наиболее часто они отмечались со стороны ЖКТ – диарея, тошнота и рвота.
Выводы
- Распространенность ББ у беременных в ряде регионов России составляет 11,9%.
- Семидневные курсы цефиксима в дозе 400 мг 1 раз в сутки и амоксициллина/клавуланата в дозе 625 мг 3 раза в сутки являются высокоэффективными режимами терапии ББ у беременных в России.
- Прием амоксициллина/клавуланата беременными с ББ достоверно чаще сопровождается развитием нежелательных реакций со стороны ЖКТ.