Введение. Уретриты у мужчин до настоящего времени остаются одними из самых распространенных заболеваний. По оценкам разных авторов, их частота в пределах разных возрастных групп достигает 40% и не имеет тенденции к снижению. Уретриты занимают приоритетное место среди факторов, приводящих к мужскому бесплодию [1].
Методы лабораторной диагностики, имеющие различную степень чувствительности, позволяют ставить этиологический диагноз, но не отражают системности и распространенности патологического процесса.
До настоящего времени недостаточно хорошо разработаны вопросы диагностики уретритов – как специфических, так и неспецифических. Несовершенство диагностики и лечения уретритов можно продемонстрировать на примере уретритов гонококковой природы. Так, в соответствии с МКБ-10 учитывают несколько форм гонококковой инфекции: А 54.0 – гонококковая инфекция нижних отделов мочеполовой системы без абсцедирования парауретральных и придаточных желез; А 54.1 – гонококковая инфекция нижних отделов мочеполового тракта с абсцедированием аналогичных желез. Это различие имеет большое значение при назначении терапии. Но достоверно диагностировать абсцедирование можно лишь с помощью инструментальных методов исследования, в частности уретроскопией. Эндоскопические методы необходимы для правильной постановки диагноза (в соответствии с МКБ-10) и назначения действенной терапии в каждом конкретном случае [2].
Возрастающий удельный вес хронических процессов с частыми рецидивами на фоне бессимптомного течения инфекций, передаваемых половым путем (ИППП), требует дальнейшего изучения и выработки алгоритма обследования, тактики лечения данной группы больных [3].
Полиморфизм, изменчивость клинических проявлений, отсутствие патогномоничных симптомов, а также наличие латентных бессимптомных форм заболевания значительно осложняют клиническую диагностику ИППП. Больные с латентной или атипично протекающей формой урогенитальной инфекции, оставаясь не выявленными, приобретают особое значение, могут служить ее источником и резервуаром, обусловливающим возникновение спорадических случаев инфекционных заболеваний мочеполовых органов. Отсюда становится понятной исключительная важность выявления хронических латентных случаев заболеваний, обусловленных ИППП [4].
Как отмечает П. А. Щеплев [5], излеченность от хронических уретропростатитов в Российской Федерации составляет около 3%, что автор связывает с несовершенством и некорректностью проведения диагностического алгоритма обследования таких больных и, соответственно, неадекватностью проводимого лечения.
Рецидивирующая инфекция возникает почти у трети больных, имевших в анамнезе инфекционно-воспалительные заболевания мочеполовых органов. Среди впервые обратившихся пациентов с инфекционно-воспалительными заболеваниями урогенитального тракта, а также у трети ранее болевших возникает рецидив в последующие 1,5–2,0 года. В ряде случаев может возникать персистирующая инфекция, обусловленная длительным нахождением микроорганизмов в урогенитальном тракте. Причиной большинства случаев бактериальной персистенции обычно являются различные патоморфологические изменения урогенитального тракта [6].
 При бесплодии у мужчин и женщин частота воспалительных заболеваний, вызванных ИППП, достигает 40–50% [7].
При бесплодии у мужчин и женщин частота воспалительных заболеваний, вызванных ИППП, достигает 40–50% [7].
Несмотря на актуальность проблемы хронического уретрита, эффективность его лечения в настоящее время остается низкой [8]. Полноценная диагностика и качественная терапия воспалительных заболеваний, обусловленных ИППП, остаются открытым вопросом. Поскольку в большинстве случаев заболевание протекает субклинически и бессимптомно, в настоящее время для выявления признаков воспалительного процесса органов мочеполовой системы при обследовании таких пациентов на первый план выходят аппаратные методы диагностики, в частности эндоскопические и ультразвуковые технологии.
Целью исследования была оценка эффективности сафоцида в комплексном лечении уретритов, ассоциированных с ИППП.
Материалы и методы. Исследования проводились на базе кафедр дерматовенерологии Казанского Государственного медицинского университета и Казанской Государственной медицинской академии, в лечебных и лабораторных подразделениях Республиканского клинического кожно-венерологического диспансера, в подразделениях Ассоциации независимых лабораторий «Ситилаб». В исследовании приняли участие 110 мужчин. Средний возраст больных составил 34,1±1,8 года.
Критерии отбора и включения в исследование:
- наличие клинически установленного и лабораторно подтвержденного диагноза;
- удовлетворительное общее состояние больного;
- письменное добровольное информированное согласие пациента на участие в исследовании.
Критерии исключения из исследования:
- тяжелые соматические заболевания;
- наличие вируса иммунодефицита человека, паппиломавирусной, герпетической и цитомегаловирусной инфекции.
В качестве критериев контроля эффективности проводимого лечения оценивалась динамика клинических и лабораторных показателей, оценка состояния пациента врачом и самим пациентом.
Всем пациентам было проведено комплексное клинико-лабораторно-инструментальное обследование с использованием эндоскопических оптиковолоконных цифровых технологий.
При диагностике ИППП руководствовались клиническими рекомендациями, разработанными Рос-сийским обществом дерматовенерологов и косметологов «Ведение больных с инфекциями, передаваемыми половым путем, и урогенитальными инфекциями» [9], а также материалами ХI съезда дерматовенерологов (Екатеринбург, 2010) [10], поскольку в настоящее время приоритетными в диагностике ИППП являются прямые методы исследования. При этом выявление возбудителя ИППП или его ДНК служит абсолютным подтверждением окончательного этиологического диагноза.
Забор материала из уретры проведен как традиционным методом, так и в ходе эндоскопического исследования. Суть метода заключается в следующем: при уретроскопии находили пораженный участок уретры, например воспаленную литтреевую железу, фиксировали дистальный отдел тубуса уретроскопа максимально перпендикулярно по отношению к стенке уретры. Далее ватным тампоном через тубус уретроскопа удаляли слизь, слущенный эпителий, продукты воспаления и т.п. Затем зондом для забора материала раздражали этот участок уретры, что сопровождалось усилением секреции уретральной железы.
Сменив зонд, проводили адресный забор материала для исследования. Это позволило нам анализировать материал не только с поверхности слизистой оболочки уретры, но и из более глубоколежащих тканей.
Верификация диагноза гонококковой инфекции базировалась на результатах микроскопического исследования препарата, окрашенного 1%-ным раствором метиленового синего и по Граму, а также культуральным исследованием.
Для диагностики хламидийной инфекции использовано два метода, один из которых – полимеразная цепная реакция (ПЦР), второй – метод прямой иммунофлюоресценции с использованием диагностических наборов, выделенных ООО « Лабдиагностика».
Диагностика урогенитального трихомониаза базировалась на обнаружении Trichomonas vaginais с помощью микроскопического исследования нативного и окрашенного по методу Грама биоматериала, а также на результатах культурального исследования на среде Джонсона–Трасселя.
Для определения микоплазм применяли метод ПЦР, а также культуральное исследование с определением титра колониеобразующих единиц в 1 мл биоматериала.
Гарднереллы идентифицировались микроскопическим исследованием нативного и окрашенного по Граму уретрального мазка, а также методом ПЦР.
Степень воспалительной реакции уретры определена путем микроскопии биоматериала из мочеиспускательного канала с оценкой микробного пейзажа мазка, наличию и количеству лейкоцитов, слизи.
Патогенетический (топический) диагноз основывался на результатах цифровой оптиковолоконной эндоскопии с компьютерной обработкой данных на эндоскопе фирмы RZ (Германия).
Состояние слизистой оболочки уретры оценивали по общепринятым параметрам уретроскопической картины:
- состояние центральной фигуры и ее соответствие анатомическому отделу уретры;
- состояние эпителиального покрова уретры;
- состояние уретральных желез;
- состояние сосудистого рисунка слизистой оболочки;
- кровоточивость;
- болезненность процедуры.
Местную анестезию при проведении эндоскопических вмешательств проводили 2%-ным гелем лидокаина в количестве 2–3 мл с экспозицией 3–4 мин. В качестве ирригационной жидкости использовали физиологический раствор (0,9%-ный раствор NaCl) в количестве 300–400 мл.
Этиотропное лечение проведено cафоцидом, содержащим в своем составе азитромицин (1 г), секнидазол (2 г) и флуконазол (150 мг), с интервалом 5 дней и с учетом пролонгированного действия препарата. Показания к назначению сафоцида: в том числе сочетанные инфекции мочеполового тракта, передающиеся половым путем, специфические и неспецифические уретриты.
По истечении сроков клинического исследования оценили эффективность применения сафоцида.
Результаты и обсуждение. Наиболее высокая заболеваемость отмечена в возрастной группе 30–39 лет – 37,4% пациентов; доля заболевших в возрасте 20–29 лет составила 31,2%, 40–49 лет – 12,6%, 17–19 лет – 10,8% и наименьшей была в возрастной группе 50 лет и старше – 8%.
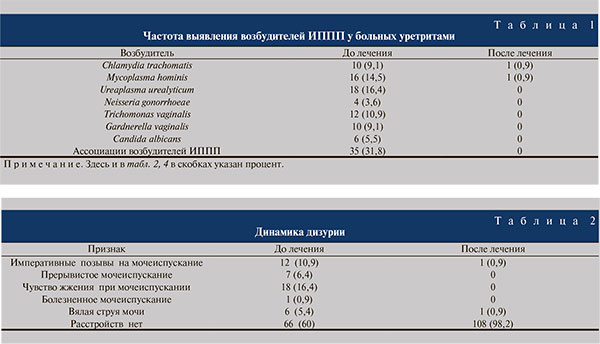
Микробиологический состав биопроб у больных с воспалительными заболеваниями мочеиспускательного канала, связанными с ИППП, представлен в табл. 1. Чаще всего встречались уреаплазменная инфекция и различные ассоциации возбудителей ИППП. Полной элиминации возбудителей удалось достичь в 96,4% наблюдений.
Об эффективности санации уретры судили по содержанию лейкоцитов в мазках из уретры, результатам бактериологических исследований. Если до лечения повышенное содержание лейкоцитов определялось у 39,9% пациентов, то по его окончании – лишь у 0,8%.
Изучая клинические проявления ИППП, обращали внимание на характер выделений из мочеиспускательного канала. Слизистые выделения определены у 11 (10%) пациентов, слизисто-гнойные – у 4 (3,6%). Гнойных выделений не было ни у кого. После проведенного лечения у 109 (99,1%) больных выделения из уретры отсутствовали, у 1 (0,9%) сохранялись выделения слизистого характера.
 Также у всех пациентов выявлены признаки воспалительного процесса в области наружного отверстия уретры. Оказалось, что в 76 (69,1%) наблюдениях клинических проявлений не было. Гиперемия диагностирована у 6 (5,5%) больных, отечность – у 4 (3,6%), слипание губок уретры – у 24 (21,8%). После лечения у 108 (98,2%) пациентов проявления отсутствовали, у 2 (1,8%) наблюдалось слипание губок уретры.
Также у всех пациентов выявлены признаки воспалительного процесса в области наружного отверстия уретры. Оказалось, что в 76 (69,1%) наблюдениях клинических проявлений не было. Гиперемия диагностирована у 6 (5,5%) больных, отечность – у 4 (3,6%), слипание губок уретры – у 24 (21,8%). После лечения у 108 (98,2%) пациентов проявления отсутствовали, у 2 (1,8%) наблюдалось слипание губок уретры.
Больные предъявляли жалобы на различные нарушения акта мочеиспускания (табл. 2).
Следует отметить, что более чем у половины пациентов жалобы отсутствовали, а самой частой была жалоба на чувство жжения во время мочеиспускания – 18 (16,4%) пациентов. В результате лечения число пациентов, не предъявивших жалобы на дизурию, возросло до 108 (98,2%).
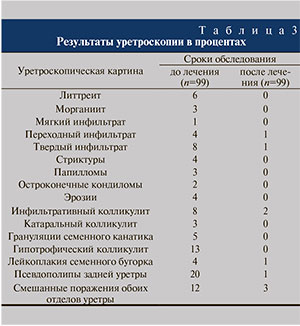
После первичного обследования 99 больным была проведена цифровая оптиковолоконная тотальная уретроскопия с целью оценки состояния слизистой оболочки уретры, результаты которой представлены в табл. 3. Для профилактики возможных инфекционно-воспалительных осложнений после процедуры проведена инстилляция уретры официальным 0,05%-ным раствором хлоргексидина в количестве 3–4 мл с экспозицией 2–3 минуты.
Наиболее часто в патологический процесс была вовлечена задняя уретра, особенно простатический отдел, доля поражения которого составила 54% (53 больных).
По окончании лечения была проведена повторная уретроскопия: инфильтративный уретрит диагностирован в 2 (2%) наблюдениях, по 1 больному имели псевдополипы задней уретры, переходный инфильтрат, твердый инфильтрат и лейкоплакию семенного бугорка, у 3 пациентов выявлены смешанные поражения. Таким образом, только у 9 (9%) пациентов сохранились различные патоморфологические изменения слизистой оболочки уретры, т.е. показатель эффективности составил 91%.
Комплексная оценка терапевтического эффекта на основе объективных показателей, результатов комплексного обследования специалистом и субъективной оценки своего состояния самим пациентом проведена сразу после окончания лечения, через 2 нед и 1 мес после окончания лечения (табл. 4).
Как видно из приведенных данных, 86 (78,2%) пациентов отметили отличный результат уже сразу после окончания лечения, тогда как неудовлетворительный результат констатирован 4 (3,6%) больными, причем по мнению как врача, так и самих пациентов.
Через 1 мес после окончания лечения ни по оценке пациента, ни по оценке врача неудовлетворительных результатов не было (рис. 1, 2).
В целом градация результатов выглядела следующим образом:
- отличный результат – отсутствие клинических проявлений, нормальные лабораторные показатели, а также отсутствие нежелательных эффектов, которые могли бы быть связаны с приемом препаратов, – 97% больных.
- хороший результат – отсутствие клинической симптоматики, незначительные отклонения лабораторных показателей – 2,3% больных.
- удовлетворительный результат – наличие клинических симптомов в выявлении того или иного возбудителя ИППП – 0,7% больных.
- неудовлетворительный результат – отсутствие положительной динамики и/или ухудшение клинических симптомов и/или ухудшение лабораторных данных.
Вывод. Комбинированный препарат сафоцид является высокоэффективным средством этиотропного лечения специфических и неспецифических уретритов, определяющим элиминацию возбудителей ИППП в 96,4% случаев.