Мочекаменная болезнь (МКБ) – распространенное хроническое заболевание, заболеваемость которым неуклонно растет и затрагивает более молодые слои населения [1, 2].
Многочисленные исследования, посвященные камнеобразованию, показали, что риск уролитиаза увеличивается при первичном анатомо-функциональном поражении почки(ек), наличии аномалий, нарушений уродинамики и инфекции мочевыводящих путей, на фоне которых воздействие различных экзо- и эндогенных факторов, сопровождающихся метаболическими нарушениями, может сопровождаться формированием мочевых камней [3–8]. Среди причин часто (до 20%) указывается первичный гиперпаратиреоз (ПГПТ).
В свою очередь ПГПТ диагностируется в 5% случаев при кальциевых камнях [1]. По данным российских авторов, при ПГПТ у 51% пациентов выявляется нефролитиаз [9].
Уровень гиперкальциемии обусловлен наличием и распространенностью кальцийчувствительного рецептора (CASR) в различных тканях человека. Наибольшая его плотность выявлена в околощитовидных железах и почках [10]. CASR экспрессируется во многих отделах нефрона – апикальной мембране проксимального извитого канальца, базолатеральной мембране кортикального и медуллярного дистального прямого канальца петли Генле и дистального извитого канальца, а также в некоторых клетках кортикальных собирательных трубочек и апикальной мембране собирательной трубки внутренней зоны мозгового вещества [10, 11].
Повышение концентрации ионов кальция приводит к конформационным изменениям в экстрацеллюлярном домене этого трансмембранного белка с дальнейшим преобразованием его в интрацеллюлярный сигнал, ингибирующий секрецию паратиреоидного гормона (ПТГ) и модулирующий процессы транспорта ионов и воды в почечных канальцах. В почках ПТГ, взаимодействуя со своим рецептором, стимулирует накопление цАМФ, увеличивает активность транспорта кальция, натрия и магния [11, 12].
Цель исследования: изучить клинико-лабораторные показатели пациентов с различными формами МКБ в зависимости от наличия ПГПТ.
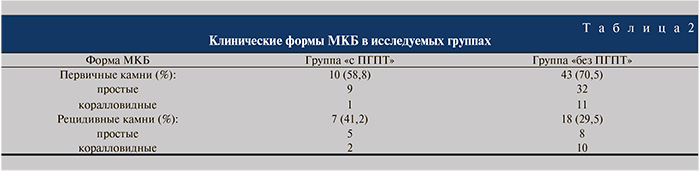
Материалы и методы. В исследование включены 78 пациентов с МКБ. Клинические формы МКБ: первичные камни выявлены у 53 больных, рецидивные – у 25; простые – у 54, коралловидные – у 24. У 17 пациентов диагностирован ПГПТ.
Критерии включения: пациенты обоего пола с МКБ, с МКБ и ПГПТ; возраст пациентов – от 20 до 80 лет.
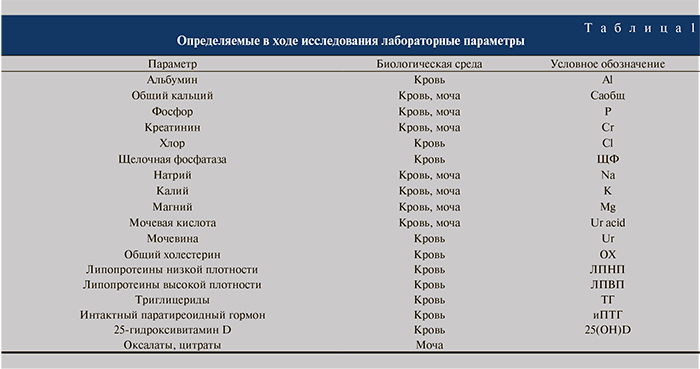
Лабораторные исследования (табл. 1) проводили на базе лаборатории клиники акушерства и гинекологии УКБ № 2 Первого МГМУ и Эндокринологического научного центра (ЭНЦ).
Статистическая обработка результатов проводилась с использованием пакета прикладных программ Statistica 6.0. Качественные признаки описывались в виде долей и абсолютных значений. Для количественных признаков вычислялись медиана, крайние квартили. Сравнение количественных признаков проводилось с помощью критериев Манна–Уитни, Вилкоксона. Для изучения взаимосвязи количественных признаков применялся непараметрический метод Спирмена. Статистически значимыми считались значения критериев и коэффициентов, соответствующие р<0,05.
Результаты и обсуждение. Длительность заболевания МКБ в среднем составила 8,32 [4,6; 17,7] года, в группе пациентов с первичными камнями – 7,5 лет [3,9; 11,2], с рецидивными – 14,9 года [7,3; 19,6].
Коралловидные камни в группе «без ПГПТ» встречались у 21 (34,4%) пациента, в группе «с ПГПТ» – у 3 (17,7%) (табл. 2).
При сравнении лабораторных показателей пациентов обеих групп (табл. 3) выявлено, что группы достоверно различались по уровню иПТГ, сывороточного Саобщ, Р, Cl и ЩФ, а также кальций- и калийурии.
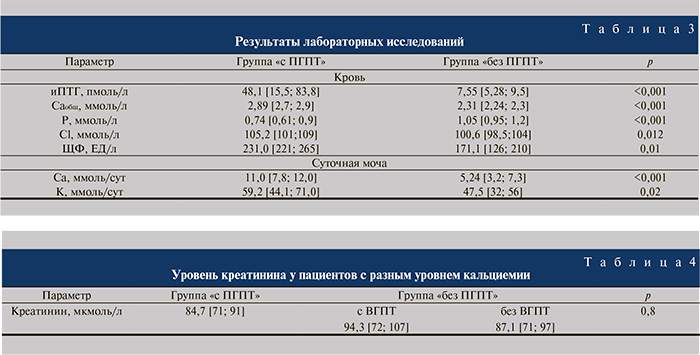
Повышение уровня ПТГ не всегда указывает на наличие ПГПТ. Чаще эти изменения бывают проявлением вторичного гиперпаратиреоза (ВГПТ), который представляет собой компенсаторную гиперфункцию околощитовидных желез на фоне гипокальциемии и/или гиперфосфатемии, и/или дефицита (недостаточности) витамина D. В нашем исследовании ВГПТ диагностирован у 24 (39%) пациентов «без ПГПТ».
Анализ содержания сывороточного Саобщ (референсные значения – 2,2–2,6 ммоль/л) в группе «без ПГПТ» выявил гипокальциемию (2,12 ммоль/л [2,09; 2,18]) у 21,3% пациентов. Наблюдалась положительная связь между уровнем кальция и витамина D (rs =0,471; р=0,036), отрицательная – между уровнем кальция и ПТГ (rs =–0,27; р=0,044). Средний уровень 25(ОН)D у пациентов с гипокальциемией составил 14,7 [9,9; 21,8] нг/мл, что соответствует дефициту витамина D.
Распространенность ВГПТ составила 28% (n=6) среди пациентов с коралловидными камнями и 45% (n=18) – с простыми камнями. У пациентов с первичными и рецидивными камнями встречаемость ВГПТ была одинаковой – 39,5 и 38,9% соответственно.
Как известно, между кальцием и фосфором существует реципрокные отношения. В нашем исследовании они выявлены у всех пациентов с МКБ (rs =–0,323; р=0,007). Определены также взаимосвязи между уровнем Саобщ и Cl как у всех пациентов с МКБ (rs=0,529; р<0,001), так и у пациентов «без ПГПТ» (rs=0,519; р<0,001).
Дефицит витамина D, снижение всасывания Са и увеличение синтеза ПТГ могут быть связаны также с уменьшением количества действующих нефронов при снижении функции почек. Средний уровень креатинина оказался выше у пациентов с ВГПТ. Однако при мультифакторном анализе различий в группах не выявлено (табл. 4).

Концентрация активного метаболита витамина D обычно низка у пациентов не только с гипокальциемией, но и с гипомагнемией [13]. Гипомагнемия (референсные значения – 0,65–1,03 ммоль/л) выявлена только в группе «без ПГПТ» (у 13,1%). По уровню магнемии группы между собой достоверно не различались (р=0,177). У 87,5% пациентов с гипомагнемией наблюдались коралловидные камни.
У пациентов «без ПГПТ» выявлена положительная связь между уровнем Mg и витамина D (rs=0,52; р=0,039), т.е. гипомагнемия сопровождается недостаточностью или дефицитом витамина D.
Еще в 1932 г. продемонстрировано, что гипомагнемия приводит к повышению нервно-мышечной возбудимости, что указывало на влияние Mg на метаболизм Са [14]. У всех пациентов с МКБ мы выявили достоверную положительную связь между уровнями Mg и Саобщ (rs=0,285; р=0,02).
Установлена достоверная положительная корреляция между уровнем сывороточного Mg и Cl (rs=0,316; р=0,022) у всех пациентов с МКБ. Как было продемонстрировано выше, Саобщ также коррелирует с уровнем Cl, что указывает на вероятную роль Cl в развитии нефролитиаза.
Мы не выявили никакой достоверной взаимосвязи между уровнем Mg в крови и различными параметрами суточной мочи.
В норме Mg и Са одинаково влияют на синтез и секрецию ПТГ [15]. Повышенное содержание Mg вызывает структурное изменение в CASR клеток околощитовидных желез, увеличивая уровень внутриклеточного Са с последующим подавлением секреции ПТГ. При дефиците Mg, с одной стороны, увеличивается уровень ПТГ, с другой – страдает его секреция, что ведет к гипокальциемии [16]. Большинство пациентов с дефицитом Mg и гипокальциемией вместо повышенного уровня ПТГ имеют несоответствующий для гипокальциемии нормальный или низкий уровень ПТГ [17], что связано с нарушением фосфоинозитольной системы и/или уменьшением активности аденилатциклазы, поскольку оба процесса Mg-зависимы [18–20].

Для оценки влияния Mg на кальциемию и ПТГ мы разделили пациентов «без ПГПТ» на три группы в зависимости от уровня магниемии (табл. 5). При мультифакторном анализе доказано, что группы достоверно различались между собой по содержанию магния (р<0,001).
Достоверная положительная корреляция между уровнем кальциемии и магниемии получена только в 1-й группе (rs=0,661; р=0,019). Данная взаимосвязь показывает, что только недостаточность или дефицит Mg достоверно влияет на уровень кальциемии. В 1-й группе не выявлено никаких достоверных взаимосвязей между Mg и ПТГ, однако показана зависимость между Саобщ и ПТГ (rs=0,685; р=0,001). Отрицательная корреляция между уровнем Mg и ПТГ выявлена во 2-й (rs=–0,513; р=0,015) и 3-й (rs=–0,557; р=0,031) группах. Никаких зависимостей между уровнем магнийурии и ПТГ в группах не получено.
Проведенный анализ показал, что низконормальный или низкий уровень Ca крови, в отличие от Mg, имеет более сильное влияние на ПТГ. Однако при нормальном уровне Ca уже выявляется влияние Mg на уровень ПТГ.
Гиперкальцийурия как один из главных факторов риска образования и рецидивирования камней при МКБ выявляется достаточно часто и находится под регулирующим влиянием комплекса факторов. Гиперкальцийурия (референсные значения – 2,5–8 ммоль/сут) чаще встречалась в группе «с ПГПТ», однако по уровню кальцийурии группы не различались (р=0,845) (табл. 6).
В группе «без ПГПТ» гиперкальцийурия выявлена только у 2 из 21 пациента с коралловидными камнями, а в группе «с ПГПТ» – у всех 3 пациентов с коралловидными камнями.
Для оценки зависимости кальцийурии от различных параметров крови проведен анализ взаимосвязей. Выявлено, что Саобщ и ПТГ имеют достоверное положительное влияние на кальцийурию (для Са rs=0,479; р<0,001, для иПТГ rs=0,451; р=0,001) только у всех пациентов с МКБ; после разделения пациентов на группы «без ПГПТ» и «с ПГПТ» связь определить не удалось.
На кальцийурию влияет также концентрация в моче ионов Mg. Впервые это влияние описано еще в 1909 г. при парентеральном введении Mg различным видам экспериментальных животных [21]. Анализируя данные, мы выявили сильную зависимость между уровнем кальцийурии и магнийурии (rs=0,627; р<0,001) у всех пациентов с МКБ. После разделения пациентов на группы «с ПГПТ» и «без ПГПТ» достоверное влияние выявлено только у пациентов «без ПГПТ» (rs=0,693; р<0,001). Скорее всего, это указывает на снижение роли Mg при наличии ПГПТ, поскольку при избытке ПТГ повышение концентрации фильтруемого Са (вследствие его усиленной мобилизации из костей) приводит к увеличению абсолютного количества Са в моче, несмотря на повышение его фракционной реабсорбции.
Исследования на животных показали, что на уровень кальцийурии и фосфатурии может влиять также длительная диета, обогащенная жирами животного происхождения [22]. Японские авторы предлагают считать МКБ еще одним компонентом метаболического синдрома [23]. Атерогенные компоненты липидного профиля представлены в табл. 7.

Мы не получили достоверной связи между компонентами липидного профиля и кальций- с фосфатурией. Однако выявлено, что у всех пациентов с МКБ чем больше уровень Саобщ, тем выше уровень ОХ (rs=0,332; р<0,01). После разделения пациентов на группы «с ПГПТ» и «без ПГПТ» достоверной корреляции не выявлено. Как видно из табл. 8, группы сопоставимы между собой.
Однако независимо от уровня кальцийурии дислипидемия, являясь компонентом метаболического синдрома, также увеличивает риск нефролитиаза. Условием для манифестации генетически детерминированной программы атеросклероза является длительный дефицит Mg, при котором повышаются уровень ОХ, ТГ, ЛПНП, активность ГМК-КОА-редуктазы, снижаются уровень ЛПВП и активность протеинлипазы, лецитинхолестероламинотрансферазы [24]. Проанализировав влияние магнемии на липидный профиль, выявили, что у всех пациентов с МКБ имеет место значимая связь между Mg и ТГ (rs= –0,296; р=0,04); Mg и ЛПВП (rs=0,339, р=0,03). С уровнем магниемии более тесная связь выявлена в группе «с ПГПТ» с уровнем ТГ (rs=-0,672, р=0,02) и ЛПВП (rs=0,883, р<0,01).
В группе пациентов «с ПГПТ» в отличие от всех пациентов и пациентов «без ПГПТ» выявлена сильная отрицательная связь Mg с ЛПНП (rs=-0,791, р=0,03). Следовательно, низкий уровень Mg как самостоятельно, так и через повышение атерогенных липидов может увеличивать риск нефролитиаза, особенно при ПГПТ.
Известно, что цитрат мочи ингибирует, а оксалат, наоборот, повышает риск кальцийоксалатного камнеобразования. Выявлено, что снижать экскрецию цитрата с мочой может дефицит калия [2]. В нашем исследовании мы не получили достоверной взаимосвязи между уровнем сывороточного калия и цитратурией, однако у пациентов «без ПГПТ» выявлена отрицательная корреляция между кальциемией и цитратурией (rs = -0,677; р = 0,03).
При сравнении показателей цитратурии и оксалурии в группах «с ПГПТ» и «без ПГПТ» достоверных различий не выявлено (р>0,05). Также не получено достоверных различий при оценке уровня цитратурии (р=0,945) и оксалурии (р=0,186) у пациентов с простыми и коралловидными камнями.
Гипероксалурия выявлена у 42,3% пациентов «без ПГПТ» и у 35,3% – «с ПГПТ». При оценке встречаемости гипероксалурии в зависимости от клинических форм МКБ выявлено, что при простых камнях она диагностируется у 36,8% пациентов, а при коралловидных – у 57,2%.
В нашем исследовании отмечено значительное влияние натрийурии на экскрецию с мочой оксалатов, ионов Mg, К. Между уровнями натрийурии и оксалатурии выявлена значимая связь (rs=0,707; р<0,001) как у всех пациентов, так и отдельно в группах «без ПГПТ» (rs=0,602; р=0,029) и «с ПГПТ» (rs=0,925; р<0,001). Натрийурия также положительно коррелирует с магнийурией (rs=0,362; р=0,015) у всех пациентов и у пациентов «без ПГПТ» (rs=0,435; р=0,013). Сильная связь выявлена между натрийурией и калийурией (rs=0,554; р<0,001) как у всех пациентов, так и в группах «с ПГПТ» (rs=0,478; р<0,001) и «без ПГПТ» (rs=0,514; р<0,001). Проведенный анализ указывает на вероятную роль натрийурии в развитии нефролитиаза.
Заключение. Уролитиаз является одним из клинических проявлений ПГПТ. Однако, несмотря на явные нарушения фосфорно-кальциевого обмена при ПГПТ, доказать ведущую роль гиперфункции околощитовидных желез в развитии уролитиаза без исходных анатомо-функциональных изменений в мочевой системе не удается.
Считается, что ПГПТ является этиологическим фактором лишь коралловидного нефролитиаза. Проведенный нами анализ показал, что коралловидные камни в группе «без ПГПТ» встречались чаще, чем в группе «с ПГПТ», а в целом у пациентов с коралловидными камнями ПГПТ был диагностирован в 12,5% наблюдений.
В диагностике ПГПТ ведущее место занимает определение уровня кальция в сыворотке крови, а не ПТГ, что до сих пор не является обязательным рутинным методом обследования во многих клиниках. Повышение уровня ПТГ не всегда служит свидетельством ПГПТ. Чаще эти изменения выступают как проявление ВГПТ, как было продемонстрировано в нашем исследовании.
Согласно полученным данным, ионы магния как самостоятельно, так и опосредованно через влияние на кальцийурию и атерогенные компоненты липидного обмена играют немаловажную роль в развитии уролитиаза.
Исходя из вышесказанного, можно сделать вывод о важности определения гормонально-биохимических показателей фосфорно-кальциевого, липидного обменов у всех пациентов с МКБ и их коррекции для профилактики рецидивов заболевания.



