Введение. В настоящее время для замещения мочеточника и мочевого пузыря предложено и используется на практике более 80 различных вариантов восстановительных операций [1, 2]. Наибольшее распространение среди них нашли реконструктивные вмешательства с использованием собственных неизмененных тканей мочевых путей (уретероуретероанастомоз, различные варианты перекрестных анастомозов, операции Боари, Демеля и psoas-hith), а также операции с применением в качестве трансплантатов различных сегментов желудочно-кишечного тракта (ЖКТ), в том числе и червеобразного отростка [3].
Экспериментальное обоснование и внедрение в клиническую практику операций по замещению мочеточника различными сегментами ЖКТ стали важным этапом развития оперативной урологии [4–7]. Однако до сих пор продолжается дискуссия в отношении хирургической техники и выбора оптимального пластического материала [8–11]. Каждая клиника пропагандирует тот метод, которым она чаще всего пользуется на практике. Это объясняется отсутствием исследований, позволяющих на большом клиническом материале сравнить отдаленные результаты реконструктивно-восстановительных операций с использованием собственных неизмененных тканей мочевыводящих путей и заместительных пластик мочеточников с применением различных сегментов ЖКТ и в особенности червеобразного отростка.
Целью настоящей работы было сравнить отдаленные результаты хирургического лечения пациентов с протяженными сужениями мочеточников, которым произведена кишечная и аппендикулярная уретеропластика или пластика с использованием собственных неизмененных тканей мочевыводящих путей.

Материалы и методы. Для проведения сравнительного исследования нами были отобраны 175 больных с протяженными сужениями тазовых отделов мочеточников, прооперированных и наблюдавшихся в нашей клинике с 1998 по 2014 г. Возраст обследованных колебался от 18 до 69 лет и в среднем составил 45,3±8,7 года. Мужчин было 79 (45,2%), женщин – 96 (54,8%). Все пациенты были разделены на три группы. Первую составили 102 (58,3%) больных, которым пластика произведена с использованием неизмененных тканей мочевыводящих путей (операция Боари и ее модификации). Во 2-ю группу вошли 54 (30,1%) больных, которым выполнена кишечная пластика мочеточников, в 3-ю – 19 (10,9%) пациентов, перенесших аппендикоуретеропластику. Сравниваемые группы не имели статистически значимых различий по полу и возрасту (p<0,05).
Оценку функционального состояния почек и мочевых путей в ближайшем и отдаленном послеоперационном периодах осуществляли на основании результатов комплексного обследования, включившего определение уровня сывороточного креатинина, электролитов, кислотно-основного состояния крови, ультрасонографию верхних и нижних мочевых путей, экскреторную урографию, реносцинтиграфию, ретроградную и антеградную пиелоуретерографию с пробой Whitaker'a, компьютерную томографию брюшной полости и малого таза, комплексное уродинамическое исследование, при необходимости – цисто- и уретероскопию.
Срок наблюдения составил от 3 мес до 16 лет (в среднем 7,3±0,8 года). При обработке данных все статистические вычисления производили с использованием компьютерной программы STATISTICA for Windows. При сравнениях установлен уровень значимости α=0,05.

Результаты и обсуждение. В послеоперационном периоде больные получали антибактериальную и симптоматическую терапию. Большое внимание уделяли функции мочевых дренажей, проводили периодическое их промывание растворами антисептиков. Мочеточниковые интубаторы удаляли на 10–12-е сутки. После этого выполняли антеградную пиелоуретерографию и при хорошей проходимости извлекали нефростомический дренаж, а затем выписывали больного на амбулаторное лечение.
Ранние послеоперационные осложнения после замещения мочеточников по методу Боари возникли у 5 (4,9%) больных: у 1 – несостоятельность уретероцистоанастомоза (проведено эндоскопическое трансуретральное стентирование анастомоза); у 3 – нагноение раны, вторичное заживление (консервативное лечение), у 1 – тромбоз наружной подвздошной артерии (консервативное лечение). Во всех наблюдениях констатировали выздоровление.
Еще более интересны данные о поздних осложнениях после этих операций. Это связано с тем, что большой клинический материал отличается многообразием не только исходных показателей, но и отдаленных результатов хирургического лечения.
Как видно из табл. 1, больным на фоне прогрессирующего гидронефроза и вторичного сморщивания почки была выполнена нефрэктомия. Один пациент перенес нефролитолапаксию по поводу рецидивной мочекаменной болезни при единственной почке. Среди поздних осложнений обращают на себя внимание больные дисфункцией мочевого пузыря (5) и пациенты, у которых возник пузырно-мочеточниковый рефлюкс на здоровой стороне (2). Эти примеры подтверждают следующий тезис: широкое выделение стенки мочевого пузыря и выкраивание из него лоскута могут служить причиной развития недостаточности детрузора [12, 13].
Сведения о характере послеоперационных осложнений у больных, которым была произведена кишечная пластика мочеточников, приведены в табл. 2.
Таким образом, в группе пациентов, которым произведена пластика тазового отдела мочеточника по методу Боари, ранние послеоперационные осложнения развились у 5 (4,9%) пациентов, поздние – у 13 (12,8%), что оказалось достоверно выше, чем в группах сравнения (p<0,05). Среди перенесших кишечную пластику мочеточников в раннем послеоперационном периоде осложнения имели место 7 (12,9%) больных. В отдаленном послеоперационном периоде частота осложнений составила 5,6%.
У 1 (1,9%) больного образовалась стриктура уретероилеоцистоанастомоза спустя 2,5 мес после операции, у 2 (3,7%) – имелся пузырно-лоханочный рефлюкс с развитием ГУН II стадии и рецидивирующей инфекцией мочевых путей.
Среди 19 пациентов, перенесших аппендикоуретеропластику, в раннем послеоперационном периоде осложнений не наблюдали. На отдаленных сроках наблюдения они возникли у 2 (10,5%) пациентов, что оказалось достоверно ниже, чем в группе больных, перенесших операцию Боари (p<0,05). Одной пациентке в связи с развитием стриктуры уретероаппендикоанастомоза произведена резекция суженного участка с верхушкой червеобразного отростка и реанастомозирование его с мочеточником. В течение 16 лет наблюдения признаков обструктивной уропатии выявлено не было, больная чувствует себя хорошо. Еще в одном наблюдении в связи с аналогичным осложнением произведены эндоуретеротомия и стентирование правого мочеточника. После удаления стента проходимость верхних мочевых путей была восстановлена. В остальных случаях отдаленный послеоперационный период протекал гладко. Таким образом, хорошие ближайшие результаты получены от 13 (68,4%) пациентов, а отдаленные в сроки (от 1 года до 16 лет) – от всех.
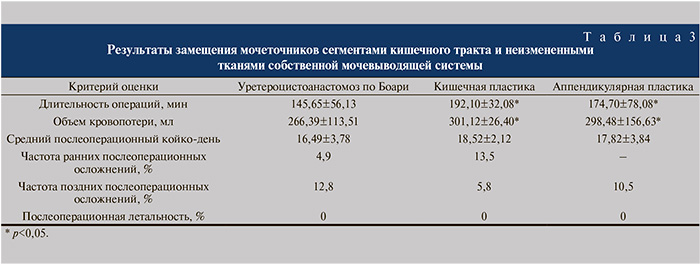
Анализируя результаты хирургического лечения протяженных дефектов мочеточников, мы основывались на ряде стандартных показателей эффективности и безопасности самого оперативного вмешательства (табл. 3).
Как видно из табл. 3, объем кровопотери и средняя продолжительность пластики мочеточников с использованием трансплантатов были достоверно выше, чем в группе пациентов, перенесших операцию Боари. Возможно, это отчасти объясняется тем, что из 73 больных, перенесших кишечную и аппендикулярную пластику, 41 (56,2%) ранее уже были оперированы, причем 18 (43,9%) из них – по 2 и более раз, а из 102 человек, которым был сделан непрямой уретероцистоанастомоз, оперированы были лишь 10 (9,8%) пациентов. С другой стороны, по количеству ранних послеоперационных осложнений эти два типа вмешательств сопоставимы, а по числу поздних осложнений кишечная пластика явно предпочтительнее операций с использованием тканей мочевого пузыря. Показатели частоты послеоперационных осложнений в группах аппендикулярной пластики и операции Боари на первый взгляд схожи, однако оказались статистически не достоверными и, вероятно, были обусловлены небольшим числом пациентов в группе аппендикулярной пластики (p>0,05).

Полученные результаты позволяют говорить о том, что по эффективности и безопасности кишечная пластика мочеточников ничуть не уступает, а может, даже превосходит операции по замещению мочеточников тканями собственной мочевыделительной системы. В связи с этим следует пересмотреть существующее отношение к реконструкции мочеточников кишечным сегментом или аппендиксом как к резервному вмешательству, к которому прибегают в последнюю очередь, когда все остальные возможности исчерпаны.
Преимущества и недостатки различных способов оперативного лечения сужений тазовых отделов мочеточников (табл. 4). В настоящее время для замещения протяженных сужений мочеточников используются три вида вмешательств: операцию Боари, аппендикоуретеропластику и кишечную пластику мочеточников. Оперирующий уролог должен владеть всеми и использовать каждый из них по показаниям. Операция Боари и ее модификации позволяют заместить протяженные сужения тазовых отделов мочеточников длиной до 12 см, тогда как кишечная пластика мочеточников дает возможность замещения дефектов любой протяженности и локализации.
Наши данные свидетельствуют о возможности замещения червеобразным отростком любого отдела правого и тазового отдела левого мочеточника у взрослых. Преимущество аппендикоуретеропластики перед операцией Боари заключается в том, что и без того поврежденному во время предшествующих операций мочевому пузырю наносится минимальная травма. При этом риск развития его дисфункции в результате образования окружающих рубцов, деформации стенки и нейроваскулярных расстройств минимален. Средняя продолжительность операции ненамного выше при аппендикулярной пластике мочеточников, однако по количеству ранних и поздних послеоперационных осложнений аппендикулярная пластика превосходит операции с использованием тканей мочевого пузыря. Изучение уродинамических характеристик нижних мочевыводящих путей показало преимущество кишечной и аппендикулярной пластик перед подобными вмешательствами, поскольку восстановление мочеточника за счет тканей мочевого пузыря достоверно уменьшает его функциональную емкость, снижает эластичность стенки, проявляясь склонностью к дисфункции мочевого пузыря и пузырно-лоханочным рефлюксам. Замещение мочеточника аппендиксом представляет собой его удлинение до мочевого пузыря. Таким образом, червеобразный отросток в роли трансплантата служит продолжением мочеточника, поэтому такое замещение можно назвать идеальной пластикой мочеточника.
Пластику мочеточника сегментом подвздошной кишки следует рассматривать как увеличение полости мочевого пузыря навстречу мочеточнику, так как кишка в данном случае играет роль буферного резервуара, относящегося к мочевому пузырю. Кишечное замещение мочеточника – более длительная и сложная операция по сравнению с непрямым уретероцистоанастомозом.
Заключение. В арсенале большинства урологов среди реконструктивных операций на верхних мочевыводящих путях интестинальная пластика мочеточника занимает последнее место, являясь отчаянной попыткой любым путем восстановить отток мочи с минимальным уроном для функции почек и качества жизни пациента. Мы считаем, что кишечная, а в ряде случаев и аппендикулярная пластики при протяженных стриктурах мочеточника зачастую являются единственно возможным оперативным пособием, позволяющим сохранить почку, избежать инвалидизирующей уретерокутанео- или нефростомии и восстановить мочеиспускание естественным путем. Данные операции позволяют заместить дефекты одного или обоих мочеточников любой локализации и протяженности, получить хорошие функциональные результаты на отдаленных сроках, нередко являясь эффективной и безопасной альтернативой операциям по замещению мочеточников тканями собственной мочевыделительной системы.



