Введение. По данным ВОЗ, в 2012 г. заболели туберкулезом 8,6 млн человек, включая 1,1 млн инфицированных ВИЧ. 170 тыс. умерших от туберкулеза выделяли возбудитель, имевший множественную лекарственную устойчивость к противотуберкулезным препаратам [1].
Урогенитальный туберкулез (УГТ) остается важной проблемой как фтизиатрии, так и урологии. Доля пациентов, выявленных своевременно, когда возможно полное исцеление консервативным путем, невелика, и тому есть как субъективные (недостаточная настороженность врачей в отношении туберкулеза), так и субъективные причины. К числу последних относится отсутствие патогномоничных симптомов и трудность верификации УГТ. «Золотым» стандартом, безусловно подтверждающим диагноз «туберкулез» любой локализации, слукжит обнаружение M. tuberculosis в патологическом материале. Однако за последние годы бактериологической верификации УГТ не удалось получить и в половине случаев. В значительной степени это обусловлено широким и зачастую бесконтрольным применением антибиотиков, тормозящих рост M. tuberculosis (но не излечивающих, а только затушевывающих заболевание), в первую очередь – фторхинолонов и амикацина. Возможны и другие неучтенные факторы, с целью выявления которых было запланировано настоящее исследование.
Второй задачей было выявить дополнительные потенциальные причины различной заболеваемости циститом разных групп населения. Известно, что у молодых мужчин практически никогда не диагно- стируют острый цистит; частота рецидивов цистита у женщин высоко коррелирует с их гормональным статусом [2–5]. Мы предположили, что в моче могут находиться неустановленные защитные факторы, зависящие от пола и возраста, и для подтверждения этой гипотезы провели настоящее исследование.
Материалы и методы. Учтя влияние большого числа факторов на заболеваемость урогенитальными инфекциями, исследовали образцы мочи четырех здоровых людей:
1-й образец — моча женщины репродуктивного возраста (25 лет), не жившей половой жизнью и, соответственно, не применявшей контрацепцию;
2-й образец — моча женщины репродуктивного возраста (27 лет), жившей половой жизнью и принимавшей оральные комбинированные контрацептивы;
3-й образец — моча женщины в менопаузе (46 лет), жившей половой жизнью и не применявшей контрацепцию (в первые два года после прекращения менструаций возможно спорадическое созревание яйцеклетки и наступление беременности, поэтому существует тенденция к продолжению контрацепции женщиной в менопаузе);
4-й образец — моча молодого мужчины (37 лет).
Такое выделение групп обусловлено доказанным влиянием половых гормонов на восприимчивость урогенитального тракта к инфекции [4]. Критерии включения: соответствие указанным группам, отсут- ствие признаков воспаления и бактериурии в общем анализе мочи; критерии исключения: урологические заболевания в анамнезе и/или в настоящее время, жалобы на нарушение мочеиспускания, менструация, патологические изменения в общем анализе мочи.
Потенциальную бактерицидность средней порции дневной мочи всех четырех образцов оценивали по влиянию на клинический изолят M. tuberculosis с множественной лекарственной устойчивостью, референс-штамм M. tuberculosis H37Rv (NCDC) и референс-штамм E. coli F-50 (№ штамма 2592), т.е. на музейные штаммы и штаммы микроорганизмов, полученных от больного.
Потенциальную бактерицидность средней порции дневной мочи оценивали по влиянию на клинический изолят M. tuberculosis с множественной лекарственной устойчивостью, референс-штамм M. tuberculosis H37Rv (NCDC) и референс-штамм E. coli F-50 (№ штамма 2592).
Использовали следующие питательные среды и растворители: жидкую питательную среду Middlbrook 7H9 BBLTM MGITTM («Becton Dickinson»), 10 %-ную обогатительную добавку BACTEC MGIT Growth Supplement OADC («Becton Dickinson»), кровяной питательный агар 5 % (нативный), питательную среду Финн II (яичную, нативную), физиологиче- ский раствор, дистиллированную воду, фосфатный буфер рН 7,8.
Ход исследования. Образцы мочи, полученные в течение 20 мин от здоровых людей, инокулировали на кровяной агар по количественному методу секторных посевов Голда. Инкубацию осуществляли в течение 18–20 ч при температуре 37°.
Приготовление бактериальной суспензии E. coli проводили следующим образом: 18-часовую культуру E. coli суспендировали в стерильном физиологическом растворе при помощи нефелометра (Phoenix Spec.BD) и доводили до стандарта мутности McFarland 1,0; 0,50 и 0,25, что соответствует 3×108;1,5×108 и 0,75×108 микробных тел/мл соответственно. Бактериальные суспензии в трех вышеуказанных разведениях в соотношении 1:1 смешивали с образцами мочи и инкубировали при комнатной температуре в течение 60 мин. Для контроля искомые суспензии в соотношении 1:1 смешивали с физиологическим раствором. После часовой экспозиции производили высев на кровяной агар. Экспозицию продолжали при комнатной температуре еще в течение 24 ч, затем так же проводили высев на кровяной агар.
В отношении микобактериальных культур использовали иную технологию. Двухнедельные микобактериальные культуры музейного штамма и клинического образца, выделенного от больного, выросшие на среде Левенштейна–Йенсена, в количестве не менее 50 колоний переносили в пробирку со стерильным физиологическим раствором и со стеклянными бусами. Содержимое пробирки гомогенизировали на вортексе в течение 1–2 мин, оставляли на 10–15 мин для осаждения частиц. Супернатант переносили в другую пробирку, мутность суспензии корректировали в соответствии со стандартом 5 ЕД ГИСК им. Л. А. Тарасевича. Далее делали пять последующих десятикратных разведений; для исследования использовали два последних разведения – 5×104 и 5×103.
Инкубацию и детекцию роста выполняли по следующей методике. Микобактериальные суспензии музейного штамма и клинического образца, выделенного от больного, в разведениях 5×104 и 5×103 смешивали с испытуемыми образцами мочи в соотношении 1:1. В качестве контроля использовали физиологический раствор, который смешивали с микобактериальными культурами в соотношении 1:1. После часовой экспозиции проводили стандартную предпосевную обработку всех образцов фосфатным буфером с последующим центрифугированием в течение 20 мин при 3000 g.
Кроме того, производили посев микобактериальных культур в разведениях 5×104, 5×103 на плотные и жидкие среды до обработки биологическими жидкостями и физиологическим раствором (контроль ростовых свойств). Посев осадка проводили на среду Финн II и бульон Middlbrook 7H9 BBLTM MGITTM (Becton Dickinson) в количестве 0,5 мл. Засеянные пробирки с плотной питательной средой инкубировали в термостате при температуре 37°. Проводили ежедневный просмотр засеянных пробирок.
Засеянные пробирки MGIT инкубировали в си- стеме BACTEC MGIT 960 до автоматической индикации наличия роста, которая подтверждается путем микроскопии мазков с окраской по Цилю–Нельсену. Пробирки с положительным результатом извлекали, пробирки с отсутствием роста продолжали инкубировать до 42 дней.
Результаты. При оценке роста E. coli был получен сплошной рост на кровяном агаре в разведениях McFarland 0,25–0,50–1,00 ЕД в контроле и образцах № 2–4. В первом образце обнаружен рост Enterobacter faecalis в титре 102 КОЕ/мл.
Нами установлено, во всех категориях испытуемых моча по своей бактерицидной активности не отличалась от физиологического раствора – как в первом образце, который оказался контаминированным Enterobacter faecalis в клинически незначимом титре, так и стерильная моча. Наличие альтернативной флоры также не сказалось на степени роста E. coli: после экспозиции в течение 60 мин и 24 ч во всех образцах получен сливной рост E. coli на кровяном агаре. Таким образом, бактерицидного действия мочи женщины репродуктивного возраста, не жившей половой жизнью и не применявшей контрацепцию; женщины репродуктивного возраста, жившей половой жизнью и принимавшей оральные комбинированные контрацептивы; женщины в менопаузе, жившей половой жизнью и не применявшей контрацепцию, и молодого мужчины на E. coli в концентрациях 3×108, 1,5×108 и 0,75×108 микробных тел/мл не отмечено. Бессимптомная бактериурия ни в коей мере не препятствовала росту E. coli.
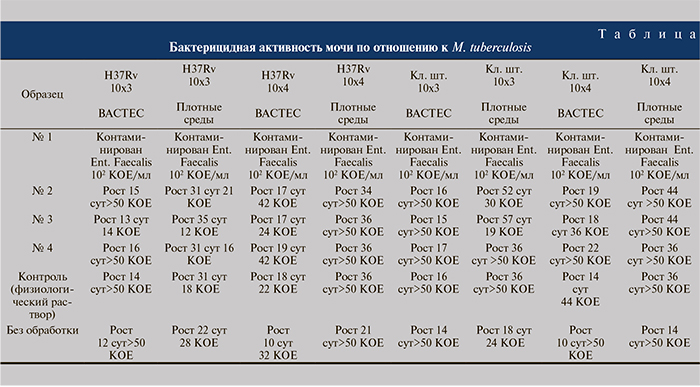
Результаты исследования активности мочи по отношению к M. tuberculosis представлены в таблице. Сравнение степени и скорости роста M. tuberculosis в культуре с добавлением мочи людей исследуемых групп показало некоторые различия по этим параметрам, не имевшие системы и достоверного подтверждения протекторных свойств изучаемых факторов.
Контаминированный Enterobacter faecalis образец 1 воспрепятствовал росту M. tuberculosis.
Таким образом, при экспозиции 45 сут при ежедневном контроле роста и подсчете КОЕ нами не установлена бактерицидная активность мочи здоровых людей по отношению к M. tuberculosis in vitro. Даже незначительная контаминация энтеробактериальной флорой препятствует идентификации МБТ.
Обсуждение. Во всем мире сегодня широко распространены урогенитальные инфекции [4, 7, 8], для которых характерна бактериурия, в том числе и асимптомная. Таким образом, в моче людей нередко присутствуют неспецифические микроорганизмы. Как показали результаты нашего исследования, наличие альтернативной микрофлоры рост E. coli не ингибировало и, соответственно, асимптомная бактериурия не препятствовала развитию неспецифической инфекции нижних мочевых путей. Хотя на прошедшем в апреле 2014 г. конгрессе EAU обсуждалась гипотеза возможного протективного влияния микрофлоры в низких титрах в отношении развития цистита. Диагностика УГТ трудна: на ранних стадиях, когда еще не сформировались деструктивные изменения, отчетливо видимые на мультисрезовых спиральных томограммах, достоверно подтвердить заболевание можно только с помощью бактериологического исследования. В доантибактериальный период «стерильная пиурия», т.е. масса лейкоцитов в моче в отсутствие роста флоры, рассматривалась как патогномоничный для уротуберкулеза симптом. В настоящее время, когда сочетание туберкулеза почек и хронического неспецифического пиелонефрита встречается в 75% наблюдений [9], он утратил свою актуальность. При этом выявляемость М. tuberculosis в моче больных УГТ, даже когда диагноз подтвержден патоморфологически и рентгенологически, не превышает 44%. Об одной из причин этого – неоправданно широком применении в эмпириче- ской терапии фторхинолонов и амикацина – мы уже упомянули выше. Полученные в ходе настоящего исследования результаты позволяют предположить еще одну причину – ингибирующее влияние уропато- генов, что препятствуют росту М. tuberculosis. Вероят-но, перед проведением бактериологического исследования мочи на М. tuberculosis пациенту с бактериурией следует проводить антибактериальное лечение препаратами, не влияющими на возбудителя УГТ: фосфомицин, нитрофураны, цефалоспорины. Это станет предметом наших дальнейших исследований.
Заключение. В проведенной работе не удалось получить подтверждений гипотезы о бактерицидном действии мочи на E. coli и М. tuberculosis, однако установлена одна из причин снижения выявления микобактериурии у больных урогенитальным туберкулезом. Совершенно очевидна необходимость продолжения исследований в этом направлении, поскольку ранняя бактериологическая диагностика туберкулеза мочеполовой системы – залог успеха в лечении.


