Введение. В настоящее время при оперативном лечении больных со стриктурами тазового отдела мочеточника методом выбора служит уретероцистанастомоз (УЦА) в различных модификациях [1–4]. При невозможности выполнения прямого анастомоза применяется УЦА по Боари или методика psoas-hitch. С активным развитием эндовидеохирургии стало возможным выполнять УЦА лапароскопическим доступом. В 1992 г. C. Nezhat и соавт. [5] выполнен первый лапароскопический уретероуретероанастомоз при травме мочеточника, случившейся во время гинекологической операции. A. Fergany и соавт. [6] сообщили о результатах лапароскопического УЦА по Боари в эксперименте на 6 самках кролика. Первый лапароскопический УЦА в клинике выполнен в 1993 г. R. Erlich и соавт. [7]. Однако, несмотря на двадцатилетнюю историю выполнения УЦА лапароскопическим доступом, количество публикаций в литературе о результатах подобных операций остается небольшим. В большинстве урологических клиник данная операция выполняется открытым доступом, так как лапароскопический УЦА требует достаточного опыта в мобилизации мочеточника и мочевого пузыря (МП), формировании антирефлюксного субмукозного тоннеля и наложении интракорпоральных швов. Совершенствование инструментов для лапароскопии и улучшение техники формирования интракорпоральных узлов позволили использовать этапы открытого УЦА при лапароскопической имплантации мочеточника.

В литературе представлены успешные результаты лапароскопического УЦА при лечении пациентов с сужениями мочеточника, его опухолях и ятрогенных повреждениях [8–12]. Стриктуры мочеточника вследствие ятрогенной травмы встречаются в 2–10% случаев и чаще всего наблюдаются после открытых гинекологических операций [13–16]. Число повреждений мочеточника во время лапароскопической гистерэктомии составляет менее 2%, однако интраоперационно они идентифицируются только в 8,6% случаев [17]. Рубцовые стенозы мочеточника развиваются после сложных эндоскопических манипуляций на верхних мочевыводящих путях (ВМП), выполненных в диагностических или лечебных целях. Парциальная уретерэктомия с УЦА также показана больным с опухолями нижней трети мочеточника [9, 10]. Несмотря на то что трансуретральная лазерная терапия высокодифференцированного переходно-клеточного рака является эффективной операцией, сужение при этом может формироваться в 5–13% случаев. C. Nezhat и соавт. [11] представили результаты успешного лечения 6 больных с эндометриозом и обструкцией мочеточника с помощью лапароскопического psoas-hitch и УЦА. O. Fugita и соавт. [18] описали лапароскопический УЦА по Боари троим пациентам со стриктурой дистального отдела мочеточника, обусловленного тазовым нейрофиброматозом, травмой мочеточника при операции по поводу грыжи диска и сужением неизвестной этиологии. В работе [3] лапароскопический УЦА выполнен 10 больным со 100%-ным успехом.
 Для выполнения лапароскопического УЦА требуется достаточный опыт в эндовидеохирургии, позволяющий производить сложную реконструктивную операцию на нижней трети мочеточника. Техника этого вмешательства непроста, так как требует мобилизации мочеточника и МП, формирования УЦА без натяжения и риска развития стриктуры, а также пузырно-мочеточникового рефлюкса (ПМР).
Для выполнения лапароскопического УЦА требуется достаточный опыт в эндовидеохирургии, позволяющий производить сложную реконструктивную операцию на нижней трети мочеточника. Техника этого вмешательства непроста, так как требует мобилизации мочеточника и МП, формирования УЦА без натяжения и риска развития стриктуры, а также пузырно-мочеточникового рефлюкса (ПМР).
Материалы и методы. С 2010 по 2014 г. в клинике СЗГМУ им И. И. Мечникова лапароскопический УЦА выполнен 12 пациентам (8 женщинам, 4 мужчинам) со стриктурами нижней трети мочеточника. Возраст больных варьировался от 19 до 64 лет (средний возраст – 35,6±8,5 года).
Из таблицы видно, что все женщины страдали ятрогенным повреждением мочеточника, возникшим в ходе гинекологических операций. Восьми пациенткам ранее были выполнены лапароскопическая гистерэктомия (5), удаление эндометриоидных узлов (2) и резекция левого яичника (1). Для мужчин показанием к операции были облитерация мочеточника после уретероскопии (3), нейромышечная дисплазия (1). Стриктура левого мочеточника диагностирована 7 больным, правого мочеточника – 5.
Больным выполнены УЗИ почек и малого таза, компьютерная томография брюшной полости и малого таза, ретроградная уретерография и антеградная пиелоуретерография при наличии нефростомического дренажа, динамическая сцинтиграфия. Данное обследование позволило уточнить локализацию стриктуры мочеточника, ее протяженность и функциональное состояние почек. Чрескожная пункционная нефростомия до реконструктивной операции выполнена 7 больным в связи с обструктивным пиелонефритом (5) и формированием мочеточниково-влагалищного свища (2). Одной пациентке из-за продолжающегося подтекания мочи в брюшную полость, несмотря на дренирование почки нефростомой, произведен лапароскопический уретеролиз с клипированием мочеточника.
Всем 12 больным выполнен лапароскопический УЦА. Под общей анестезией пациента укладывали в литотомическое положение для симультанной лапароскопии и цистоскопии. В области пупка иглой Вереша пунктировали брюшную полость, провели инсуффляцию СО2 до 12 мм рт.ст., установили троакар 11 мм для лапароскопа. После осмотра брюшной полости под визуальным контролем в контралатеральной стороне подвздошной области устанавили троакар 6 мм параректально и 6 мм по подключичной линии для рабочих инструментов, дополнительный троакар 11 мм – параректально на стороне оперируемого мочеточника. Операцию начали с инцизии париетальной брюшины по линии Тольда и вскрытия забрюшинного пространства. Мочеточник идентифицировали в зоне пересечения с общей подвздошной артерией, после взятия на держалку выделили дистальнее до зоны стриктуры. Далее пересекли его выше уровня стриктуры, спатулировали на протяжении 1,5 см, установили стент.
Достаточная мобилизация МП важна для создания анастомоза без натяжения. Для этого при необходимости можно выделить контралатеральный верхний сосудистый пучок. После определения зоны для анастомоза на задней стенке МП вскрыли его просвет на протяжении 1 см. Далее узловыми швами формировали заднюю стенку УЦА, стент устанавили в полость МП, наложили дополнительные швы на переднюю часть анастомоза. После его формирования через уретральный катетер туго заполнили МП стерильным раствором для уточнения герметичности зоны операции. Устанавили дренаж в область анастомоза, троакары извлекли и наложили узловые швы на раны.
В послеоперационном периоде проведена антибактериальная и симптоматическая терапия. На 5–7-е сутки после ретроградной цистографии и в отсутствие подтекания мочи из зоны анастомоза удален уретральный катетер. Нефростомический дренаж пережали на сутки и в отсутствие болей, лихорадки и признаков ПМР извлели его и выписали больного в поликлинику под наблюдение урологом. Через 4 нед извлекли мочеточниковый стент, выполнили экскреторную урографию для уточнения функционального состояния ВМП и цистографию для исключения ПМР.
Результаты. Всем больным успешно выполнен лапароскопический УЦА. Конверсии не было. Справа вмешательство выполнено 5 больным, слева – 7.

Четырем пациентам выполнены psoas-hitch+УЦА, двоим – операция Боари, пятерым – прямой УЦА. Больному с нейромышечной дисплазией произведены продольная резекция расширенного тазового отдела мочеточника единственной правой почки, ушивание его на стенте узловыми швами и экстравезикальная имплантация в МП. Продолжительность операции в среднем составила 145 мин (от 110 до 230 мин), объем кровопотери – 180 мл (от 120 до 245 мл). Случаев гемотрансфузии не было, срок госпитализации в среднем составил 7 дней.
 Умеренное расширение ВМП после операции наблюдалось только у больного с нейромышечной дисплазией. У остальных пациентов функция почки была своевременной, нарушений уродинамики не отмечено. При ретроградной цистографии пассивный ПМР наблюдался у 3 больных. Однако они не предъявляли жалоб со стороны мочевых путей, а анализ и посев мочи были без изменений.
Умеренное расширение ВМП после операции наблюдалось только у больного с нейромышечной дисплазией. У остальных пациентов функция почки была своевременной, нарушений уродинамики не отмечено. При ретроградной цистографии пассивный ПМР наблюдался у 3 больных. Однако они не предъявляли жалоб со стороны мочевых путей, а анализ и посев мочи были без изменений.
Приводим клинические наблюдения.
Б о л ь н а я 28 лет госпитализирована в нашу клинику с жалобами на подтекание мочи по дренажу из влагалища. Из анамнеза известно, что при обследовании по поводу бесплодия установлен диагноз кисты левого яичника. В июле 2014 г. выполнена лапароскопическая резекция левого яичника. На следующий день после операции состояние пациентки ухудшилось, появились боли внизу живота, лихорадка. На компьютерной томограмме выявлено жидкостное образование в малом тазу. Выполнена диагностическая лапароскопия, из Дугласова пространства эвакуировано около 1 л светло-желтой жидкости, установлен дренаж через влагалище. В послеоперационном периоде по дренажу за сутки выделено до 0,8–1,0 л отделяемого, которое после введения индигокармина окрасилось в синий цвет. С диагнозом «мочеточниково-влагалищный свищ» больная переведена в нашу клинику. При обследовании на экскреторных урограммах и КТ-урограмме функция обеих почек своевременная, справа нарушения уродинамики нет, слева – умеренное расширение ВМП, затек контрастного вещества в нижней трети мочеточника и выделение по дренажу (рис. 1, 2). Выполнена пункционная нефростомия слева. Однако, несмотря на хорошую функцию нефростомы, сохранено подтекание мочи в брюшную полость, приводящее к спастическим болям в животе. Проведена лапароскопия, выделен левый мочеточник ниже подвздошных сосудов и клипирован выше зоны свища. Дренаж из влагалища извлечен через день, больная выписана на амбулаторное лечение. В сентябре повторно госпитализирована в клинику для оперативного лечения – проведения реконструктивной операции. В литотомическом положении в области пупка установлен троакар 11 мм для лапароскопа, два троакара справа для хирурга и один троакар 11 мм слева для ассистента. Сигмовидная кишка мобилизована, отведена медиально. Левый мочеточник идентифицирован в зоне пересечения с подвздошными сосудами, выделен дистальнее до участка клипирования и отсечен. Далее МП мобилизован, фиксирован узловыми швами к малой поясничной мышце. Стенка МП вскрыта на протяжении 1 см. Мочеточник стентирован, экстравезикально имплантирован в МП узловыми швами. Установлен дренаж в область УЦА, троакары извлечены, на раны наложены узловые швы. Перед выпиской выполнена антеградная пиелоуретерография слева: затека контрастного вещества нет (рис. 3). Нефростома удалена, больная выписана на амбулаторное лечение. Стент извлечен через 4 нед. При контрольном обследовании на экскреторной урограмме функция обеих почек своевременная, нарушения уродинамики ВМП нет (рис. 4), на цистограмме ПМР отсутствует (рис. 5). В настоящее время больная находится под динамическим наблюдением, жалоб со стороны мочевыводящих путей нет, вернулась к своей прежней работе.
В представленном клиническом наблюдении, несмотря на предыдущие лапароскопические вмешательства в зоне нижней трети мочеточника, наличие рубцово-спаечного процесса, удалось лапароскопическим доступом выделить мочеточник и имплантировать его в МП.
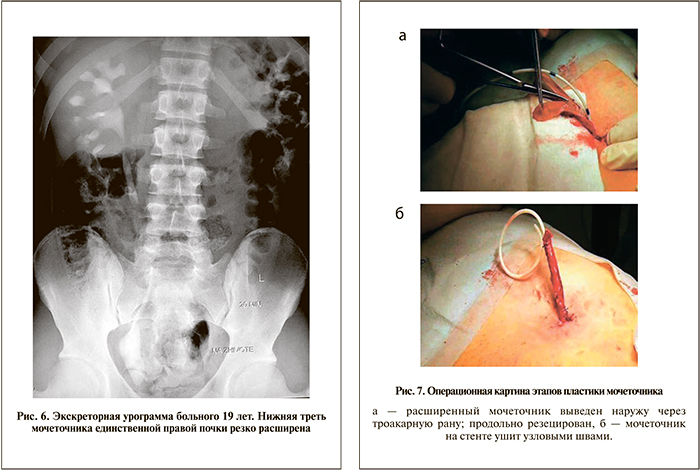
Б о л ь н о й 19 лет госпитализирован в нашу клинику с жалобами на периодические тупые боли в пояснице справа, частые обострения хронического пиелонефрита. Из анамнеза известно, что у больного врожденная единственная правая почка. При обследовании на основании данных экскреторной урографии диагностирована нейромышечная дисплазия тазового отдела мочеточника (рис. 6). При цистоскопии устье правого мочеточника сужено. Было решено выполнить лапароскопическую резекцию нижней трети правого мочеточника с его имплантацией в МП. В литотомическом положении по вышеописанной методике установлено 4 троакара, мобилизована расширенная нижняя треть мочеточника, отсечена от МП. Далее произведена деинсуффляция, через троакарную рану мочеточник выведен наружу. Он продольно резецирован, на стенте ушит непрерывным швом (рис. 7), обратно погружен в брюшную полость. Подобная методика резекции мочеточника и формирования его на стенте, в отличие от интракорпоральной методики, значительно сокращает время операции. Вскрыта полость МП, произведена экстравезикальная имплантация мочеточника узловыми швами. Установлен дренаж, троакары извлечены. Осложнений после операции не было. На 6-е сутки больной выписан на амбулаторное лечение. Через 4 нед стент удален. По данным контрольной экскреторной урографии, функция единственной правой почки своевременная, сохраняется умеренная дилатация ВМП, хотя зона резекции мочеточника не расширена (рис. 8). При цистографии ПМР отсутствует. В настоящее время активных жалоб нет, уровень креатинина в крови 88 мкмоль/л, трудоспособность восстановлена.
 Результаты лапароскопического УЦА у данного пациента, несмотря на умеренное расширение ВМП, можно считать удовлетворительными. Изменений в зоне операции нет, ПМР на цистограмме отсутствует, а сохраняющее расширение можно объяснить нейромышечными изменениями стенки мочеточника.
Результаты лапароскопического УЦА у данного пациента, несмотря на умеренное расширение ВМП, можно считать удовлетворительными. Изменений в зоне операции нет, ПМР на цистограмме отсутствует, а сохраняющее расширение можно объяснить нейромышечными изменениями стенки мочеточника.
Обсуждение. Стриктуры тазового отдела мочеточника в большинстве случаев развиваются после ятрогенных повреждений в гинекологической и хирургической практике, эндоурологических вмешательств на ВМП. Резекция нижней трети мочеточника по поводу опухоли тоже завершается формированием его протяженного дефекта, требующего проведения восстановительной операции [9, 10]. Во всех перечисленных случаях приходится прибегать к реконструктивным вмешательствам на тазовом отделе мочеточника, выполнять прямой УЦА или непрямой УЦА по Боари или рsoas-hitch. В настоящее время активно внедряется УЦА лапароскопическим доступом, имеющим определенные преимущества перед открытой операцией [3, 4, 11–14].
Использование антирефлюксной техники при лапароскопическом УЦА остается одним из дискутабельных моментов этой операции. Некоторые авторы не применяют ее [9, 18, 19], а другие урологи предпочитают УЦА с антирефлюксным механизмом [3, 12, 14, 20]. В клинической практике используются различные варианты интра- и экстравезикального создания субмукозного тоннеля, формирование которого при лапароскопическом доступе имеет технические сложности. Одним из интравезикальных способов служат введение через цистоскоп стерильного физиологического раствора под слизистую МП, препарирование ее от мышечного слоя и формирование тоннеля для проведения мочеточника [20]. Другие авторы предпочитают экстравезикальный способ создания подслизистого тоннеля. Так, P. Modi и соавт. [12, 14] при лапароскопическом УЦА использовали методику Lich-Gregoir для исключения ПМР. Вначале они проводили инцизию детрузора на протяжении 2–3 см, вскрывали слизистую МП и узловыми швами анастомозировали мочеточник с МП. Ушиванием краев рассеченного детрузора над мочеточником формировали субмукозный тоннель длиной 1,5–2,0 см. Подобная экстравезикальная техника более проста и характеризуется низкой частотой осложнений. Противники антирефлюксной методики УЦА утверждают, что после открытого УЦА в 50% случаев наблюдается ПМР [2]. Так, O. Fugita и соавт. [18] выполнили прямой УЦА без создания субмукозного тоннеля, и все пациенты по данным контрольной цистографии имели ПМР I степени. J. Rassweiler и соавт. [3] у 2 из 10 больных после открытого УЦА с субмукозным тоннелем наблюдали ПМР I степени. После лапароскопического УЦА у 6 больных отмечен ПМР при цистографии, однако у всех 4 больных с субмукозным тоннелем ПМР не было.
Мы выполнили лапароскопический экстравезикальный УЦА без субмукозного тоннеля всем 12 больным. Пассивный бессимптомный ПМР наблюдался у 3 из них. Болей в области почки никто из них не отмечал. Однако с учетом собственных данных и результатов других урологов, имеющих опыт лапароскопического УЦА, считаем необходимым формирование субмукозного тоннеля. Дальнейшее накопление опыта подобных операций позволит выполнить лапароскопический УЦА с антирефлюксной методикой и снизить частоту развития ПМР после операции.
Одним из фундаментальных принципов УЦА остается формирование свободного анастомоза без натяжения. При выделении мочеточника желательно сохранить периуретеральную жировую клетчатку, что позволяет избегать ишемии его стенки. Для достаточной мобилизации МП при необходимости можно выделить контралатеральную верхнюю пузырную артерию, что позволит заместить протяженный дефект мочеточника. Меньшая кровопотеря и послеоперационная боль, короткий период госпитализации и выздоровления – очевидные преимущества лапароскопической хирургии мочевых путей. При сравнении результатов открытого и лапароскопического УЦА J. Rassweiler и соавт. [3] установили, что время операции при эндовидеохирургии было достоверно выше, чем при открытом доступе (228 против 187 мин). Однако с накоплением опыта продолжительность операции уменьшилась и последние два лапароскопических УЦА длились около 190 мин, сравнимых со временем, потребовавшимся O. Castilio и соавт. на проведение операции, – около 157 мин [4]. Объем кровопотери (370 против 610 мл) и требуемая доза парентеральных анальгетиков (4,9 против 2,5 мг) при лапароскопии были достоверно меньше. В нашей серии операции были выполнены в среднем за 145 мин (от 110 до 230 мин), объем кровопотери при этом составил 180 мл (от 120 до 245 мл), что сопоставимо с данными, полученными другими исследователями.
В течение последних десятилетий показания к эндовидеохирургическим вмешательствам в урологии расширяются, накапливается опыт лапароскопического лечения различных урологических заболеваний, в том числе и стриктур мочеточника. При выполнении лапароскопического УЦА следует учитывать следующее: каждое клиническое наблюдение представляется сложным случаем, базированным на этиологии, локализации и протяженности стриктуры. Ввиду этих причин операция требует от уролога высокой квалификации в лапароскопической хирургии и должна выполняться только в специальных центрах. Наш опыт и результаты коллег свидетельствуют о том, что наложение УЦА лапароскопическим способом позволяет достигать хороших результатов в тех случаях, когда клиника имеет достаточный опыт в реконструктивной эндовидеохирургии мочевых путей.
Заключение. Лапароскопический УЦА – высокоэффективное вмешательство, позволяющее получать функциональные результаты, сопоставимые с таковыми после открытых операций. Данной операции свойственны такие преимущества, характерные для малоинвазивной хирургии, как меньшая потребность в анальгетиках в послеоперационном периоде, короткие сроки госпитализации и реконвалесценции.



