Инфицированность вирусом папилломы человека (ВПЧ) чрезвычайно высока и напрямую связана с развитием доброкачественных и злокачественных новообразований кожи и слизистых [1]. Впервые ВПЧ был описан в середине 1970-х гг. как причина развития бородавок, причем подчеркивалась тенденция к их спонтанной редукции [1]. Позже была установлена этиологическая роль ВПЧ в развитии рака шейки матки [2, 3].
На сегодняшний день идентифицировано около 200 типов ВПЧ, которые подразделяют на две большие группы: низкого и высокого онкогенного риска. ВПЧ генотипов низкого риска вызывают доброкачественные новообразования (папилломы), имеющие тенденцию к самопроизвольному регрессу, а высокого риска вызывают злокачественную трансформацию и развитие опухоли. Вирус папилломы человека инфицирует базальные слои эпителия, при этом наиболее уязвимым местом считается зона перехода многослойного плоского эпителия в цилиндрический. Возможность поражения аногенитальной области в настоящее время связывают с 34 типами ВПЧ, из них типы 6, 11, 42, 43 и 44 отнесены к типам низкого риска развития рака, а 16, 18, 31, 33, 48 и 56 – высокого [4–7].
В группе низкого риска наиболее распространены ВПЧ-6 и ВПЧ-11 – именно они, как правило, ответственны за развитие аногенитальных папиллом [8]. Наиболее канцерогенными считают ВПЧ-16 и ВПЧ-18 [3, 9]. Около 80% опухолей ануса, 60% вагины, 40% вульвы и пениса индуцируются ВПЧ, преимущественно 16-го типа [10]. Наиболее часто встречающимися канцерогенными типами ВПЧ у ВИЧ-инфицированных были ВПЧ-52 (7,3%), ВПЧ-58 (6,6%), ВПЧ-18 (6,3%), ВПЧ-16 (6%) и ВПЧ-33 (5,3%) [11].
Эпидемические исследования показали, что 60% сексуально активных людей в течение жизни будут хотя бы однажды в жизни инфицированы хотя бы одним типом ВПЧ высокого риска [12]. В большинстве случаев происходит элиминация вируса в течение 1–2 лет, однако у остальных инфицированных вирус продолжает персистировать и в конечном итоге может вызывать рак [13]. Даже среди пациенток с одним половым (единственным) партнером ВПЧ выявляли в трети наблюдений [14–16]; презерватив не обеспечивал должной защиты. Однако инфицирование эпителиальных клеток вирусом не всегда приводит к их раковому перерождению, поскольку является необходимым, но недостаточным условием этого процесса [17]. L. Conley и соавт. [18] изучали риск развития вульвовагинальных и перианальных остроконечных кондилом у ВИЧ-инфицированных женщин. Оказалось, что в группе здоровых добровольцев заболеваемость урогенитальным папилломатозом составила 0,16 случая на 100 тыс. женщин, а среди ВИЧ-инфицированных – 2,6 (р<0,0001) [18].
Вирус папилломы человека изменяет программу репликации клеточной ДНК и обеспечивает воспроизведение собственных ДНК, а как следствие – выработку новых вирионов [19]. В зараженной клетке вирус может существовать в двух формах – эписомальной (вне хромосом клетки), которая считается доброкачественной, и интегрированной, когда ДНК встраивается в хромосому клетки; эта форма определяется как злокачественная [5, 20].
Выделяют следующие формы ВПЧ-инфекции:
- персистенция вируса, когда он существует в эписомальной форме, не вызывая патологических изменений в клетках. На этой стадии заболевание можно выявить только методом ПЦР, клинические проявления отсутствуют;
- папилломавирус существует в эписомальной форме, однако происходит усиленное размножение клеток базального слоя, что ведет к появлению разрастаний, которые клинически определяются как бородавки или папилломы на коже и слизистых;
- дисплазия (неоплазия) – вирус существует в эписомальной и интегрированных формах;
- карцинома – вирус в интегрированной форме ведет к перерождению клеток, наиболее частая локализация – шейка матки, хотя возможна малигнизация в любом участке кожи и слизистой [21–23].
Первые две формы Л. Д. Андосова и соавт. [5] рассматривают как защитную реакцию организма, который пытается локализовать размножение вируса путем создания своеобразного «саркофага» из ороговевающих клеток.
 Вирус папилломы человека у инфицированного человека с хорошим иммунным ответом может быть полностью элиминирован на субклинической стадии [24]. Защита против вирусной инфекции происходит за счет как клеточного, так и гуморального иммунитета. Вирус может проникнуть в организм, например, через микроповреждения кожи.
Вирус папилломы человека у инфицированного человека с хорошим иммунным ответом может быть полностью элиминирован на субклинической стадии [24]. Защита против вирусной инфекции происходит за счет как клеточного, так и гуморального иммунитета. Вирус может проникнуть в организм, например, через микроповреждения кожи.
В этом случае, достигнув базального слоя эпидермиса, вирус внедряется в делящиеся кератиноциты. Первичный воспалительный ответ на повреждение ткани заключается в притоке к очагу поражения нейтрофилов, макрофагов и лимфоцитов. Этот неспецифический первичный иммунный ответ распознает вирион как опасность, после чего происходит усиленная продукция воспалительных цитокинов, интерферона, иммунно-активных клеток, в дальнейшем инициируется адаптивный иммунный ответ. Активированные Т-клетки дифференцируются в цитотоксические Т-лимфоциты, способные секретировать протеолитические энзимы, гранзим и перфорин [25]. Эти клетки мигрируют к очагу воспаления и уничтожают инфицированные ВПЧ клетки.
Гуморальный ответ реализуется посредством выработки специфических антител. Однако гуморальный иммунитет при ВПЧ-инфекции обычно слабый и не защищает от реинфекции и не предотвращает рецидив [26]. Основной механизм защиты ВПЧ – блокировка выработки интерферона, а также нарушение распознавания инфицированных клеток натуральными Т-киллерами [2].
Вирусы, сохранившиеся после первичного иммунного удара, сохраняются в базальном слое клеток в течение неопределенно долгого времени. Стресс, иммуносупрессия, повреждение ткани могут спровоцировать реактивацию инфекции. ВПЧ-инфицирование аногенитальной области вызывает два типа повреждений: папилломы (остроконечные кондиломы) или сквамозное интраэпителиальное поражение (неоплазия). Вирус папилломы человека изменяет структуру эпителия и создает предпосылки к манифестации вирусных, бактериальных, протозойных, грибковых и других инфекций [27].
Наиболее часто диагностируют инфицирование ВПЧ-6 и ВПЧ-11, приводящее к развитию доброкачественных образований кожи или слизистой. Данные типы ВПЧ обусловливают развитие папиллом с характерным патоморфологическим строением. Среди гистологических критериев диагностики данных состояний наиболее типичным считают койлоцитоз с формированием перинуклеарного просветления («гало») и широкой каймой цитоплазмы. Предраковые изменения вульвы и аногенитальной зоны – это дисплазия плоского эпителия, характеризующаяся высокой митотической активностью, нарушением ядерно-цитоплазматического соотношения и утратой дифференцировки верхних слоев эпителия [28].
В первую очередь пациентов беспокоят косметический дефект и психологический дискомфорт [24, 29]. A. Graziottin и соавт. [29] изучали влияние аногенитальных папиллом на психологический статус женщин. У пациенток часто выявляли депрессию, тревожность, агрессивность, но прямой связи с инфицированностью ВПЧ установить не удалось. Авторы полагают, что связь между ВПЧ-инфекцией и вестибуловульводинией и диспареунией опосредованная.
В работе [30] изучена возможная ассоциация экзофитных вульварных папиллом и цервикальной интраэпителиальной неоплазии у здоровых сексуально активных женщин. Были обследованы 74 женщины, которым ранее проводилась лазерная вапоризация по поводу урогенитальных кондилом, и 88 здоровых волонтеров. Атипичные сквамозные клетки с неопределяемой или низкой дифференцировкой были обнаружены в мазке из цервикального канала у 13,5% женщин с симптомной ВПЧ-инфекцией в анамнезе и лишь у 2,3% здоровых женщин [30].
Поскольку специфических препаратов против ВПЧ не существует, лечение направлено или на физическое устранение разрастаний, или на купирование воспаления и стимуляцию иммунного ответа [31]. Криотерапия, химическая деструкция, электро- и лазероабляция демонстрируют хорошие результаты, однако рецидивы развиваются у 20–50% больных [32]. Более того, после операции возможно появление папилломатозных высыпаний на новом месте [33], после агрессивного вмешательства ВПЧ может ингибировать распознавание опухолевых клеток иммунной системой [34]. В 50% случаев ВПЧ-индуцированный рак заканчивается летально [35].
Помимо хирургических методов воздействия широко применяют терапевтические подходы. Препаратов, избирательно действующих на ВПЧ, не существует, поэтому цель терапии – уменьшить воспаление и повысить иммунный ответ [36]. Иммуномодуляторы активируют натуральные киллеры и зрелые цитотоксические Т-лимфоциты (CD8+). Пока вирус находится в эписомальном состоянии, его элиминация достигается за счет активации любого звена иммунитета, как клеточного, так и гуморального, – это один из механизмов самоизлечения.
Среди множества иммуномодуляторов особого внимания заслуживает изопринозин, включенный в европейские стандарты ведения больных папилломавирусной инфекцией. Двойное противовирусное действие препарата заключается в ингибировании фермента дигидроптероатсинтетазы, участвующего в репликации вирусов, и блокировании образования вирусных белков за счет изменения стереохимической структуры рибосом зараженной клетки. Проведя систематический обзор отечественной и мировой литературы по применению иммуномодуляторов в гинекологии, О. А. Мынбаев и соавт. [37] показали, что высокодостоверные результаты получены только в отношении изопринозина и интерферонов, как естественных, так и рекомбинантных.
Меняя сферическую структуру рибосом, изопринозин препятствует переходу вируса на следующую ступень развития. После интеграции вируса в геном клетки возникает интраэпителиальная неоплазия [38]. На этом этапе противовирусное воздействие возможно только при повреждении клетки-мишени с помощью NK-клеток, зрелых цитотоксических Т-лимфоцитов и макрофагов. На стадии умеренной и тяжелой дисплазии одни противовирусные препараты не в состоянии остановить процесс опухолевой трансформации, поэтому эти клетки должны быть разрушены (удалены) хирургическим или химическим способом. Однако адъювантная иммунотерапия способствует лучшему заживлению и существенному снижению частоты рецидивов [38].
Изопринозин относится к иммуномодуляторам с противовирусной активностью – он подавляет репликацию ДНК- и РНК-вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения. Изопринозин также стимулирует неспецифический иммунитет, усиливает продукцию интерлейкинов, повышает синтез антител, стимулирует хемотаксическую и фагоцитарную активность моноцитов и полиморфно-ядерных клеток. Максимальная концентрация достигается через 1 ч после приема 1500 мг. Первый период полувыведения (50 мг) связан с образованием мочевой кислоты; второй период полувыведения составляет 3–5 ч, при этом метаболиты выводятся через почки [39].
Изопринозин – предшественник аденозина, энергетической молекулы, играющей важную роль в белковом и углеводном метаболизме. Предпринимались попытки применять изопринозин как допинг для спортсменов [40].
Показания к применению:
- инфекции, вызванные вирусом простого герпеса 1-го, 2, 3 и 4-го типов: генитальный и лабиальный герпес, герпетический кератит, опоясывающий лишай, ветряная оспа, инфекционный мононуклеоз, вызванный вирусом Эпштейна–Барр;
- цитомегаловирусная инфекция;
- корь тяжелого течения;
- папилломавирусная инфекция: папилломы гортани/голосовых связок, папилломавирусная инфекция гениталий у мужчин и женщин, бородавки;
- контагиозный моллюск.
Противопоказания:
- повышенная чувствительность к компонентам препарата;
- подагра;
- мочекаменная болезнь;
- аритмии;
- хроническая почечная недостаточность;
- детский возраст до 3 лет (масса тела до 15 кг).
Изопринозин назначают взрослым и детям с 3 лет внутрь по 50 мг на 1 кг массы тела, разделенных на 3–4 приема в сутки, после еды. Максимальная суточная доза – 4 г. При папилломавирусной инфекции в качестве монотерапии назначается на 28 дней, как адъювантная терапия – на 14 дней. При комбинированном назначении усиливает действие интерферона α, ацикловира.
Анализ наблюдений за 5650 больными с ВПЧ-ассоциированными заболеваниями показал, что у 22,6% пациентов через 6 мес после заражения произошла спонтанная элиминация возбудителя; монотерапия изопринозином привела к такому эффекту в 54,8% наблюдений, использование в составе комбинированной терапии – в 84,2% [41]. Изопринозин способствует полноценной эпителизации шейки матки, что снижает частоту рецидивов [42]. Стандартный курс лечения изопринозином обеспечивал элиминацию ВПЧ в 76–98% случаев [43–47].
Проведено двойное слепое рандомизированное исследование по оценке эффективности инозина (inosine pranobex) (1000 мг 3 раза в день в течение 6 нед) в лечении симптоматического субклинического папилломатоза вульвы. Пятьдесят шесть женщин были случайным способом распределены в две группы: 22 получали инозин, 24 – плацебо. Через 2 мес лечения у 63,5% пациенток в группе инозина было отмечено значительное улучшение морфологии эпителия вульвы; в группе плацебо таковых было достоверно меньше – всего 16,7%. Субъективно улучшение (уменьшение зуда) отметили 59,1% больных в группе инозина и 37,5% – в группе плацебо. Достигнутые результаты сохранялись в течение 4 мес. Побочные явления в виде покраснения кожи зафиксированы у 4 пациенток – по две в каждой группе [48].
В. Н. Прилепская и соавт. [49] применяли изопринозин при вульводинии, обусловленной инфекционно-воспалительными процессами. Препарат назначали по 50 мг на 1 кг массы тела в сутки в течение 10 дней, 1 курс – 1 раз в месяц, 3 курса на цикл. Эффективность составила 87,5 против 50,0% у больных, получавших только этиотропную терапию.
Хирургическое лечение без адъювантной терапии сопряжено с высоким риском рецидивов [50], что обусловливает целесообразность дополнительного назначения иммуномодуляторов. Изопринозин повышает эффективность деструктивных методов лечения ВПЧ-инфицированных, снижает частоту рецидивов, способствует нормализации морфологической картины экзо-, эндоцервикса [51]. Эффективность комплексной терапии составила 82–96,3% [52, 53].
J. Sellors и соавт. [54] еще в 1994 г. поделились положительным опытом применения инозина пранобекс в отношении больных аногенитальными бородавками и подчеркнули, что семейный врач должен быть ориентирован в проблеме ВПЧ-инфекции и самостоятельно назначать иммуномодулирующую терапию [54].
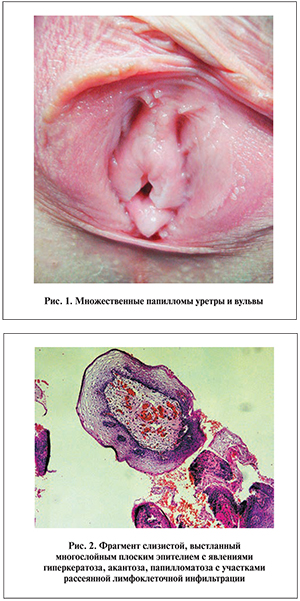
Мы обладаем опытом лечения 26 больных (10 мужчин, 16 женщин) рецидивирующим урогенитальным папилломатозом, в комплексной терапии которых применяли изопринозин. Все на момент включения в исследование имели в анамнезе от 1 до 4 хирургических вмешательств по поводу папиллом, и у всех заболевание рецидивировало в течение 4–8 мес. Пациенты предъявляли жалобы на боль, зуд, физический и психологический дискомфорт, приводящие к нарушению сексуальной жизни. Типичная клиническая картина урогенитального папилломатоза представлена на рис. 1, патоморфологическая – на рис. 2.
Больных подвергли лазерной (22 пациента) или электрохирургической (4 пациента) деструкции папиллом. С первого дня после операции пациенты принимали изопринозин по 1000 мг 3 раза в день в течение 2 нед; заживление прошло быстро – через 7–12 дней наступила полная эпителизация, рецидивов заболевания при максимальном сроке наблюдения 3 года отмечено не было.
У ряда пациентов после хирургического удаления папиллом возникает потребность в проведении местного лечения с использованием кремов imignimod (иммуномодулятор), cidofovir (ингибитор вирусной репликации, индуктор апоптоза), однако частота рецидивов все же может достигать 40% [55]. Крем Aldara вызывал редукцию папиллом у 50% больных с 19%-ной вероятностью рецидива [56]. Использование мази Poliphenon оказалось эффективным для 54% больных [57]. Если предотвратить инфицирование, ВПЧ-ассоциированные раки исчезнут. Поэтому много усилий брошено на создание вакцин (Jardasil Merk, Cervivax JCK), однако данные по их результативности пока противоречивы [58, 59]. Длительное назначение и высокие дозы иммуномодуляторов могут приводить к иммуносупрессивному эффекту. Активность изопринозина снижается на фоне приема иммунодепрессантов [51–53]. Вызывает сомнение обоснованность указанного в инструкции противопоказания – нарушение сердечного ритма, ибо ни в механизме действия, ни в побочных эффектах никаких предпосылок к развитию аритмии не прослеживается, в литературе также нет данных по этому поводу.
В заключение следует отметить, что ВПЧ-инфекция, особенно на ранних стадиях, успешно излечивается вплоть до полной элиминации вируса консервативными или малоинвазивными методами на основе инозина пранобекс (изопринозин) как обладающего двойным действием и имеющего наибольшую доказательную базу. На более поздних стадиях, когда папилломы (остроконечные кондиломы) уже сформированы, иммуномодулирующую терапию целесообразно назначать сразу после хирургического удаления этих образований. Требует уточнения указанное в инструкции противопоказание – аритмии; вероятно, пациенты с определенными видами нарушений сердечного ритма, тем более компенсированными медикаментозно, все же могут получать лечение изопринозином.


