Введение. Значимость проблемы папилломавирусной инфекции (ПВИ) половых органов обусловлена высокой контагиозностью, широкой распространенностью и онкогенным потенциалом ее возбудителя – вируса папилломы человека (ВПЧ). Генитальная ПВИ является одной из самых частых инфекций, передаваемых половым путем. Ежегодно в мире выявляется до 30 млн случаев ПВИ с тенденцией к увеличению этого показателя [1].
В Российской Федерации показатель заболеваемости генитальной ПВИ, составивший в 2008 г. 38,5 случаев на 100 тыс. населения в год, не отражает истинных масштабов распространенности ПВИ. Как правило, ПВИ поражаются люди молодого возраста – максимальная заболеваемость регистрируется в возрасте 18–25 лет. Инфицируются ВПЧ около 80% людей, ведущих половую жизнь; они становятся вирусоносителями или у них развивается клинически выраженная форма инфекции [3]. Генитальная ПВИ служит фактором риска развития рака вульвы, полового члена, анального канала [4].
На сегодняшний день идентифицировано более 200 генотипов ВПЧ, из них около 45 генотипов (6-й, 11, 16, 18, 31, 33, 35, 44, 52-й) могут инфицировать урогенитальный тракт [5, 6]. В настоящее время к вирусам высокого онкогенного риска отнесены 15 генотипов (16-й, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82-й), к вирусам, возможно, высокого онкогенного риска — 3 генотипа (26-й, 53, 66-й) и к вирусам низкого онкогенного риска – 12 генотипов (6-й, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81-й и СР 6 108) [7].
Генитальные кондиломы развиваются на фоне иммунодефицита, вызванного сопутствующей соматической или генитальной патологией, беременностью, применением больших доз или длительных курсов иммуносупрессивных препаратов [8].
Папилломатозные разрастания формируются в роговом слое в локусах максимальной репродукции вируса, поэтому методы лечения, направленные на удаление поверхностного слоя эпидермиса без санации клеток базального слоя, неэффективны и сопровождаются рецидивом заболевания. Согласно существующим принципам ведения больных ПВИ, лечение должно быть направлено либо на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса, либо на стимуляцию противовирусного иммунного ответа, либо на сочетание этих подходов. Существует много методов лечения бородавок и кондилом, но ни один из них не обеспечивает 100%-ную эффективность, поскольку рецидивы заболевания возможны после лечения любым из них [9].
В Европейском руководстве по лечению дерматологических заболеваний представлена следующая классификация методов лечения аногенитальных бородавок [10]:
- Наружные препараты: кератолитики и прижигающие средства, цитотоксические препараты, ингибиторы ДНК; местные ретиноиды.
- Деструктивные методы: электрохирургический, криотерапия, лазеротерапия, хирургическое иссечение, лазерный фототермолиз.
- Противовирусные препараты и модуляторы иммунного ответа: интерфероны, имиквимод, инозин пранобекс (Изопринозин).
- Комбинированные методы: сочетанное применение различных методов.
Целью лечения является удаление генитальных бородавок (в том числе протекающих субклинически), при этом большое значение в предотвращении рецидива и приостановлении процесса канцерогенеза имеет элиминация ВПЧ [11].
В настоящее время эффективность различных методов лечения генитальных бородавок с учетом повторных курсов лечения составляет 60–80% [12]. Повысить эффективность лечения и снизить частоту рецидивов позволяют иммунотропные препараты. Так как ВПЧ сохраняется в эпителиальных клетках, а использование деструктивных и цитотоксических методов не гарантирует отсутствия рецидивов, для их предотвращения предпочтительно применение интерферона или его индукторов, а также других активаторов противовирусного иммунитета в качестве адъювантной терапии в комбинации с различными деструктивными методами. Комбинированная иммунотерапия может применяться при лечении упорных, плохо поддающихся лечению бородавок и кондилом [13].
Одним из немногих иммунотропных препаратов, в инструкции по применению которого указана терапия заболеваний, вызванных ВПЧ, является Изопринозин.
Изопринозин (инозин пранобекс) – иммуномодулятор, стимулирующий противовирусную защиту организма. Механизм противовирусного действия Изопринозина заключается в ингибировании трансляции вирусных белков и фермента дигидроптероатсинтетазы, участвующего в репликации вирусов, а также в усилении подавленного вирусами синтеза мРНК лимфоцитов, что сопровождается повышением продукции эндогенных интерферонов (ИФН) α и γ, обладающих противовирусными свойствами [14]. Такой механизм действия препарата позволяет рассчитывать на достижение не только коррекции иммунологических показателей, но и выраженного непосредственного противовирусного действия, что позволяет добиваться значительного снижения количества случаев рецидивирования клинических проявлений папилломавирусной инфекции по сравнению с деструкцией новообразований как монотерапии [15].
Таким образом, Изопринозин прямо и косвенно способен подавлять репликацию ВПЧ и образование вирусных белков, обладая противовирусным свойством и оказывая влияние на противовирусный иммунитет. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя переходу вируса из транзиторной в персистирующую форму, а также влияя на клиническую манифестацию. При инфекциях, вызванных ВПЧ, Изопринозин назначают по 2 таблетки (1000 мг) 3 раза в сутки в течение 14-28 дней в виде монотерапии. В случае рецидивирующих остроконечных кондилом – по 2 таблетки 3 раза в день в течение 14–28 дней как в виде монотерапии, так и в комбинации с хирургическим лечением, далее с трехкратным повторением курса с интервалами в 1 мес. При добавлении Изопринозина к традиционным методам лечения эффективность терапии повышается с 32 до 94 % [16].
На сегодняшний день наиболее эффективным и безопасным методом лечения генитальных кондилом является их удаление с помощью углекислого, неодимового Nd:YAG и диодного лазера [17]. Лазерная хирургия может быть использована для удаления как единичных, так и множественных генитальных кондилом. Деструкция лазером сопровождается минимальным некрозом новообразований, меньшей частотой рецидивов по сравнению с электрохирургией и криодеструкцией [18, 19]. Использование препарата Изопринозин в сочетании с лазерной аблацией представляет альтернативу только деструктивным методам лечения генитальных кондилом, которые характеризуются высоким процентом рецидива папилломовирусной инфекции.
Цель настоящего исследования: оценить эффективность применения Изопринозина в комбинации с лазерной аблацией генитальных кондилом.
Материалы и методы. В исследование были включены 107 мужчин с генитальной ПВИ и проявлениями в виде остроконечных кондилом в области головки полового члена, внутреннего листка крайней плоти, уретры, мошонки, промежности. Возраст больных варьировался от 20 до 60 лет (средний возраст – 32,6±4,3 года), причем в возрасте от 20 до 30 было 56 (52,3%) человек. Давность заболевания колебалась от 6 до 36 мес. и в среднем составила 18,4±1,2 мес. Всем больным проведено стандартное урологическое обследование, включившее сбор анамнеза, физикальное обследование, лабораторные исследования, в том числе ПЦР-диагностику для исключения инфекций, передаваемых половым путем (Herpes Simplex Virus, Chlamidia trachomatis, Micoplasma genitalium, Trichomonas vaginalis, Ureaplasma urealiticum). Метод ПЦР оказался особенно ценен для диагностики ПВИ, так как с его помощью можно не только установить наличие ДНК ВПЧ при любой форме ПВИ (в том числе при субклинической и латентной), но и идентифицировать тип ВПЧ и, следовательно, дать прогноз развития заболевания. При подозрении на наличие уретральных кондилом больным выполняли уретроскопию.
В зависимости от проведенного лечения больные были разделены на две группы. В лечении больных 1-й группы (n=51) использовали только лазерную абляцию генитальных кондилом. Больным 2-й группы (n=56) проведено комбинированное лечение: лазерную деструкцию сочетали с назначением Изопринозина Больным 2-й группы (n=56) проведено комбинированное лечение: за 10 дней до процедуры лазерной деструкции пациентам назначали Изопринозин 1000 мг 3 раза в сутки, всего 3 курса по 10 дней с интервалом 1 мес.
Для проведения лазерной абляции мы использовали высокоэнергетический лазерный аппарат Лахта–Милон мощностью 16 Вт и с длиной волны 0,81 мкм. Лазерное воздействие в контактном режиме при относительно небольшой мощности вызывает четко ограниченную зону карбонизации, в которой излучение полностью поглощается и вызывает точечное выпаривание. При этом глубина проникновения лазерного излучения незначительная, но хорошо выражен гемостатический эффект.
Период наблюдения за больными составил 9 мес. Контрольные обследования осуществляли через 1, 3, 6 и 9 мес. от начала лечения, а также при возникновении жалоб.
Основным критерием эффективности лечения служило наличие осложнений в послеоперационном периоде и отсутствие кондилом.
Результаты. Все пациенты жили половой жизнью. Большинство (61 [57%]) пациентов имели в анамнезе инфекции, передающиеся половым путем. При появлении первых признаков заболевания к урологу самостоятельно обратились или были направлены только 68 (63,6%) больных. Остальные 39 (36,4%) обратились сами или были направлены к урологу спустя 1–12 мес. (в среднем через 3,4±2,6 мес.) после возникновения первых признаков заболевания, как правило, уже при прогрессировании болезни – увеличении площади поражения или появлении новых очагов.
У 41 (38,3%) больного длительность заболевания составила 6–12 мес., у 51 (47,7%) – 13–24 и у 15 (14%) – 25–36 мес. Двадцать девять (27,1%) пациентов ранее проходили лечение по поводу генитальных папиллом, причем рецидив заболевания возник у них в интервале от 1 до 6 мес. после проведенного лечения. Жалобы на наличие папилломатозных образований в области половых органов предъявили 98 (91,6%) пациентов. У 9 (8,4%) больных предъявляемые жалобы не были специфичными для ПВИ: покраснение на головке полового члена (4 пациента), боль при мочеиспускании и дискомфорт в уретре (8 пациентов), кровянистые выделения из уретры после полового акта (5 пациентов).
У 43 (40,2%) больных папилломатозные высыпания были локализованы на крайней плоти, у 23 (21,5%) – на головке полового члена, у 8 (7,5%) – на уздечке полового члена, у 9 (8,4%) – в области наружного отверстия уретры и ладьевидной ямки, у 12 (11,2%) – на теле полового члена, у 7 (6,5%) – на мошонке, у 5 (4,7%) – в промежности. Более чем в одной зоне папилломы располагались у 15 (14%) мужчин, из них у 9 (8,4%) на крайней плоти и головке полового члена, у 2 (1,9%) на коже полового члена и в промежности и у 4 (3,7%) и на коже полового члена и в области наружного отверстия уретры. Генитальные папилломы имели различную форму (чаще всего напоминали цветную капусту на ножке) и величину. У 18 (19,6%) пациентов генитальные папилломы мы рассматривали как множественные, так как они занимали площадь более 2 см2.
По результатам ПЦР клеточного материала из уретры у 48 (44,9%) больных выявлена ассоциация двух и более типов ВПЧ, у 17 (15,9%) больных – вирус 6-го типа, у 10 (9,3%) – 11-го, у 5 (4,7%) – 16-го, у 9 (8,4%) – 18-го, у 11 (10,3%) – 31-го, у 7 (6,5%) – 33-го.
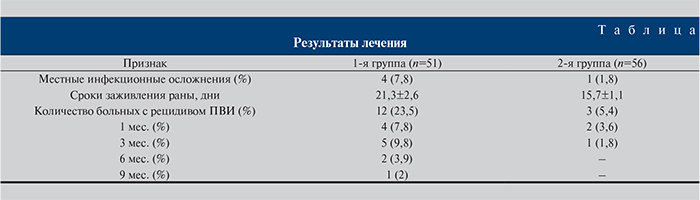
Результаты оценивали по количеству осложнений в послеоперационном периоде и частоте рецидивов заболевания в течение 9 мес. Переносимость комбинированного лечения большинством пациентов оценена как хорошая. Побочные эффекты на фоне приема препарата были отмечены у 3 (2,8%) больных. Они выражались в диспепсических явлениях, отмены препарата не потребовалось ни у одного больного. Местные инфекционные осложнения были зарегистрированы у 4 (7,8%) пациентов 1-й группы и у 1 (1,8%) – 2-й. Ни в одном случае не потребовалось применения системных антибактериальных препаратов; местные воспалительные явления в зоне лазерной деструкции были полностью купированы в течение 3–4 сут. с использованием местных лекарственных препаратов (обработка перекисью водорода, туширование анилиновыми красителями или перманганатом калия, порошок «Банеоцин»). Сроки заживления лазерной раны у больных 1-й группы в среднем составили 21,3±2,6 дня, у пациентов 2-й группы – 15,7±1,1 дня.
Через 9 мес. после проведенного лечения рецидивы генитальных папиллом были выявлены у 12 (23,5%) больных 1-й группы и у 3 (5,4%) пациентов 2-й группы (см. таблицу).
Обсуждение. Удаление только видимых проявлений генитальных кондилом является основным недостатком деструктивных методик, при которых отсутствует воздействие на ВПЧ. Наличие ассоциаций нескольких типов ВПЧ также повышает риск персистенции вирусной инфекции. Поэтому в схему лечения целесообразно включать иммунокорригирующие противовирусные препараты, которые влияют на все звенья патогенеза заболевания.
При анализе результатов данного исследования оказалось, что комбинированное лечение, сочетающее фармакотерапию и лазерную абаяцию, оказало положительное влияние на результаты лечения больных генитальной папилломовирусной инфекцией. У 94,6% пролеченных по данной методике пациентов отсутствовали рецидивы генитальных папиллом в течение 9 мес. наблюдения, тогда как в группе больных после лазерной аблации частота безрецидивных наблюдений составила 76,5%.
Кроме того, использование препарата Изопринозин в лечении мужчин с генитальной папилломовирусной инфекцией способствует снижению риска послеоперационных осложнений и ускорению заживления ран после лазерной аблации.
Комбинированно лечение генитальных кондилом более эффективно и предпочтительнее, чем мототерапия деструктивным методом.


