Введение. В настоящее время наблюдается рост числа хронических инфекционно-воспалительных заболеваний мочеполовой сферы, характеризующихся вялым, рецидивирующим течением и устойчивых к этиотропной терапии. Наиболее частым проявлением инфекции нижних мочевыводящих путей является цистит. Он представляет собой серьезную медицинскую проблему и характеризуется значительной распространенностью. Цистит чаще обусловлен грамотрицательными энтеробактериями, однако возбудителями цистита могут быть и вирусы, а также грибы рода Candida и простейшие [1]. Часто инициирующим моментом в возникновении воспаления мочевого пузыря у женщин являются воспалительные заболевания органов женской половой сферы, в том числе инфекции, передаваемые половым путем (ИППП). Частота рецидивирования цистита после первого эпизода заболевания составляет 50%, у некоторых женщин рецидивы отмечаются более 3 раз в год [2]. R. Ikaheimo и соавт. [3] выявили, что у 36% молодых женщин, инфицированных Е. coli, цистит рецидивирует в течение первого года. Нередко рецидивы обусловлены персистенцией фокуса инфекции, но в подавляющем большинстве случаев объясняются реинфекцией [3]. Под хроническим воспалением понимают процессы, протекающие недели и месяцы, при которых повреждающий фактор, реактивные изменения и рубцевание развиваются одновременно. Традиционно хроническим считается воспалительный процесс длительностью более 60 дней [4]. Диагноз хронического цистита
правомочен при наличии 2 и более эпизодов обострений за 6 мес или 3 и более в течение года. Воспаление принимает хронический характер на фоне органических и функциональных изменений мочевого пузыря, у людей с серьезными сопутствующими заболеваниями, у женщин в постменопаузе, беременных, пациентов с сахарным диабетом, с резистентностью к антибиотикам и более чем у трети больных циститом [5, 6].
В норме слизистая оболочка мочевого тракта содержит антиадгезивные, биостатические, биоцидные факторы, особенно по отношению к Е. coli, благодаря выработке специфических мукополисахаридов и секреторного IgA. Кроме того, моча может содержать специфические и неспецифические ингибиторы роста бактерий, IgG и IgA. Неповрежденный уротелий обладает значительной фагоцитарной активностью. Известно, что при хронических заболеваниях возникает транзиторная дисфункция иммунной системы [7], в то же время в большинстве случаев цистит вторичен, т.е. осложняет течение имеющихся заболеваний мочевого пузыря, уретры, почек, половых органов [8].
Естественно, что устранение причинного фактора (инфекционного агента) и оптимизация нарушений
гомеостаза в организме – путь к выздоровлению. Однако лечение рецидивирующего цистита — чрезвычайно трудная задача, поскольку резистентность возбудителей внебольничных инфекций к антибактериальному лечению продолжает расти. В то же время у пациентов, страдающих хроническими заболеваниями, наблюдается снижение факторов иммунитета, наиболее важные из
которых – интерфероны. Известно, что они участвуют в антимикробной защите, обладают антипролиферативными, иммуномодулирующими свойствами.
В данном клиническом исследовании впервые изучена роль иммуномодулирующего препарата лавомакс (тилорон) (ОАО “Нижфарм”) в стимуляции бактерицидных свойств клеток гуморальной защиты — нейтрофилов. Цель исследования — оценка эффективности иммуномодулирующего лекарственного препарата Лавомакв комплексной терапии обострений хронического цистита.
Материалы и методы. Объектом исследования были 60 женщин в возрасте от 20 до 80 лет (средний возраст – 44,1 года). Длительность заболевания хроническим циститом составила в среднем 4,9 года (от 6 мес до 40 лет). Критерии включения: женщины с установленным диагнозом хронического цистита в стадии обострения и давностью заболевания не менее 6 мес. Включение в исследование было
добровольным, с обеспечением прав и защиты пациентки. На начальном этапе проведено ознакомление с целью и условиями исследования. Все пациентки подписывали информированное согласие на участие в исследовании. Больные были рандомизированы на 2 группы по 30 человек. Оценку однородности групп провели с использованием критерия Манна–Уитни. Группы были сопоставимыми по возрасту, длительности воспалительного процесса.
Женщины основной группы в комплексном лечении хронического рецидивирующего цистита получали лавомакс (таблетки, покрытые оболочкой, содержащие 0,125 г тилорона) по схеме: первые двое суток по 1 таблетке, затем по 1 таблетке через день, на курс — 1,25 г, или 10 таблеток), далее препарат назначали по 1 таблетке 1 раз в неделю в течение 10 нед. На курс профилактического лечения потребовалось 1,25 г препарата. Женщины контрольной группы вместо иммуномодулятора получали плацебо. Общий срок лечения и наблюдения пациенток обеих групп составил 180 дней.
В процессе наблюдения и лечения каждая пациентка осуществила 5 визитов к врачу. План обследования включил сбор анамнеза, жалоб, физикальное обследование, стандартные клинические лабораторные исследования, в том числе анализ мочи по Нечипоренко, бактериологический анализ мочи с определением чувствительности к антибиотикам выделенной микробной флоры и исследование на ИППП, микроскопию мазков, окрашенных по Грамму, из отделяемого влагалища и уретры. Всем определены уровень IgG, IgM, IgA, Т-, В-лимфоцитов, спонтанная активность фагоцитов, иммунорегуляторный индекс. При необходимости для уточнения причины затяжного хронического процесса перед началом лечения выполнена цистоскопия с забором тканей (щипковая биопсия) из подозрительных участков. Дополнительные диагностические исследования – ультразвуковое исследование верхних мочевыводящих путей, органов малого таза, рентгенологическое исследование мочевой системы – проведены при наличии заболеваний верхних мочевыводящих путей в анамнезе.
Пациентки обеих групп получали этиотропную и патогенетическую терапию: антибактериальный препарат фторхинолонового ряда ципрофлоксацин по 500 мг 2 раза в день в течение 10 дней, при необходимости — анальгетики, антидепрессанты, антигистаминные препараты, антихолинэргические средства, спазмолитики. Субпопуляции иммунокомпетентных клеток определены с помощью мембранной иммунофлуоресценции с использованием моноклональных антител (ООО “Сорбент”, Москва). Для определения фагоцитарной активности нейтрофилов использовали НСТ-тест, тест восстановления нитро-синего тетразолия. Определение уровня IgG, IgM, IgA осуществлено методом радиальной иммунодиффузии в агаре по Манчини.
Статистическую обработку полученных данных провели с помощью пакета Microsoft Excel и программы
Statistica 6.0. Различия считали достоверными при уровне значимости р<0,05.
Результаты и обсуждение. В процессе исследования ни одна пациентка из протокола не выбыла. Пятьдесят две (86,6%) пациентки были трудоспособного возраста (до 55 лет). Средний возраст женщин составил 44,1 года, что согласуется с данными литературы о патогенезе развития мочевой инфекции, определяющейся недостатком эстрогенов, а также снижением иммунитета с возрастом [9].
Сопутствующие заболевания желудочно-кишечного тракта были выявлены у 16 (26,6%) женщин, заболевания женских половых органов – у 20 (33,3%), мочевой системы – у 11 (18,3%). Важно, что у 29 (48,3%) женщин диагностирована 3-я степень чистоты влагалища, а у 7 (11,6%) – 4-я. Только у 9 (15%) пациенток не зафиксировано сопутствующих заболеваний. Следовательно, 51 (85%) больная на фоне сопутствующих хронических заболеваний могли иметь снижение/сдвиги иммунных показателей. Назначение им иммуномодулятора было патогенетически обосновано.
У 49 (81,6%) пациенток в моче определялено 7 и более лейкоцитов в поле зрения. У 11 женщин на фоне нормального общего анализа мочи было выявлено превышение нормальных значений лейкоцитов в анализе мочи по Нечипоренко и наличие в бактериологическом анализе мочи микробной флоры в концентрации более 103 КОЕ /мл. В начале исследования в бактериологическом анализе мочи микробная флора в моче была выделена в 54 наблюдениях из 60 в диагностическом титре 103 КОЕ/мл и более (в основной группе – 29 случаев, в контрольной – 25). Чаще всего высевались E. coli – 23 (42,6%) наблюдения, Staphylococcus saprophytiсus – 6 (11,1%) и Staphylococcus epidermidis – 6 (11,1%). На момент окончания базовой терапии иммуномодулятором (25-й день наблюдения) в основной
группе микробная флора была выделена в 20,7% (6/29) случаев, в контрольной — в 48% (12/25), на 100-й день — в 13,8% (4/29) и 32% (8/25) случаев соответственно. На 180-й день наблюдения в каждой группе микробная флора выделена в 3 случаях (рис. 1).
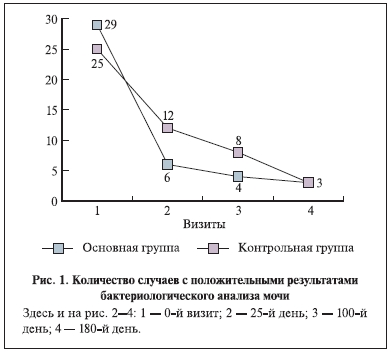
Таким образом, эрадикации микроорганизмов к 100-му дню наблюдения удалось добиться 25 (86,2%) и
17 (68%) пациенткам основной и контрольной групп соответственно. Причем после лечения в контрольной группе в 2 наблюдениях была выявлена микст-инфекция. Одинаковая частота выделения микроорганизмов на 180-й день наблюдения свидетельствует о необходимости повторения профилактических курсов иммуномодулирующей терапии 2 раза в год.
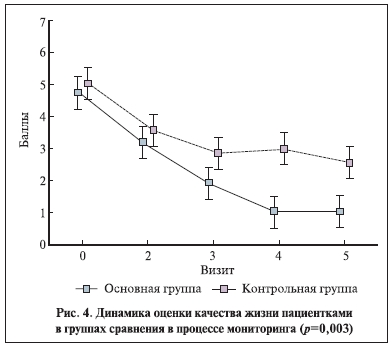
Различия в изменении выраженности симптомов в группах были недостоверными (рис. 2, 3). Оценка пациентками влияния на компоненты качества жизни (степень подверженности мыслям о болезни, изменение интенсивности жалоб в целом, способность мириться с наличием имеющейся клинической картины, быть социально адаптированной) в процессе лечения достоверно различалась (рис. 4). Качество жизни и частота “выраженного” эффекта оказались выше у пациенток, получавших иммуномодулятор (р<0,01, точный тест Фишера).
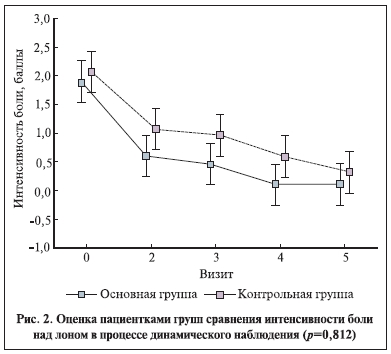
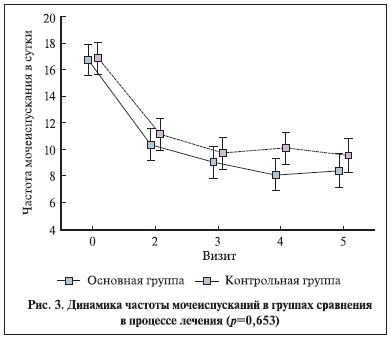
Обращает на себя внимание факт параллельности событий до 3-го визита (25 дней) и увеличение интенсивности жалоб от пациенток контрольной группы к 100-му и 180-му дням на фоне их снижения в основной группе.
Наряду с клинической оценкой изучалось влияние препарата на иммунореактивность. Р.В. Петров (1986), выделяя неспецифические факторы защиты и иммунологическую реактивность организма, подчеркивал особенное положение фагоцитоза и комплемента в этих процессах [7].
Ключевым моментом функционирования адаптивного иммунитета является презентация антигена антигенпрезентирующими клетками, в роли которых в абсолютном большинстве случаев выступают дендритные клетки. Дендритные клетки – это высокоспециализированная субпопуляция клеток, основной функцией которых являются поглощение, процессинг и презентация антигенов в составе главного комплекса гистосовместимости в комбинации с костимулирующими молекулами. В норме для адекватного иммунного ответа необходимо контактное и дистанционное взаимодействие дендритной клетки и Т-хелпера, которое осуществляется группой молекул на мембране клетки. В результате происходит активация Т-хелперов 1-го и 2-го типов и, соответственно, клеточного и гуморального звеньев иммунитета [10]. Известно, что главными эффекторами воспаления являются фагоциты. Нейтрофилы при остром экссудативно-деструктивном течении принимают помощь гуморальных факторов – комплемента и антител, которые усиливают фагоцитарные реакции. Макрофаги же служат эффекторами хронического воспаления с преобладанием пролиферативно-склерозирующего компонента. Причем инфекционный агент способен персистировать внутри макрофага [11]. При выраженном воспалительном процессе количество Т-клеток в организме может уменьшаться.
В нашем исследовании состояние врожденного иммунитета оценивали по реактивности нейтрофилов в тесте нитро-синим тетразолием (НСТ-тест). Как известно, нейтрофил играет центральную роль в организации экссудативно-деструктивного воспаления, являющегося универсальным механизмом освобождения организма от внеклеточных патогенов. Как эффекторная клетка нейтрофил располагает широким спектром протеаз и может генерировать ряд активных форм кислорода (АФК) с высокой биоцидной активностью. НСТ-тест в спонтанном и стимулированном вариантах (НСТсп
и НСТст) дает возможность оценивать как базисную продукцию АФК, коррелирующую с выраженностью воспалительного процесса, так и резерв биоцидности по индексу активации нейтрофилов (ИАН), рассчитанному как отношение показателей НСТст к НСТсп [11, 12].
Исследование показало достаточный исходный уровень биоцидности нейтрофилов в обеих группах. Однако при включении в схему лечения иммуномодулятора стимулированный показатель фагоцитарного резерва (НСТст) в основной группе увеличился до 68 против 60% до лечения, а в контрольной группе динамики показателя не отмечено — он составил 60%.
Индекс активации нейтрофилов после лечения иммуномодулятором увеличился с 4,07 до 4,8, в то время
как в контрольной группе снизился с 4,73 до 3,93, что можно объяснить угнетением активности нейтрофилов в процессе традиционной антибактериальной терапии. В свою очередь функциональная недостаточность фагоцитарного звена лежит в основе хронизации воспалительного процесса.
Изучение воздействия иммуномодулятора на Т-клеточное звено иммунитета показало отсутствие
существенного влияния иммуномодулирующего препарата на общее содержание в крови Т-лимфоцитов (CD3+-клетки), однако субпопуляционный анализ продемонстрировал возрастание иммунорегуляторного индекса (CD4+/CD8+) с 2,11 до 2,35, в то время как в контрольной группе этот показатель не изменился, составив 2,16 и 2,17 до и после лечения соответственно.
С учетом “хелперцентрического” характера функционирования иммунной системы это свидетельствует о благоприятном влиянии лавомакса на иммунореактивность.
Статистический анализ выявил достоверные различия в группах во влиянии на показатели CD4+ и НСТст. Также выявлена достоверная положительная динамика ИАН в основной группе.
Эффекторы гуморального ответа — антитела и Т-лимфоциты – воспринимают разную информацию об антигенах, потому выполняют разные функции в противоинфекционном иммунитете. Антитела иммобилизуют/нейтрализуют свободные антигены, не ассоциированные с молекулами главного комплекса гистосовместимости. Считают, что антитела добиваются элиминирующего эффекта в
содружестве с фагоцитами и комплементом [10]. Известно, что В-лимфоциты — основа обеспечения гуморального иммунитета. Из них образуются плазмоциты, которые вырабатывают защитный белок иммуноглобулин.
Состояние гуморального иммунитета оценивали по содержанию в крови трех основных классов иммуноглобулинов – M, G, A. Анализ уровня иммуноглобулинов до лечения в обеих группах выявил отклонения от нормы в ту или иную сторону у 17 (56,6%) больных основной группы и у 16 (53,3%) – контрольной. После лечения у 19 (63,3%) пациенток контрольной группы отмечена тенденция к увеличению содержания иммуноглобулинов. В контрольной группе имели место разнонаправленные колебания: у 18 (60%) регистрировали увеличение содержание, у 5 (16,6%) – снижение. Однако
статистически достоверных изменений не получено.
Следует учитывать тот факт, что кровь не относят к лимфоидным тканям. В ней циркулирует лишь 1,5–3,0% всех лимфоцитов, имеющихся в организме. Основная масса лимфоцитов сосредоточена в лимфоидных и других тканях. Таким образом, по результатам определения количества лимфоцитов и их субпопуляций в периферической крови лабораторными методами невозможно оценить состояние иммунного статуса [7].
Ведущим фактором успешности терапии обострения цистита является динамика клинической картины заболевания.
Частота неудовлетворительного ответа на терапию к 25-му дню лечения была достоверно выше в контрольной группе: 14 против 5 в основной группе (p=0,01, точный тест Фишера). Частота выраженного эффекта, соответственно, была выше в основной группе (р<0,01, точный тест Фишера). К 180-му дню наблюдения за пациентками выявленные различия в частоте ответа на терапию по группам сохранялись. В основной группе выраженный ответ регистрировали у 19 больных, в контрольной – у 2 (р<0,01, точный тест Фишера).
Клиника обострения цистита в период базового приема иммуномодулятора возникла у 6 (20%) пациенток основной группы и 11 (36,6%) – контрольной. В период профилактического приема иммуномодулятора (10 нед) обострения зафиксированы лишь у 3 (10%) пациенток основной группы, тогда как в контрольной – у 11 (36,6%) (p<0,01, точный тест Фишера). Причем после прекращения приема иммуномодулятора к 180-му дню количество обострений цистита в основной группе возросло до 6 (20%), в контрольной – до 9 (30%), что свидетельствует о необходимости проводить профилактические курсы патогенетического лечения 2 раза в год – весной и осенью, в период максимального риска обострений заболевания.
Выводы
1. Обязательным компонентом лечения хронических циститов с повышенным риском развития нового эпизода заболевания должна быть иммуномодуляция.
2. Включение иммуномодулятора лавомакс в состав комплексной терапии больных хроническим циститом способствует увеличению индекса активации фагоцитарного резерва нейтрофилов.
3. Комплексная терапия больных хроническим рецидивирующим циститом с применением лавомакса позволяет с большей частотой добиваться эрадикации инфекционного агента.
4. Включение иммуномодулятора в схему этиопатогенетического лечения больных хроническим циститом способствует достоверному уменьшению частоты обострений заболевания во время и после терапии.
5. Терапия лавомаксом улучшает качество жизни женщин, больных хроническим циститом.



