Введение. Хронический простатит (ХП) является одним из наиболее распространенных, недостаточно изученных и плохо поддающихся лечению хронических заболеваний [1–3]. Распространенность ХП в мужской популяции, по данным разных авторов, составляет 10–14% [4, 5]. В России ХП страдают до 35% мужчин трудоспособного возраста [6], а в регионах с низкими сезонными температурами заболеваемость достигает 72,2% [7]. Социальная значимость заболевания определяется его высокой распространенностью, негативным влиянием на половую, репродуктивную и психоэмоциональную сферу, что значительно ухудшает качество жизни мужчин.
Согласно современным представлениям, ХП рассматривается как полиэтиологическое заболевание, в возникновении и рецидивировании которого большое значение отводится инфекционным факторам, нарушениям кровообращения в органах малого таза, гормональным сдвигам, иммунным и нейровегетативным нарушениям, климатическим факторам [8–10]. Выделение какого-то одного фактора практически всегда носит условный характер [11].
В настоящее время среди причин, ведущих к развитию ХП, принято различать факторы инфекционной и неинфекционной природы, в связи с чем признается существование бактериального и абактериального простатита [2, 5, 12]. Существует мнение, будто если в XX в. воспалительный процесс в предстательной железе чаще всего был связан с инфекцией, то в XXI в. ее присутствие не всегда является несомненным [13].
За последние десятилетия на рост уровня хронических заболеваний предстательной железы оказывают влияние не только факторы инфекционной природы, но и малоучитываемые ранее факторы физической природы естественного или техногенного происхождения [14]. Среди факторов, оказывающих значимое влияние на биологические процессы в органах и тканях и способных вызывать их патологические изменения, в том числе и на развитие заболеваний мочеполовой системы, выделяют химические токсиканты ввиду ежегодного увеличения техногенного влияния на окружающую среду [15, 16].
В ряде исследований показано негативное воздействие локальной и общей вибрации на репродуктивное здоровье мужчин и морфофункциональное состояние предстательной железы [17, 18]. В то же время поражения предстательной железы и сопутствующие им нарушения репродуктивной функции у работников химического производства до настоящего времени остаются малоизученными.

Материалы и методы. За 2012–2013 гг. в ходе периодического медицинского осмотра работников олеумного завода были обследованы 1085 мужчин в возрасте от 21 года до 72 лет с целью выявления у них заболеваний органов мочеполовой системы. По результатам профосмотра ХП был выявлен у 122 (11,2%) обследованных. Обратило на себя внимание, что среди работников сернокислотного цеха заболеваемость ХП был выше, чем в других цехах, и составил 26,4% (42 из 159 человек). В то время как, например, среди 126 рабочих строительного цеха данный показатель составил 4,7% (n=6), что было в 5,6 раза ниже.
Комплексно обследованы 42 рабочих сернокислотного цеха в возрасте от 23 до 64 лет с первичным диагнозом ХП. Необходимо отметить, что работники данного производства подвергаются эпизодическому воздействию аэрозолей серной кислоты, сернистого газа, повышенной температуры, шума, вибрации. С учетом совокупности всех факторов производственной среды и трудового процесса условия труда у аппаратчиков, слесарей и электромонтеров данного производства квалифицируются как вредные 3-го класса [19].
По результатам проведенного обследования в основную группу включены 30 пациентов с хроническим абактериальным простатитом. Средний возраст пациентов составил 46,2±11,1 (31–64) года, стаж работы во вредных условиях химического производства у них превышал 5 лет.
 В 3 наблюдениях установлен диагноз хронического бактериального простатита.
В 3 наблюдениях установлен диагноз хронического бактериального простатита.
Семь пациентов имели хронический простатит в анамнезе, диагностированный до устройства на работу на химическое предприятие. Это были мужчины сравнительно молодого возраста (23–27 лет) с небольшим стажем работы на предприятии (менее 5 лет).
Из исследования исключены 2 пациента, у которых по данным комплексного клинического обследования и результатам патоморфологического анализа мультифокальных биопсий выявлен рак предстательной железы.
Общеклинические и лабораторные методы исследования. План обследования у всех пациентов предусматривал сбор жалоб и анамнеза, физикальное обследование. Во всех случаях проведено пальцевое ректальное исследование предстательной железы, выполнены лабораторные исследования: общий анализ крови, анализ мочи, 4-стаканная проба по Mеares–Stamey, определение уровня простатспецифического антигена (ПСА) сыворотки крови.
Клиническое состояние пациентов оценивали путем анкетирования с использованием опросников: Международной суммарной оценки симптомов при заболеваниях простаты (I-PSS), Международной шкалы оценки симптомов хронического простатита (NIH-CPSI), Международного индекса эректильной функции (IIEF).
Трансректальное УЗИ (ТРУЗИ) простаты в серошкальном режиме и в режиме цветового допплеровского и энергетического картирования проведено на ультразвуковом сканере Toshiba Aplio XG с конвексным ректальным датчиком 7,5 МГц.
Ввиду того что нормальные показатели кровообращения предстательной железы значительно варьируются [20, 21], в качестве контроля использовали показатели интраорганного кровотока 20 рабочих строительного цеха. Это соматически здоровые мужчины сопоставимого возраста, работающие на предприятии менее 5 лет, в условиях отсутствия профессиональных факторов, характерных для пациентов основной группы.
Методы патоморфологического исследования. Ввиду онконастороженности при наличии асимметрии простаты, уплотнений в предстательной железе, выявлении роста содержания ПСА или определения уровня ПСА в «серой» зоне при наличии информированного согласия пациента выполнена трансректальная мультифокальная биопсия предстательной железы под ультразвуковым контролем с помощью автоматического биопсийного устройства «ИБРА "Уникон"» с эхогенной разметкой. Забор биопсийного материала осуществлен из транзиторной, центральной и периферической области правой и левой долей простаты. Патоморфологическое исследование биоптатов проведено с помощью методов световой и электронной микроскопии. Среды окрашивали гематоксилином и эозином в комбинации с реакцией Персла и по Ван Гизону, ставили ШИК-реакцию.
Статистическая обработка данных выполнена с помощью программы Statistica 6.1. Количественные данные представлены в виде среднего значения и стандартного отклонения (M±m). Для определения статистической значимости различий количественных признаков двух независимых групп использован непараметрический метод и критерий Манна–Уитни. Пороговый уровень статистической значимости (p) принят равным 0,05.
Результаты и обсуждение. По результатам проведенного анкетирования, большая часть пациентов группы исследования со стажем работы во вредных условиях труда более 5 лет отметили наличие болевого синдрома. Согласно данным опросника NIH-CPSI, боли в промежности отмечали 14 (46,7%) мужчин, боли внизу живота – 11 (36,7%). У 3 (10%) пациентов наблюдались боли в мошонке, у 4 (13,3%) – боли в головке полового члена. Боли при мочеиспускании зарегистрированы в 2 (6,7%) наблюдениях, дискомфорт при эякуляции – в 5 (16,7%). Сорок процентов респондентов отметили редкое появление болей, 50% опрошенных на вопрос о частоте появления боли ответили «иногда», 10% – «часто». Средний показатель интенсивности испытываемой пациентами боли по десятибалльной шкале составил 2,46±0,86 (1–5) балла.
Согласно результатам оценки по опроснику NIH-CPSI, у 90% мужчин отмечена маловыраженная симптоматика, у 10 % – умеренно выраженная. Средний балл по данной шкале составил 9,83±4,8 (5–25), что соответствует маловыраженной симптоматике ХП.
 При анализе результатов анкеты IPSS 36,7% (n=11) пациентов нарушений мочеиспускания не отметили, у 63,7% наблюдалась легкая степень нарушения мочеиспускания, обусловленная в основном ирритативными симптомами. Так, чувство неполного опорожнения мочевого пузыря отметили 11 (36,7%) пациентов, 10 (33,3%) указали на ночную поллакиурию до 2 раз. У 8 (26,7%) мужчин наблюдались эпизодические императивные позывы, у 4 (13,3%) – эпизодическое ослабление струи мочи. Два (6,7%) пациента отметили редкие эпизоды необходимости повторного мочеиспускания ранее, чем через 2 ч после предыдущего. Средний балл по шкале I-PSS составил 1,36±1,42 (0–5), что соответствует легкой степени нарушений мочеиспускания.
При анализе результатов анкеты IPSS 36,7% (n=11) пациентов нарушений мочеиспускания не отметили, у 63,7% наблюдалась легкая степень нарушения мочеиспускания, обусловленная в основном ирритативными симптомами. Так, чувство неполного опорожнения мочевого пузыря отметили 11 (36,7%) пациентов, 10 (33,3%) указали на ночную поллакиурию до 2 раз. У 8 (26,7%) мужчин наблюдались эпизодические императивные позывы, у 4 (13,3%) – эпизодическое ослабление струи мочи. Два (6,7%) пациента отметили редкие эпизоды необходимости повторного мочеиспускания ранее, чем через 2 ч после предыдущего. Средний балл по шкале I-PSS составил 1,36±1,42 (0–5), что соответствует легкой степени нарушений мочеиспускания.
Нарушения эректильной функции, согласно данным анкетирования IIEF, отмечены у 63,3% обследованных мужчин и характеризовались в основном легкой (48%) степенью нарушений. У остальных пациентов наблюдались нарушения эректильной функции умеренной выраженности. В 36,7% наблюдений жалобы на эректильную дисфункцию отсутствовали. Средний балл по шкале составил 19,36±3,96 (10–25), что соответствует проявлениям эректильной дисфункции легкой степени.
Таким образом, клиническая картина ХП у пациентов, работающих на химическом производстве, характеризовалась слабовыраженной симптоматикой и стертостью клинических проявлений.
У пациентов с бактериальным простатитом преобладали ирритативные симптомы, отмечено учащенное мочеиспускание, болевой синдром был более выраженным. Имели место сексуальные расстройства в виде преждевременной эякуляции. Проявления эректильной дисфункции пациенты данной группы не отметили.
По результатам 4-стаканной пробы Mеares–Stamey у пациентов со стажем работы во вредных условиях труда более 5 лет в 3-й и 4-й порциях выявлено увеличение количества лейкоцитов в отсутствие роста бактериальной микрофлоры, что соответствовало категории простатита IIIА, согласно классификации Национального института здоровья США (NIH, 1995).
В 3 наблюдениях в 3-й порции исследуемого материала была выявлена бактериальная микрофлора в клинически значимом титре, что указывало на развитие хронического бактериального простатита.
При пальцевом ректальном исследовании предстательной железы у пациентов с длительностью работы во вредных условиях химического производства более 5 лет обращали на себя внимание такие изменения, как асимметрия долей простаты, наличие уплотнений в одной или обеих долях, умеренная болезненность предстательной железы. Данные проявления были наиболее выражены у мужчин со стажем работы во вредных условиях производства более 10 лет.
Для пациентов с бактериальным воспалением предстательной железы были характерны пастозность простаты, ее выраженная болезненность.
У мужчин, имевших ХП в анамнезе и ранее получавших лечение, выраженных изменений предстательной железы при пальцевом ректальном исследовании выявлено не было.
Уровень ПСА варьировался от 0,3 до 3,5 нг/мл.
Результаты УЗИ предстательной железы. При интерпретации данных УЗИ использована «зональная» концепция, модифицированная Rifkin [22, 23], согласно которой выделяют три области простаты: центральную, периферическую и переднюю.
В ходе УЗИ в В-режиме были выявлены следующие характерные изменения. У 16 пациентов отмечено наличие участков повышенной эхогенности, расположенных в центральной области одной из долей. Эти изменения сочетались с относительным увеличением центральной области, средний объем которой составил 3,12±2,4 см3. Реже очаги повышенной эхогенности выявлялись в периферической области. У 9 пациентов гиперэхогенные включения в центральной области не сопровождались увеличением объема этой зоны. У 2 пациентов выявлены ультразвуковые признаки гиперплазии предстательной железы, что проявлялось наличием узлов переходной зоны 17,66±7,3 см3, структурными изменениями в узлах, повышением эхогенности, множественными кальцинатами, формирующими конгломераты.
У 3 пациентов изменений эхоструктуры предстательной железы не было определено.
Что касается пациентов с выявленным бактериальным характером воспаления предстательной железы, то у них имело место диффузное асимметричное снижение эхогенности.
Для мужчин, имевших ХП в анамнезе, было характерно наличие мелких гиперэхогенных включений, расположенных периуретрально в виде единичных кальцинатов.
При ультразвуковой допплерографии сосудов предстательной железы в основной группе обращало на себя внимание статистически значимое снижение скоростных параметров кровотока в артериях капсулярной и уретральной групп артерий по сравнению с аналогичными показателями контрольной группы (см. таблицу). В то же время наблюдалось увеличение индекса резистентности артериальных сосудов у пациентов с ХП по сравнению со здоровыми мужчинами.
Данный факт косвенно указывает на изменения в паренхиме железы, сопровождающиеся повышением периферического сосудистого сопротивления. Это подтверждают результаты УЗИ в В-режиме, выявившие наличие в предстательной железе пациентов основной группы полей повышенной эхогенности, указывающих на развитие склеротического процесса.
С другой стороны, повышение периферического сосудистого сопротивления может быть обусловлено изменениями сосудистой стенки. В пользу этого свидетельствует тот факт, что у 63,3% обследованных мужчин отмечены проявления эректильной дисфункции. Поскольку кровоснабжение полового члена, как и предстательной железы, осуществляется за счет ветвей внутренних подвздошных артерий, это предположение выглядит вполне оправданным.
Необходимо отметить, что за последние годы накапливаются данные о роли дисфункции эндотелия в формировании хронического абактериального простатита [24]. Эндотелиальная дисфункция чаще всего развивается вследствие органических изменений, что также может являться причиной функциональных расстройств.
В работах отечественных авторов показано, что поражения артерий и вен малого таза с высокой частотой сопровождаются как симптомами нижних мочевых путей, так и болевым синдромом [25]. Гипоксия служит одной из патогенетических составляющих болевого синдрома при хроническом абактериальном простатите и также может быть причиной эректильной дисфункции [21].
Немаловажное значение имеет тот факт, что выявленные изменения артериального кровотока простаты зарегистрированы у лиц, работающих в условиях производственной вредности более 5 лет. Данное обстоятельство может указывать на производственный характер патологии. Длительное воздействие комплекса вредных производственных факторов на пациентов основной группы, сочетающееся с патологическими изменениями предстательной железы, приводит к развитию хронического болевого синдрома и функциональных расстройств, в совокупности снижающих качество жизни трудоспособных мужчин.
Патоморфологический анализ биоптатов предстательной железы.
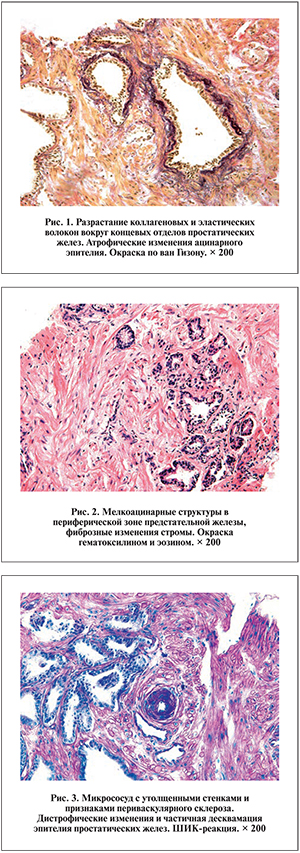
При светомикроскопическом исследовании биоптатов предстательной железы у мужчин с ХП, работающих в сернокислотном цехе, во всех случаях найдены признаки структурной реорганизации железистых и стромальных компонентов, к особенностям которых относится значительное распространение дистрофически атрофических и фиброзных изменений. При этом наблюдался своеобразный полиморфизм строения ткани с чередованием очагов фиброза и очагов простой и мелкоацинарной атрофии (рис. 1, 2), а также участков относительно сохраненной паренхимы, что отражало мультифокальный характер поражения, наиболее выраженного в периферической и транзиторной зонах простаты.
Характерным было наличие множественных конкрементов, кистозной трансформации отдельных ацинусов, что в ряде случаев сопровождалось развитием постатрофической гиперплазии, образованием локусов базальноклеточной гиперплазии и плоскоклеточной метаплазии эпителия. Наблюдались повышенная коллагенизация соединительнотканной стромы, формирование очагов перигландулярного склероза в отсутствие или слабовыраженной воспалительно-клеточной инфильтрации. Изменения микрососудов заключались в редукции их количества, утолщении васкулярных стенок, дистрофических изменениях эндотелия, периваскулярном разрастании коллагеновых волокон (рис. 3).
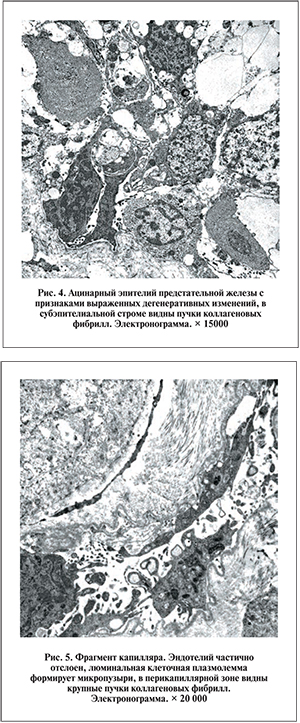
Электронно-микроскопически преобладали дегенеративно-клеточные изменения эпителиальных и стромальных компонентов ткани. Ацинарный эпителий характеризовался неравномерной секрецией, особенно в экзокриноцитах главных желез, что проявлялось уменьшением секреторного компартмента цитоплазмы и дистрофически дегенеративными модификациями клеточных органелл (рис. 4).
В эндотелии капилляров наблюдались элементы дегенерации (рис. 5) и низкий уровень микропиноцитоза, что свидетельствует о нарушении транскапиллярного обмена. Популяция гладкомышечных клеток отличалась гетерогенностью и выраженными дистрофически дегенеративными изменениями ультраструктурных элементов.
Заключение. Анализ результатов проведенного исследования позволяет сделать следующее заключение: ХП у лиц, занятых на химическом производстве, характеризуется стертостью клинических проявлений при наличии ярко выраженных морфологических изменений, легко диагностируемых с помощью таких рутинных методов, как пальцевое ректальное исследование и ТРУЗИ простаты. При этом выраженность изменений прямо кореллирует со стажем работы во вредных условиях.
Комплекс выявленных изменений, характеризующих структурную реорганизацию предстательной железы в условиях долговременного воздействия неблагоприятных факторов химического производ-
ства, имеет принципиальные отличия от морфологических проявлений, наблюдаемых при ХП [26–29]. Доминирование в биоптатах простаты дистрофически дегенеративных изменений, затрагивающих основные клеточные популяции железистого эпителия и соединительнотканных образований, редукция микроциркулярного русла, прогрессирующий фиброз стромы, как правило в отсутствие признаков воспалительной реакции, позволяют определять данное патологическое состояние предстательной железы как простатопатию производственного или смешанного генеза.
Также необходимо отметить, что ряд форм атрофических изменений простаты, в частности постатрофическая гиперплазия и пролиферативная воспалительная атрофия, протекающие с формированием мелкоацинарных структур и/или внутрипротоковой пролиферацией эпителия, некоторые исследователи рассматривают в качестве потенциальных предшественников неопластической трансформации [30–32], что определяет важность изучения данного феномена и требует разработки стандартов диспансеризации для групп работников, находящихся в зоне риска.


