Актуальность. В течение последних 50 лет концентрация сперматозоидов в эякуляте здоровых мужчин, проживающих в технологически развитых странах, постоянно снижалась, при этом в большинстве случаев мужское бесплодие было связано со снижением количества и качества сперматозоидов [1]. В связи с этим часто возникает вопрос о необходимости применения методов лечения, направленных на увеличение количества сперматозоидов в эякуляте, в том числе и гормональной стимулирующей терапии.
В настоящий момент из препаратов для гормональной стимулирующей терапии используются: хорионический гонадотропин (ХГЧ), антиэстрогены, рекомбинантные препараты фолликулостимулирующего гормона (ФСГ), а также их комбинации [2, 3].
Цель: исследование эффективности и безопасности разных видов стимулирующей терапии у пациентов с патоспермией и бесплодием.
Материалы и методы исследования. В проспективное когортное исследование были включены 60 бесплодных мужчин с олигоастенотератозооспермией, сочетавшейся с нормальными или сниженными уровнями лютеинезирующего и фолликулостимулирующего гормонов. Критериями исключения являлись наличие в анамнезе травм или хирургических вмешательств на половых органах, криптозооспермия, азооспермия, любые формы обструктивного бесплодия, гипергонадотропный гипогонадизм, гипотиреоз, гиперпролактинемия, гиперкортицизм, нарушения кариотипа, делеции AZF, опухоли яичек, опухоли гипофиза, варикоцеле, урогенитальные инфекции, воспалительные заболевания половых желез, бактериоспермия, лейкоспермия, носительство антиспермальных антител. Включенные в исследование пациенты были рандомизированы в сопоставимые группы путем стратифицированной рандомизации, табл. 1.

Пациенты первой группы (группа кломифена, n=30) получали кломифена цитрат (Клостилбегит, «Эгис»; Венгрия) 50 мг перорально утром ежедневно. Пациенты второй (группа ХГЧ+ФСГ, n=30) получали комбинированную терапию препаратами Хорионический гонадотропин в индивидуально подобранной дозе, которая составила от 1000 до 3000 ЕД 1 раз в 3 дня внутримышечно и рекомбинантный препарат ФСГ (Гонал-Ф, «Мерк Сероно», Швейцария) в дозе 75 ЕД подкожно через день. Доза ХГЧ определялась путем оценки уровня общего тестостерона утром натощак после инъекции препарата (целевым значением являлось 20–33 нмоль/л).
Первичная эффективность лечения оценивалась через 3 месяца стимулирующей терапии. Под эффективностью терапии понималось наличие зачатия и/или устранение олиготератозооспермии. Пациенты, от которых наступило зачатие на фоне исследуемого лечения, в дальнейшее исследование не включались. Мужчины, от которых зачатие на фоне лечения не наступило, но было достигнуто устранение олиготератозооспермии, продолжили получать назначенную терапию еще 3 месяца с дальнейшей оценкой ее эффективности.
Кроме того, в исследовании оценивалась эффективность комбинированной терапии препаратами ХГЧ в сочетании с ФСГ, аналогичной той, которая применялось во второй группе, у 17 пациентов с первичной неэффективностью кломифена цитрата и монотерапии ХГЧ.
С целью оценки объема яичек проводилось ультразвуковое исследование на аппарате Aloka ProSound SSD-α 10 с использованием линейного датчика с частотой 10 МГц. При лабораторном обследовании состояния половых желез проводилось определение лютеинезирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), общего тестостерона и ингибина В в трех аликвотах сыворотки крови. Уровни ЛГ (норма 2,5–11,0 ЕД/л), ФСГ (норма 1,6–9,7 ЕД/л) и тестостерона (норма 12,0–33,3 нмоль/л) определялись на автоматическом анализаторе «Vitros ECi» (Johnson and Johnson [Великобритания]) методом усиленной хемилюминесценции, а уровни ингибина В (норма – 25–325 пг/мл) методом иммуноферментного анализа с использованием тест-системы DSL (США). Кровь для исследования забиралась в пробирки типа «вакутейнер» в утреннее время натощак из локтевой вены.
Оценка качества эякулята осуществлялась в соответствии с рекомендациями ВОЗ (2010 г.) путем световой микроскопии с помощью микроскопа Olimpus 41 CX (Япония) и камеры Маклера того же производителя. Учитывая, что на параметры спермограммы может влиять множество различных факторов, ее анализировали двухкратно (ориентировались на лучший результат) и оценивались наиболее «стабильные» показатели: количество сперматозоидов в 1 млн эякулята (норма – 15 млн и более), количество морфологически нормальных форм (норма – 4% и более [критерий Крюгера]), подвижность А+В (норма 40% и более). Кроме того, проводилось электронно-микроскопическое исследование эякулята (ЭМИС) путем центрифугирования, этаноловой, далее эпоксидной фиксации клеток эякулята с дальнейшим электронным микроскопированием х16000–18000 для исследования органоидов и х20000–25000 для исследования жгутиков. Оценивались: число интактных головок (норма >4%), содержание сперматозоидов с недостаточно конденсированным хроматином (норма <30%), содержание многоядерных сперматозоидов (норма <5%), содержение сперматозоидов с патологией акросомы (норма <20%), жгутика (норма <30%), деградирорвавших сперматозоидов. Забор эякулятата осуществлялся в стерильные контейнеры путем мастурбации (половое воздержание – 3–5 суток).
Статистическая обработка полученных данных была проведена с использованием пакета прикладных программ STATISTICA (StatSoft Inc. США, версия 8.0). Сравнение по количественным признакам осуществлялось непараметрическим методом с использованием U критерия Манна–Уитни для независимых групп, и теста Вилкоксона – для зависимых групп. Сравнение групп по качественным признакам осуществлялось непараметрическим методом путем анализа таблиц сопряженности с использованием точного критерия Фишера для независимых групп. Статистически значимыми считали различия при p<0,05.
Результаты и обсуждение. При одинаковых исходных данных пациентов проводимая стимулирующая терапия оказывала разный эффект в зависимости от выбранного препарата. Эффективность монотерапии препаратом кломифена представлена в табл. 2.

Терапия кломифеном наряду с увеличением уровня тестостерона, гонадотропинов и ингибина В, приводила не только к статистически значимому увеличению числа сперматозоидов в 1 мл эякулята, но и к статистически значимому улучшению их морфологии. При этом отмечалась тенденция к улучшению подвижности, однако различия не являлись статистически значимыми. Препарат устранил олиготератозооспермию у 73% пациентов (22 человека). Из них от 2 мужчин на 3-м месяце лечения наступило зачатие. Беременность окончилась естественными родами здоровых детей женского пола.
Таким образом, эффективность монотерапии кломифеном через 3 месяца в отношении олиготератозооспермии составила 73% (22 человека) и в отношении наступления зачатия – 7% (2 человека). Оставшиеся 8 пациентов были переведены на комбинированную терапию ХГЧ и рекомбинантным ФСГ. Двадцать человек, от которых не наступило зачатия, но отмечалось устранение олиготератозооспермии, продолжили терапию кломифеном в прежнем режиме и были повторно обследованы еще через 3 месяца, табл. 2.
На фоне продолжающейся еще 3 месяца терапии кломифена цитратом было выявлено дальнейшее статистически значимое увеличение уровней гонадотропинов и ингибина В при тенденции к увеличению уровня тестостерона, что сопровождалось улучшением подвижности сперматозоидов, но статистически значимых различий в отношении концентрации сперматозоидов или их морфологии дополнительно к промежуточной точке исследования (3 месяца) выявлено не было. Тем не менее еще от 4 пациентов на фоне 6 месяцев лечения кломифеном наступило зачатие. Беременности окончились естественными родами здоровых детей (три женского пола, один мужского).
У 13 пациентов зачатия достигнуто не было, но олиготератозооспермия была устранена, из них у 4 мужчин в анамнезе имелись дети. Таким образом, суммарная эффективность терапии кломифеном составила 20% (6 человек) в отношении зачатия и 63% (19 человек) в отношении олиготератозооспермии. Пациентам с устраненной олиготератозооспермией, но не достигшим зачатия, было рекомендовано использование вспомогательных репродуктивных технологий (ВРТ).
Терапия кломифеном являлась безопасной, нами не было выявлено побочных эффектов, однако на фоне продолжающейся терапии кломифеном у 3 пациентов было выявлено ухудшение достигнутых ранее показателей – персистирование олиготератозооспермии. Этим пациентам была рекомендована криоконсервировация эякулята и использование ВРТ.
Исследования других авторов, использовавших антиэстрогены для стимуляции сперматогенеза, были объеденены в мета-анализе, проведенном в 2013 г. [4]. В результате было показано, что использование антиэстрогенов приводило к статистически значимому повышению частоты наступления беременности по сравнению с контрольной группой. При этом отмечалось значительное увеличение концентрации сперматозоидов и их подвижности. Данные изменения сопровождались повышением сывороточных концентраций ФСГ и тестостерона. Не было отмечено существенной разницы в количестве нежелательных эффектов между группами, получавшими терапию антиэстрогенами и группами контроля. Таким образом, как результаты проведенного исследования, так и приведенный мета-анализ свидетельствуют о том, что антиэстрогены в качестве медицинской эмпирической терапии идиопатического мужского бесплодия могут обеспечить наступление спонтанной беременности, увеличить концентрацию сперматозоидов и их подвижность с низким риском несерьезных побочных эффектов. Это подтверждается и отечественными исследователями [5].
Хорошие результаты лечения также отмечались при использовании комбинированной терапии ХГЧ в сочетании с рекомбинантным ФСГ, табл. 3.
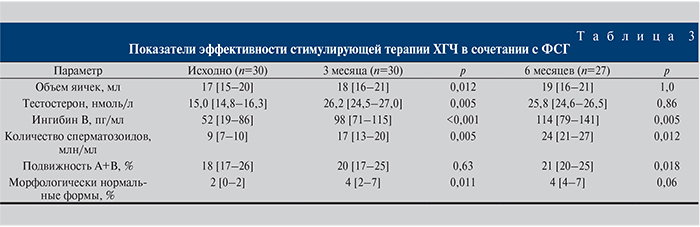
Комбинированная терапия гонадотропинами наряду с увеличением уровня тестостерона и ингибина В приводила как к статистически значимому увеличению числа сперматозоидов в 1 мл эякулята, так и статистически значимому улучшению их морфологии. На подвижность сперматозоидов лечение не повлияло. Препараты устранили олиготератозооспермию у 70% пациентов (21 человек). Из них от 3 мужчин на 3-м месяце лечения наступило зачатие. Беременности окончились естественными родами здоровых детей мужского пола.
Таким образом, эффективность комбинированной терапии через 3 месяца в отношении олиготератозооспермии составила 70% (21 человек) и в отношении наступления зачатия – 10% (3 человека). Пациенты с ненаступившим зачатием продолжили терапию гонадотропинами в прежнем режиме и были повторно обследованы еще через 3 месяца, табл. 3.
На фоне продолжающейся еще 3 месяца комбинированной терапии гонадотропинами у 9 мужчин с отсутствием олиготератозооспермии наступило зачатие, закончившееся рождением здоровых детей (5 женского, 4 – мужского пола), у 6 из этих мужчин в анамнезе имелись дети. Еще у 5 мужчин было отмечено устранение олиготератозооспермии, но зачатия не наступило (у 3 из этих мужчин в анамнезе также имелись дети). У 4 пациентов эффекта от лечения не отмечалось, олиготератозооспермия сохранялась.
Таким образом, суммарная эффективность комбинированной терапии гонадотропинами составила 40% (12 человек) в отношении зачатия и 87% (26 человек) в отношении олиготератозооспермии. Пациентам, не достигшим зачатия, было рекомендовано использование ВРТ. Комбинированная терапия гонадотропинами являлась безопасной, нами не было выявлено побочных эффектов, кроме нерезких тянущих болей в области яичек, на которые жаловались 4 пациента. Боли отмечались в начале лечения, купировались самостоятельно, не требовали отмены терапии и были связаны с увеличением объема яичек.
Другие исследователи, использовавшие терапию гонадотропинами для стимуляции сперматогенеза, также продемонстрировали хорошие результаты [6, 7]. Так, в исследовании М. А. Amirzargar и др. (2012) было показано, что комбинированная терапия препаратами ХГЧ в сочетании с ФСГ приводит к большему числу беременностей – 57%, нежели чем монотерапия ХГЧ – 32% [6]. К подобному выводу пришли и A.A. Sinisi и др. (2010), в исследовании которых было установлено, что использование рекомбинантного ФСГ у пациентов с гипогонадотропным гипогонадизмом, в дополнение к лечению ХГЧ способствует лучшей индукции сперматогенеза по сравнению с монотерапией последним [8]. Это подтверждается и результатами нашего исследования пациентов с первичной неэффективностью кломифена цитрата и монотерапии ХГЧ на фоне лечения комбинацией гонадотропинов, которые представлены в табл. 4.

Комбинированная терапия гонадотропинами, назначенная после использования других препаратов, привела как к статистически значимому увеличению уровня ингибина В, так и числа сперматозоидов в 1 мл эякулята, а также к статистически значимому улучшению их морфологии. На подвижность сперматозоидов лечение не повлияло. Препараты устранили олиготератозооспермию у 65% (11 человек) – у 5 из группы кломифена (62,5% от всех ранее получавших кломифен) и у 6 из группы ХГЧ (67% от всех ранее получавших монотерапию ХГЧ). Из этих пациентов у 3-х мужчин из группы кломифена и 3 из группы ХГЧ в анамнезе имелись дети. При этом от 2 мужчин из группы ХГЧ и от 1 из группы кломифена с устраненной олиготератозооспермией на 5-м и 4-м месяцах лечения, соответственно, наступило зачатие. Беременности окончились естественными родами здоровых детей женского пола. Всем пациентам с ненаступившим зачатием было рекомендовано использование ВРТ. Побочных эффектов при смене стимулирующей терапии не отмечено.
С целью уточнонения аспектов эффективности используемой терапии в отношении ее влияния на сперматогенез проведено сравнение мужчин с достигнутым эффектом от лечения (устранение олиготератозооспермии) и без такового, табл. 5.

Были выявлены статистически значимые различия в наличии детей в анамнезе, объеме яичек, уровне тестостерона, ингибина В и параметрах сперматогенеза. Все эти показатели в группе пациентов с недостигнутым эффектом были существенно хуже таковых в группе с хорошим результатом лечения. Следует отметить, что у пациентов с недостигнутым эффектом в большинстве случаев отмечалась тотальная тератозооспермия. Кроме того, при проведении ЭМИС было установлено, что у пациентов с отсутствием эффекта от стимулирующей терапии исходные показатели числа интактных головок, а также «конденсации» хроматина и патологии жгутиков статистически значимо хуже таковых по сравнению с больными, для которых лечение было эффективным. Полученные нами результаты подтверждаются другими авторами. Так, S. Belloc и соавт. (2014) в своем исследовании, посвященном изучению факторов риска и нарушению сперматогенеза при мужском бесплодии, пришли к выводу о том, что тератозооспермия является одним из наиболее негативных факторов, приводящих к невозможности спонтанного зачатия [9]. С ними согласены C. Krausz и C. Giachini (2007), которые также считают тератозооспермию одним из основных факторов риска мужского бесплодия [10].
Заключение. Проведенное нами исследование продемонстрировало, что все исследованные виды стимулирующей терапии приводят к повышению уровня тестостерона, ингибина В и концентрации сперматозоидов, являясь безопасными и не приводящими к развитию побочных эффектов. В отношении устранения олиготератозооспермии и достижения спонтанного зачатия наиболее эффективна комбинированная терапия гонадотропинами (ХГЧ в сочетании с ФСГ), при этом длительность лечения должна составлять 3–6 месяцев. Эта терапия может быть с успехом использована в случаях неэффективного лечения другими видами стимулирующей терапии.


