Введение. Несмотря на значительные успехи в лечении мочекаменной болезни (МКБ), связанные с широким внедрением дистанционной ударно-волновой и контактной литотрипсии, диагностика метаболических нарушений и метафилактика рецидивов камнеобразования представляют нерешенную задачу [1–3]. Краеугольным камнем всех диагностических мероприятий считается количественное определение состава камня [2–5]. Традиционно используемые титриметрические методы анализа не пригодны для количественной идентификации имеющихся в камне минералогических фаз [3, 4]. В частности, они не позволяют отличать моно- и дигидрат оксалата кальция (КОМ и КОД соответственно), мочевую кислоту (МК) от ее солей или гидратов, инфицированные (струвит, карбонатный апатит) и неинфицированные (брушит, ньюберрит) фосфаты и т.д.
Определение количественного минералогического состава конкрементов методами рентгенофазового анализа (РФА) или ИК-Фурье спектроскопии для множества европейских клиник является уже скорее рутинным [3–5], а его результаты обязательно учитываются при разработке схем диагностики и метафилактического лечения пациентов [3–6]. Однако в России лишь ряд клиник с той или иной степенью успеха проводит подобные исследования, что связано прежде всего со сложностью решаемых задач, а также отсутствием необходимого оборудования и методик.
Проведенные в странах Европы и США клинико-лабораторные и экспериментальные исследования позволяют проследить связь ряда метаболических нарушений с составом и текстурой камней на основе гидратов оксалата кальция [3–12]. В частности, показано, что более чем 80% случаев образования конкрементов на основе КОД (КОД>>КОМ) связаны с гиперкальциурией [9]. Однако, если доля дигидрата в камне оказывается меньше 15 мас. %, то гиперкальциурия уже не является единственной причиной его образования [9]. Интересно отметить, что проведенные нами исследования [12] также указывают на странную взаимосвязь между гиперкальциурией и присутствием больших количеств КОД в смешанных кальций-оксалатных конкрементах [9, 10]. В частности, нам лишь у двух пациентов с подобными камнями удалось наблюдать одновременно гиперкальциурию и гипероксалурию.
В остальных случаях основной причиной образования конкрементов на основе КОД являлись гиперкальциурия и/или гипоцитратурия [12].
Еще одним важным и клинически значимым методом исследования мочевых камней является сканирующая электронная микроскопия (СЭМ).
В частности, относительно недавно было обнаружено, что тяжелое генетическое заболевание гипероксалурия 1-го типа сопровождается образованием камней из КОМ совершенно определенной микроструктуры [7, 8]. На рис. 1 приведены микрофотографии конкрементов, состоящих из моногидрата оксалата кальция. Образец I представляет собой результат медленного образования камня вследствие недостаточного диуреза и незначительной, но постоянной гипероксалурии [7, 8]. Камни подобной структуры встречаются достаточно часто и окрашены в бордовый цвет вследствие адсорбции пигментов и уропротеинов. Напротив, образец II светло-желтого цвета является результатом быстрой кристаллизации при значительном пересыщении мочи. Камни такого типа слабоструктурированы, плохо поддаются разрушающему воздействию ударных волн при проведении дистанционной литотрипсии (ДЛТ) и образуются исключительно при тяжелой гипероксалурии, главным образом гипероксалурии 1-го типа [7, 8]. Вследствие ускоренной интратубулярной кристаллизации у пациентов с такой патологией быстро развивается почечная недостаточность [8]. Таким образом, несмотря на то что образцы I и II на атомно-молекулярном уровне идентичны, супрамолекулярная их организация существенно различается, что позволяет использовать данные СЭМ для быстрого выявления гипероксалурии 1-го типа [7, 8], не прибегая на данном этапе к биопсии печени.
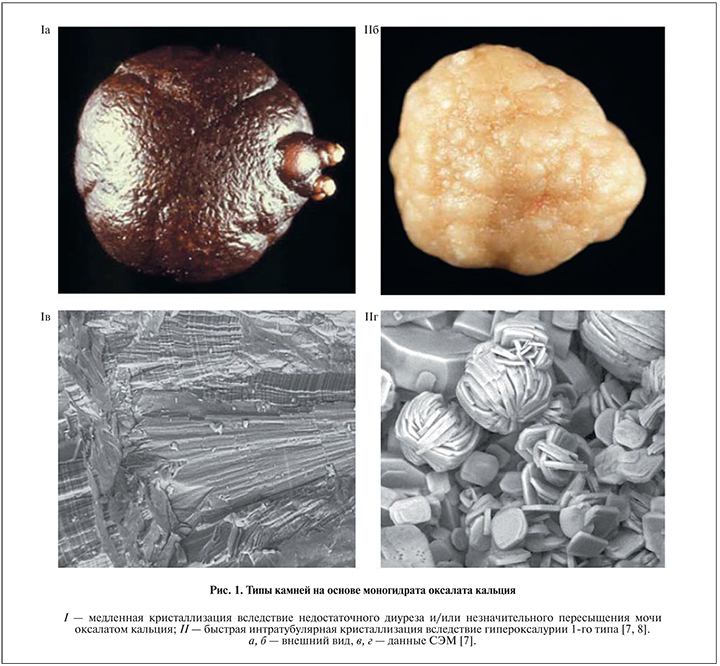
Итак, данные физико-химических методов исследования конкрементов позволяют существенно облегчать работу клиницистам при установлении причин камнеобразования. К сожалению, они еще недостаточно проникли в систему отечественного здравоохранения и информация о минералогическом составе и текстуре поверхности мочевых камней пациентов как центральной части России, так и, в частности, Ивановского региона очень скудна.
Настоящее исследование преследует две цели. Во-первых, разработать методику количественного минералогического анализа камней на основе данных порошковой дифрактометрии и продемонстрировать ее эффективность для установления состава мочевых конкрементов. Во-вторых, исследовать состав и текстуру поверхности камней у пациентов Ивановского региона методами РФА, СЭМ и рентгеноспектрального микроанализа (РСА), показав возможности использования физико-химических методов исследования для диагностики и метафилактического лечения МКБ.
Материалы и методы. Для установления количественного минералогического состава конкрементов был использован метод РФА, позволяющий с высокой точностью определять количественный минералогический состав кристаллических веществ [3, 4].
С целью получения воспроизводимых и достоверных результатов была разработана следующая методика анализа. Образцы удаленных в урологическом отделении ОКБ мочевых камней предварительно промывались дистиллированной водой, тщательно перетирались в агатовой ступке с небольшим количеством 70%-ного этилового спирта и в виде суспензии равномерно наносились тонким слоем на зеркало специальной безотражательной ячейки из монокристалла кремния. Далее ячейка высушивалась в потоке воздуха и закреплялась в гониометре рентгеновского дифрактометра Bruker Advance D 8. Для получения дифрактограмм использовалось либо молибденовое, либо реже медное излучение с длиной волн 0,071 и 0,154 нм соответственно. Ширина щели, шаг сканирования и время накопления импульсов варьировались в зависимости от образца и используемого излучения; продолжительность анализа составляла от 50 (молибден) до 100 (медь) мин.
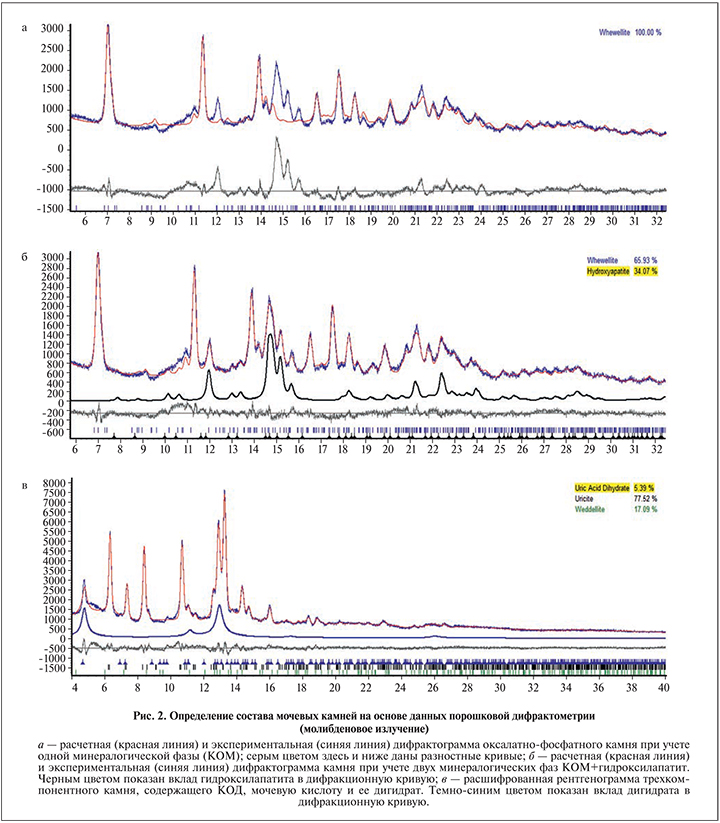
Для определения количественного состава конкрементов использовали итерационную процедуру Ритвельда, минимизирующую отклонения между экспериментальной и рассчитанной рентгенограммами. Данная схема, позволяющая варьировать размер кристаллитов, смещение и толщину образца, а также его текстурированность, была реализована в пакете программ Topas 4 (Bruker). Для расчетов использовали базу данных PDF 2 или Кембриджскую кристаллографическую базу данных.
Структура и состав поверхности мочевых камней были изучены методом электронной микроскопии с помощью растрового электронного микроскопа LEO1455VP (Carl Zeiss), снабженного SiLi-детектором (Röntec) для рентгеноспектрального микроанализа. Исследования проводили как при нормальном падении пучка на поверхность образца, так и при наклоне образца на определенное число градусов. Ускоряющее напряжение составляло 20 кВ, максимально возможное разрешение прибора – до 10 нм. Концентрацию химических элементов на поверхности камня, пропорциональную интенсивности определяемых на опыте рентгеновских квантов, рассчитывали путем сравнения с данными соответствующего эталона.
Результаты. Полученные нами результаты исследования мочевых камней методами РФА, СЭМ и РСА представлены на рис. 2, 3. Всего нами было исследовано более 100 образцов. В качестве примера на рис. 2 приведен пример определения минералогического состава конкремента, состоящего из трех минералогических фаз. Учет одной минералогической фазы (КОМ) не позволяет воспроизвести эксперимент (см. рис. 2, а). Несколько пиков на дифрактограмме остаются не описанными, и величина R-фактора, показывающего отклонение расчетной кривой от экспериментальной, составляет 17. Добавление гидроксилапатита и учет текстурированности КОМ по направлению (101) позволяют добиваться хорошего описания со значением R=6,8. Таким образом, камень содержит две минералогические фазы – КОМ и ГА – с долей последнего 34 мас. %.

Высокое содержание ГА в камне свидетельствует о том, что наряду с исследованиями суточной экскреции с мочой ионов кальция, оксалат-, фосфат- и цитрат-ионов необходим анализ ее суточного рН-профиля с целью исключения почечно-канальциевого ацидоза [6].
На рис. 2, в приведен результат анализа уратно-оксалатного камня, содержащего три минералогические фазы. Как видно, конкремент наряду с МК содержит ощутимое количество ее дигидрата и КОД. Поскольку камни, содержащие дигидрат мочевой кислоты, образуются в очень кислой среде [13], в этом случае также необходим анализ рН-профиля мочи для диагностики мочекислого диатеза как одного из важнейших факторов риска образования уратных камней. Наличие КОД в образце в свою очередь свидетельствует о необходимости определения суточной экскреции ионов кальция и цитрат-ионов [6].
Обсуждение. Результаты проведенных нами исследований минералогического состава мочевых камней у пациентов Ивановского региона в целом согласуются с данными, полученными для стран Западной Европы [3–5, 8]. Более 70% изученных нами камней сложено моно- и дигидратом оксалата кальция или их смесями с различными гидроксилапатитами. В 44% случаев мочевые камни содержали один компонент, в остальных случаях – два, три или четыре. Камни из мочевой кислоты или ее дигидрата оказались достаточно редкими – 12% случаев; камни на основе фосфатов (гидроксил- и карбонатапатит, брушит) наблюдались у 14% пациентов. Ньюберрит, струвит, КОТ и моногидрат мочевой кислоты наблюдались лишь в виде примесей.
На рис. 3 приведены результаты анализа текстуры и состава поверхности различных типов мочевых камней методами СЭМ и РСА. Представленный на рис. 3, а конкремент имеет типичную темно-бордовую окраску и однородную плотную структуру, которая формируется в результате агломерации мелких кристаллитов КОМ, дополнительно скрепленных органическим матриксом. Данный тип камней, достаточно устойчивый к действию ударных волн [8], образуется главным образом вследствие незначительного и длительного пересыщения мочи, а также при нарушении ее оттока вследствие нарушений уродинамики [8].
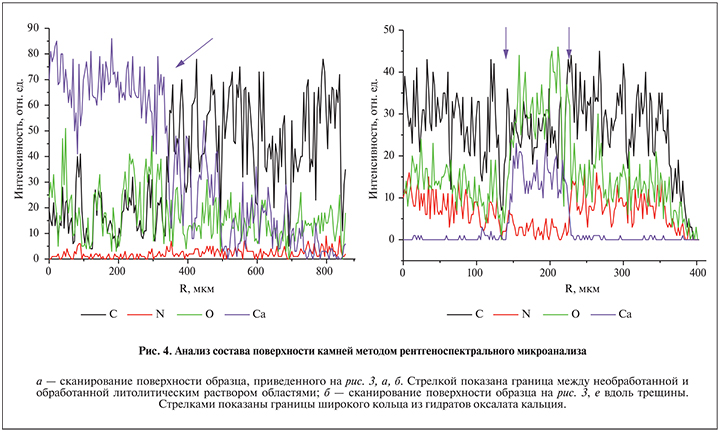
На рис. 3 б показана поверхность того же камня после 4-часовой обработки литолитическим раствором [14], содержащим комплексообразующие агенты – цитрат- и этилендиаминтетраацетат-ионы. Как видно, травление приводит к значительной деминерализации поверхности, связанной с почти полным удалением кальция и образованием небольших каверн (см. рис. 3, 4). При этом с падением концентрации кальция на поверхности образца существенно возрастает содержание азота вследствие увеличения доли органического матрикса, экранирующего камень от действия комплексообразующих агентов (см. рис. 4а), что снижает эффективность хемолиза.
На рис. 3, в приведена микрофотография удаленного хирургическим путем камня из моногидрата оксалата кальция, подвергнутого нами одновременному механохимическому воздействию ударных волн и литолитическим раствором в специальной термостатируемой ячейке, имитирующей условия ДЛТ (Richard Wolf PIEZOLITH 3000, 12 тыс. импульсов, объем зоны фокуса 2439 мм3, положительная плотность потока энергии в фокусе 0,08 мДж/мм2). Как видно из рис. 3, в, после 3 часов хемолиза и 12 тыс. импульсов в камне появились значительные трещины, что в итоге привело к его дефрагментации. Заметим, что одновременное механохимическое воздействие на камень оказалось значительно более эффективным, чем ДЛТ или хемолиз сам по себе, что может иметь большое значение для удаления мочевых камней в клинике.
На рис. 3, г, д представлены участки поверхности оксалатно-фосфатного камня, сложенного ГА (см. рис. 3, г) и гидратами оксалата кальция (см. рис. 3, д) с преобладанием КОД. Подобные камни часто являются результатом гетерогенной кристаллизации и могут формироваться на поверхности апатитовых кальцификатов, когда в кислой моче часть растворенного фосфата промотирует осаждение гидратов оксалата кальция. Адсорбция последних на поверхности депозитов и обеспечивает рост камня.
На рис. 3, е показан разрез весьма редкого камня, у которого ядро и внешняя часть сложены из МК, а внутри имеются кольца из гидратов оксалата кальция, экранирующие ядро. Очевидно, что добиться полного растворения данного камня путем назначения ощелачивающих мочу препаратов возможно лишь разрушив кальций-оксалатную оболочку.
На рис. 4 приведены результаты анализа содержания химических элементов на поверхности двух конкрементов, определенных методом РСА путем сканирования по линии. Эти результаты согласуются с приведенными выше данными. При переходе к поверхности, подвергнутой хемолизу, концентрация кальция (фиолетовая кривая) вследствие деминерализации поверхности резко падает, а доля органического матрикса (черная кривая для углерода) возрастает, и именно поэтому дальнейший хемолиз становится менее эффективным (см. рис. 4, а). В связи с этим использование ферментов, разрушающих матрикс, может существенно повышать эффективность литолитических растворов.
Как видно на рис. 4, б, в области, сложенной мочевой кислотой, основными химическими элементами являются азот, углерод и кислород, что согласуется с данными РФА. В области кольца, наоборот, концентрация азота на поверхности падает почти до нуля, но на ней обнаруживается большое количество кальция и кислорода (фиолетовая и зеленая кривые), указывая на то, что данная область сложена гидратами оксалата кальция.
Заключение. Результаты физико-химических методов исследования конкрементов позволяют во многих случаях не только получать важную информацию о строении камней и особенностях их формирования, но прежде всего заметно облегчать поиск метаболических нарушений, вызвавших их образование, и повышать эффективность хемолиза конкрементов. Особое значение подобные исследования имеют для пациентов с рецидивирующим уролитиазом, в частности, в случае тяжелой гипероксалурии, когда правильная постановка диагноза позволяет своевременно назначать эффективное лечение и избегать множества грозных осложнений МКБ.
Работа поддержана РФФИ (проект 15-44-03016- рег.)



