Введение. РПЖ является четвертым по частоте раковым заболеванием в популяции и вторым – среди мужского населения во всем мире, количество новых случаев РПЖ в 2012 г. составило 15% от числа всех раковых заболеваний у лиц мужского пола [1]. РПЖ – возрастное заболевание; с 2007 по 2011 г. 0,6% заболеваний было выявлено среди пациентов 35–44 лет; 9,7% – 45–54; 32,7% – 55–64; 36,3% – 65–74; 16,8% – 75–84 лет и 3,8% – после 85 лет [2]. Вследствие старения населения во всем мире и усовершенствования методов диагностики заболеваний ПЖ число зарегистрированных случаев РПЖ прогресcивно растет [3], однако проблема ранней диагностики этого заболевания остается актуальной [4].
Эпителиальная ткань ПЖ формируется клетками трех типов: люминальных, базальных и нейроэпителиальных [5]. Люминальные клетки составляют основную массу эпителия ПЖ, они выполняют секреторную функцию, экспрессируют цитокератины (ЦК) 8, 18, рецептор для андрогенов, простатспецифический антиген (ПСА), маркерный белок Nkx3.1 [6]. Клетки базального слоя формируют базальную мембрану, отделяют эпителиальную ткань от подлежащей мезенхимы, продуцируют ЦК5, 14, белок семейства опухолевого супрессора р53–р63 и формируют нишу для тканеспецифических стволовых клеток (СК) [7]. Нейроэндокринные клетки представляют третий и самый малочисленный тип клеток эпителия ПЖ, функция которого не установлена [8].
В ткани простаты при РПЖ доминирует люминальный фенотип, поэтому в начале изучения патогенеза этого заболевания считалось, что мишенью раковой трансформации являются люминальные клетки. В последующем оказалось, что РПЖ рецидивирует после антигормональной терапии, к которой чувствительны люминальные, а не базальные клетки. Первичные культуры трансформированных базальных клеток ПЖ принимают люминальный фенотип [9]. При трансплантации под капсулу почки иммунодефицитных мышей вместе с эмбриональными мезенхимными клетками урогенитального синуса базальные, но не люминальные клетки ПЖ формируют железистые структуры, которые содержат все типы эпителиальных клеток этого органа [10]. При инфицировании сортированных с помощью проточной цитометрии эпителиальных клеток ПЖ лентивирусами, содержащими различные онкогены, только базальные клетки формируют аденокарциномы [11].
В литературе обсуждается точка зрения о патогенетической роли нарушения программы эпителиальной дифференцировки в инициации РПЖ. Более чем в 50% случаев РПЖ идентифицированы рекомбинантные белки TMPRSS2-Ets, которые формируются в результате хромосомной транслокации [12]. Возможно, такие белки вызывают дифференцировку базальных клеток при РПЖ. На моделях трансгенных животных экспрессия рекомбинантных белков, содержащих Ets, вызывает РПЖ и редукцию клеток базального слоя в случае дополнительной продукции факторов Erg и Etv1 [13, 14].
По современным представлениям, возникновение и метастазирование опухоли инициируются небольшой субпопуляцией раковых стволовых клеток (РСК), обладающих, подобно нормальным СК, способностью к самоподдержанию и дифференцировке в разнообразные клеточные типы, составляющие ткань опухоли [15–17]. Раковые СК формируются в результате эпителиально-мезенхимного перехода (ЭМП), в ходе которого поляризованные неподвижные эпителиальные клетки теряют полярность и превращаются в подвижные мезенхимные циркулирующие клетки [18]. Способность к ЭМП наделяет РСК при различных формах рака метастатическими свойствами. ЭМП регулируется специфическими транскрипционными факторами Snail, Zeb, Twist (ТФ-ЭМП), экспрессия которых носит тканеспецифический характер [19]. Эти факторы транскрипционно подавляют экспрессию Е-кадхерина и способствуют продукции мезенхимных факторов полярности.
 Клетки базального слоя имеют более мезенхимный фенотип по сравнению с люминальными клетками, что связано с экспрессией генов, ассоциированных с ЭМП. Например, мкРНК miR-200, которая позитивно регулирует экспрессию Е-кадхерина, продуцируется на более высоком уровне в люминальных по сравнению с базальными клетках. Механизм действия miR-200 связан с уменьшением продукции транскрипционных факторов Zeb1 и Zeb2, тормозящих синтез Е-кадхерина [20]. Возможно, при РПЖ клетки базального слоя приобретают вследствие ЭМП мезенхимный фенотип и покидают железистую ткань, мигрируя в ткань ПЖ.
Клетки базального слоя имеют более мезенхимный фенотип по сравнению с люминальными клетками, что связано с экспрессией генов, ассоциированных с ЭМП. Например, мкРНК miR-200, которая позитивно регулирует экспрессию Е-кадхерина, продуцируется на более высоком уровне в люминальных по сравнению с базальными клетках. Механизм действия miR-200 связан с уменьшением продукции транскрипционных факторов Zeb1 и Zeb2, тормозящих синтез Е-кадхерина [20]. Возможно, при РПЖ клетки базального слоя приобретают вследствие ЭМП мезенхимный фенотип и покидают железистую ткань, мигрируя в ткань ПЖ.
Цель настоящей работы – проследить за судьбой малигнизированных клеток базального слоя эпителия предстательной железы (ПЖ) больных раком предстательной железы (РПЖ) в ходе их дифференцировки в люминальные клетки и/или миграции в мезенхиму.
Материалы и методы. Образцы ткани ПЖ получали от пациентов, подвергшихся радикальной простатэктомии по поводу РПЖ в урологическом отделении 2-й городской клинической больницы Санкт-Петербурга в соответствии с протоколом этического комитета СПбГБУЗ «Городская многопрофильная больница № 2». Пробы, содержащие опухолевый узел или окружающую его нормальную ткань, помещали в пробирки с 5 мл стерильного физиологического раствора, содержащего 50 мг/мл гентамицина. Каждую из двух проб разделяли острыми ножницами на 2 половины, одну из которых фиксировали в 10 мл 4%-ного параформальдегида в фосфатном буфере (pH – 7,4) для последующей гистологической обработки. Вторая проба предназначалась для экстрагирования общеклеточного белка.
Окраска срезов ткани ПЖ гематоксилином и эозином. Пробы ткани толщиной до 5 мм фиксировали в формалине в течение 40–48 ч, в единичных случаях образцы находились в формалине до 2 нед. Фиксированные образцы в случае необходимости рассекали для получения фрагментов толщиной не более 3 мм, которые промывали под проточной водой в течение 30 мин и подвергали гистологической проводке в аппарате Logos J (Milestone, Италия) по протоколу, рекомендованному производителем оборудования для фрагментов ткани толщиной не более 3 мм: 60%-ный этиловый спирт (ЭТ) – 3 мин при комнатной температуре, 95% ЭТ – 2 смены по 2 мин при комнатной температуре, 95% ЭТ – 25 мин при 65°С с применением электрического и микроволнового нагрева, раствор, включивший несколько реагентов для гистологической проводки (изопреп) («ЭргоПродакшн», Россия), – 72 мин при 68°С с применением электрического и микроволнового нагрева, парафин типа 3 («Thermo Scientific», Германия) – 75 мин при 82°С с применением только электрического нагрева. Далее образцы ткани заливали в парафин типа 9 («Thermo Scientific», Германия). С парафиновых блоков с помощью ротационного микротома HM 340E («Thermo Scientific», Германия) получали срезы толщиной 2,5 мкм, которые монтировали на специальных предметных стеклах Superfrost Plus («Thermo Scientific», Германия). Стекла помещали в термостат на ночь при 37°С для оптимальной адгезии срезов. Окрашивание срезов проводили в автоматическом режиме на аппарате Leica ST5020 («Leica Microsystems», Германия) по следующему протоколу: ксилол («Вектон», Россия) – 3 смены по 2 мин, изопреп – 3 смены по 2 мин, проточная вода – 1 мин, дистиллированная вода – 1 мин, гематоксилин Карацци («ЭргоПродакшн», Россия) – 5 мин, проточная вода – 5 мин, дистиллированная вода – 1 мин, 1%-ный водный эозин («ЭргоПродакшн», Россия) – 5 с, проточная вода – 2 мин, изопреп – 2 смены по 1 мин, ксилол – 3 смены по 1 мин. Окрашенные срезы заключали под покровные стекла в аппарате для автоматического заключения Leica CV5030 («Leica Microsystems», Германия), использовав среду Leica CV Mount («Leica Biosystems», Германия).
Иммуногистохимическая окраска тканей, фиксированных в формалине. С парафиновых блоков с помощью ротационного микротома HM 340E («Thermo Scientific», Германия) получали срезы толщиной 2,5 мкм, которые монтировали на предметные стекла с полилизиновым покрытием Polysine slides («Thermo Scientific», Германия). Стекла помещали в термостат на ночь при 37°С для оптимальной адгезии срезов. Для депарафинирования и температурной демаскировки антигенов использовали однократные растворы буферов, разведенные из концентратов Dewax and HIER Buffer (15x) («Thermo Scientific», Германия). Депарафинирование и демаскировку проводили в устройстве PT Module («Thermo Shandon», Германия) по следующей схеме: препараты погружали в предварительно нагретый до 65°С буфер, нагревали до 98°С и поддерживали эту температуру в течение 30 мин, затем остужали буфер с погруженными в него препаратами до 65°С. После этого препараты ополаскивали в дистиллированной воде, обводили срезы гидрофобным карандашом Elite PAP Pen («Diagnostic Biosystems», США) и помещали в однократный раствор трис-буфера (1 x TBS) на 5 мин. Для постановки иммуногистохимической реакции использовали систему UltraVision Quanto Detection System («Thermo Scientific», Германия) в соответствии с инструкцией производителя: UltraVision Hydrogen Peroxide Block – 10 мин, 1xTBS – 2 смены по 5 мин, UltraVision Protien Block – 5 мин, 1xTBS – 2 смены по 5 мин, инкубация с первыми антителами, 1xTBS – 2 смены по 5 мин, Primary Antibody Amplifier Quanto – 10 мин, 1xTBS – 2 смены по 5 мин, HRP Polymer Quanto – 10 мин, 1xTBS – 2 смены по 5 мин, DAB Quanto – 5 мин. Далее препараты ополаскивали в дистиллированной воде и докрашивали ядра гематоксилином в автоматическом режиме на аппарате Leica ST5020 («Leica Microsystems», Германия) по следующему протоколу: гематоксилин Карацци («ЭргоПродакшн», Россия) – 3 мин, проточная вода – 1 мин, 1xTBS (для подсинивания ядер) – 2 мин, проточная вода – 1 мин, изопреп («ЭргоПродакшн», Россия) – 2 смены по 1 мин, ксилол (Вектон, Россия) – 3 смены по 1 мин. Окрашенные препараты заключали под покровные стекла в аппарате для автоматического заключения Leica CV5030 («Leica Microsystems», Германия), использовав заключающую среду Leica CV Mount («Leica Biosystems», Германия). Цитокератин 5 выявляли готовыми к употреблению мышиными моноклональными антителами против цитокератина 5/6 человека («Dako», Дания; кат. № IS780); AMACR – мышиными моноклональными антителами против AMACR человека («Abcam»; кат. № ab63340) в разведении 1:10000; Е-кадхерин – готовыми к употреблению кроличьими моноклональными антителами («Thermo Scientific»; кат. № RM-2100) в разведении 1:60; актин – мышиными моноклональными против β-актина в разведении 1:10000 («Sigma», США, кат. № A5441); в качестве вторых антител использовали Fab-фрагмент козлиных и кроличьих иммуноглобулинов, конъюгированных с пероксидазой хрена, против легких и тяжелых цепей иммуноглобулинов кролика или мыши («Jackson Immunolabs», США).

Электрофорез и иммуноблотинг. Для получения белковых экстрактов образцы ткани массой 10 мг помещали в пробирки со 100 мкл лизирующего буфера, содержащего 1% додецилсульфата натрия (SDS), 50 мМ Трис-HCl (pH 6.8), 100 мМ β-меркаптоэтанола, коктейли ингибиторов протеаз и фосфатаз («Sigma», США); обрабатывали ультразвуком с амплитудой 70% на соникаторе Cole-Parmer 130-Watt Ultrasonic Processor (США) 6 раз по 10 с, инкубировали 20 мин при 0˚С и центрифугировали 15 мин при 13 тыс. g и 4˚С, отбирали супернатант. Концентрацию общего белка в экстрактах определяли при помощи набора реагентов Pierce BCA Protein assay kit («Thermo Scientific», США). Электрофорез белков проводили в 8%-ном полиакриламидном геле, содержащем SDS в камере Mini-PROTEAN Tetra cell («Bio-Rad», США). На дорожку геля наносили 25 мкл экстракта, содержавшего 40 мкг общего белка. После электрофореза белки переносили с геля на мембрану PVDF («Millipore», США) и визуализировали с помощью специфических антител и реактива, усиливавшего хемилюминисценцию (ECL) («Sigma», США).
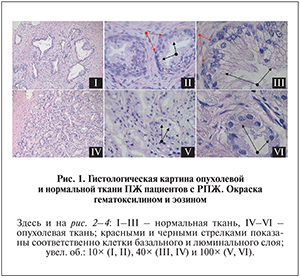
Результаты. Гистологическая характеристика ткани ПЖ пациентов с РПЖ при окраске гематоксилином и эозином. Проведен анализ экспрессии маркеров в материале из опухолевой и окружающей нормальной ткани, полученном от 4 пациентов в возрасте от 59 до 72 лет, уровень ПСА в сыворотке крови которых составлял 8,5–10 нг/мл. Эти пациенты были отобраны по результатам предварительного гистологического скрининга образцов ткани ПЖ от 20 пациентов, подвергшихся радикальной простатэктомии. Образцы ткани ПЖ, взятые из опухоли и окружающей ее нормальной ткани в ходе оперативного вмешательства, подвергали гистологическому анализу после фиксации и окраски гематоксилином и эозином. В случае отсутствия характерных для РП морфологических изменений образцы ткани не использовали для оценки экспрессии функционально различных маркеров.
При малом увеличении в нормальной ткани ПЖ видны альвеолярно-трубчатые эпителиальные железы различных размеров в продольном и поперечном сечениях, разделенные прослойками соединительной ткани различной толщины (рис. 1, I). В опухолевых образцах при малом увеличении обращала на себя внимание гиперплазия железистой ткани, проявлявшаяся в значительном увеличении числа мелких и средних желез с небольшими внутренними просветами и узкими прослойками разделяющей их соединительной ткани (рис. 1, IV). При большем увеличении в нормальной железистой ткани отчетливо выражен базальный слой, состоящий из уплощенных клеток с плотными ядрами, формирующими прерывистую внешнюю окружность железы. Люминальный слой, представленный столбчатыми клетками со светлыми ядрами и четко очерченной цитоплазмой отдельных клеток, формирующих эпителиальный пласт внутри просвета железы, располагался сразу над базальным слоем (рис. 1, II, III). При том же увеличении в опухолевой ткани видна измененная структура эпителиальных желез, базальный слой клеток отсутствовал и в местах его расположения формировались множественные пустоты между мезенхимной и эпителиальной тканью, клетки люминального слоя теряли столбчатую форму, приобретали вакуоли, их ядра становились гиперхромными (рис. 1, V, VI).
 Иммуногистохимическая характеристика ткани ПЖ пациентов с РПЖ при окраске на ЦК5, Е-кадхерин и AMACR. Антитела к ЦК5 окрашивают в нормальной ткани ПЖ цитоплазму и плазматическую мембрану клеток базального слоя сплошной линией, окружающей железу, которая изредка прерывается в местах отсутствия базальных клеток (рис. 2, I, II). Интенсивность окраски на ЦК5 усиливается по всей окружности цитоплазматической мембраны, формируя четкие границы между зонами, которые занимают базальные, люминальные и мезенхимные клетки (рис. 2, II, III). Трансформированные клетки люминального слоя и окружающая мезенхимная ткань не показывали видимых признаков окраски на ЦК5 (рис. 2, IV–VI).
Иммуногистохимическая характеристика ткани ПЖ пациентов с РПЖ при окраске на ЦК5, Е-кадхерин и AMACR. Антитела к ЦК5 окрашивают в нормальной ткани ПЖ цитоплазму и плазматическую мембрану клеток базального слоя сплошной линией, окружающей железу, которая изредка прерывается в местах отсутствия базальных клеток (рис. 2, I, II). Интенсивность окраски на ЦК5 усиливается по всей окружности цитоплазматической мембраны, формируя четкие границы между зонами, которые занимают базальные, люминальные и мезенхимные клетки (рис. 2, II, III). Трансформированные клетки люминального слоя и окружающая мезенхимная ткань не показывали видимых признаков окраски на ЦК5 (рис. 2, IV–VI).
Антитела к Е-кадхерину в нормальной ткани ПЖ наиболее интенсивно окрашивали плазматическую мембрану в области контактов базальных и люминальных клеток (рис. 3, I–III).
Участки плазматических мембран на границах, разделяющих базальный слой и окружающую мезенхиму, а также апикальные поверхности люминальных клеток не окрашивались на Е-кадхерин (рис. 3, II, III). Поверхность опухолевой ткани, окрашенной антителами к Е-кадхерину, значительно возрастала по сравнению с нормальной тканью. В опухолевой ткани на Е-кадхерин окрашивался не только эпителий в железистых структурах, но и многочисленные, небольшие по размерам вновь сформированные скопления из нескольких клеток, расположенных в мезенхиме (рис. 3, IV). Интенсивность и зоны окрашивания мембран увеличивались, в противоположность нормальным клеткам они занимали всю окружность опухолевых клеток, включая как участки, контактирующие с мезенхимой, так и апикальную поверхность люминальных клеток. Секретируемые в просвет канальцев апикальные фрагменты люминальных клеток окружены четко прокрашенной плазматической мембраной, которая в отличие от таковой в нормальных клетках приобретала объемный характер (рис. 3, V,VI).
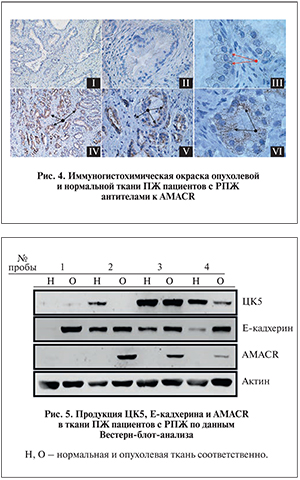
Прилежащая к опухолевой нормальная ткань ПЖ практически не окрашивалась антителами к AMACR (рис. 4, I–III), лишь в некоторых клетках базального слоя выявлялись отдельные гранулы с большей оптической плотностью, свидетельствующие о продукции этого белка (рис. 4, III). В опухолевой ткани антитела к AMACR выявляли этот белок во всех люминальных клетках, а также в многочисленных клеточных кластерах, расположенных в мезенхиме (рис. 4, IV, V). Материал, окрашиваемый антителами к AMACR, выглядел гранулярным и располагался в апикальной части люминальных клеток (рис. 4, VI).
Оценка продукции ЦК5, Е-кадхерина и AMACR в ткани ПЖ пациентов с РПЖ с помощью иммуноблота. Результаты оценки продукции ЦК5, Е-кадхерина и AMACR в нормальной и опухолевой ткани ПЖ пациентов с РПЖ с помощью иммуноблота в целом подтверждали данные иммуногистохимического исследования. Продукция ЦК5 снижена в опухолевой по сравнению с нормальной ткани пациентов 2 и 4, отсутствует у пациента 1 и не отличается у пациента 3 (рис. 5). Продукция Е-кадхерина в малигнизированной ткани ПЖ превышала таковую в контрольной у всех пациентов, продукция AMACR – у трех, но не выявлялась у четвертого пациента (рис. 5).
Обсуждение. В настоящей работе охарактеризована с помощью гистологической, иммуногистохимической окраски и иммуноблота продукция маркеров базального слоя эпителия: ЦК5, AMACR и Е-кадхерина, в нормальной и опухолевой ткани ПЖ пациентов с РПЖ. Показано, что клетки базального слоя эпителия ПЖ служат мишенью раковой трансформации и их последующая судьба лежит в основе патогенеза РПЖ [21, 22]. С этой точки зрения слежение за продукцией ЦК5, AMACR и Е-кадхерина в различных компартментах ткани ПЖ при РПЖ может пролить свет на механизм развития этого заболевания.
Цитокератин 5 является белком промежуточных филаментов, экспрессирующимся в эпителии базального слоя, в котором располагаются тканеспецифические СК различных органов: кожи, молочной железы, мочевого пузыря, простаты. Продукция ЦК5 супрессируется по мере клеточной дифференцировки и не выявляется на следующем этапе специализации родоначальных клеток [23]. В ткани ПЖ ЦК5 определяется в базальных, но не в других типах эпителиальных клеток, поэтому потеря этого белка используется в качестве индикатора РПЖ [24]. Результаты нашей работы показывают присутствие ЦК5 в базальном слое эпителия нормальной ткани ПЖ пациентов с РПЖ и его полное отсутствие вместе с потерей клеток базального слоя в малигнизированной ткани ПЖ таких пациентов.
Е-кадхерин является опухолевым супрессором и у человека кодируется геном CDH1 [25]. Е-кадхерин располагается в контактных соединениях плазматической мембран и опосредует межклеточную адгезию, играя ключевую роль в формировании слоя связанных между собой неподвижных эпителиальных клеток. Структура Е-кадхерина включает внеклеточный домен, формирующий гомодимеры с внеклеточными кадхериновыми доменами соседних эпителиальных клеток, трансмембранную область и цитоплазматический домен, опосредующий взаимодействие Е-кадхерина с внутриклеточным цитоскелетом. При злокачественной трансформации происходит снижение продукции Е-кадхерина, в котором важную роль играют ТФ-ЭМП, взаимодействующие с промотором CDH1 и подавляющие его экспрессию [26]. При раке поджелудочной железы и толстого кишечника ТФ-ЕМП Snail1 2 взаимодействуют с промотором CDH1, физически связывают белки Ezh2 и Suz12, входящие в состав супрессорного комплекса PRC2, и опосредуют триметилирование сайта Н3К27, способствуя транскрипционной супрессии синтеза Е-кадхерина [27].
Транскрипционная супрессия Е-кадхерина при ПРЖ часто является следствием прямого гиперметилирования его промотора [28]. При потере Е-кадхерина эпителиальные клетки приобретают подвижность, что связано с их способностью к инвазии и метастазированию [29]. Повышенный уровень Ezh2 и снижение экспрессии CDH1 были выявлены при РПЖ [30]. Стоит отметить, что механизм регуляции уровня Е-кадхерина путем метилирования промоутора его гена существует уже в эмбриогенезе и используется клеткой для регуляции роста ПЖ. При снижении уровня Е-кадхерина происходит увеличение подвижности эпителия и рост протоков, но эпителиальные структуры не теряют специфический характер строения [31].
Гистологическая и иммуногистохимическая оценка ЦК5 выявляет его присутствие в базальных клетках эпителия нормальной ткани ПЖ и полную потерю в раковой ткани вместе с клетками базального слоя. Результаты нашей работы показывают, что в нормальной ткани ПЖ Е-кадхерин преимущественно выявляется в участках плазматической мембраны, формирующей контакты между базальными и люминальными клетками и между боковыми поверхностями люминальных клеток. Е-кадхерин отсутствует на поверхности базальных клеток, контактирующих с мезенхимой, и на апикальной поверхности люминальных клеток. В опухолевой ткани ПЖ Е-кадхерин определяется по всей длине плазматической мембраны люминальных клеток, включая фрагменты мембран, окружающих безъядерные участки цитоплазмы люминальных клеток, секретируемых в просвет канальцев. Е-кадхерин выявляется в трансформированной ткани и многочисленных клеточных кластерах, расположенных в мезенхиме ПЖ и состоящих из немногих клеток. Вероятно, в нормальных клетках продукция Е-кадхерина супрессируется в условиях отсутствия межклеточных контактов, например на базальной поверхности клеток базального слоя и апикальной поверхности люминальных клеток эпителия ПЖ. В трансформированных клетках механизм супрессии теряется и Е-кадхерин экспрессируется по всей поверхности люминальных клеток. Появление Е-кадхеринположительных клеток в мезенхиме ПЖ пациентов с РПЖ может быть связано с миграцией трансформированных эпителиальных клеток, которые приобретают подвижность. Повышение продукции Е-кадхерина в цитоплазматической мембране люминальных клеток может сочетаться со снижением общего уровня его экспрессии за счет потери клеток базального слоя, которые продуцируют такой белок в нормальных условиях [32]. Существующие противоречия между повышением уровня Е-кадхерина при РПЖ и ожидаемым его снижением при ЭМП, возможно, связаны с особенностями тканеспецифической регуляции продукции этого белка в ПЖ, в частности с повышенным уровнем его продукции в люминальных клетках [20], количество которых при РПЖ возрастает.
AMACR обнаруживается во фракции базальных клеток эпителия ПЖ [33], которые рассматриваются как СК ПЖ. При РПЖ продукция AMACR значительно увеличивается и этот белок выявляется во множестве трансформированных люминальных клеток [34]. AMACR катализирует обратимый переход (2R)-метилацил-СоА и (2S)-метилацил-СоА [35, 36], предшествующий β-окислению жирных кислот и синтезу желчных кислот [37, 38]. В ткани опухолей повышен обмен жирных кислот, что сопряжено с повышением продукция AMACR, который обеспечивает раковым клеткам уникальные энергетические преимущества для роста в условиях активной пролиферации [39, 40]. Результаты настоящей работы показывают, что AMACR экспрессируется на низком уровне в единичных клетках базального слоя эпителия нормальной ткани. В опухолевой ткани ПЖ AMACR, напротив, обнаруживается в цитоплазме большинства трансформированных люминальных клеток и, подобно Е-кадхерину, – в многочисленных клетках в мезенхиме, которые, возможно, мигрируют в стромальный компартмент из эпителия.
Заключение. Полученные в ходе настоящего исследования данные дают основание предполагать, что в патогенезе РПЖ дифференцировка трансформированных клеток базального слоя эпителия может сочетаться с их миграцией в мезенхиму в результате предшествовавшего ЭМП. Уровень Е-кадхерина, выявленный в секретируемых люминальных клетках в раковой ткани пациентов с РПЖ, повышен по сравнению с таковым в нормальной ткани ПЖ, что, вероятно, может приводить к его возрастанию в моче и крови пациентов с РПЖ и служить диагностическим индикатором этого заболевания. В некоторых случаях нами выявлено несоответствие иммуногистохимических и иммуноблотинговых данных, например отсутствие ЦК5 в нормальной и AMACR в опухолевой тканях пациента 1, равный уровень ЦК5 в нормальной и опухолевой тканях пациента 3 в иммуноблоте. По нашему мнению, эти противоречия являются следствием присутствия в опухолевой ткани ПЖ участков нормального эпителия, а в нормальной ткани ПЖ – трансформированных клеток. В целом полученные нами результаты показывают, что патогенез РПЖ связан с изменением судьбы эпителиальных клеток и уровня экспрессии их маркеров, оценка которых может быть использована для изучения механизмов заболевания и поиска новых подходов к его диагностике и терапии.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 16-04-00251), которая обеспечила проведение электрофореза и иммуноблота, и Российского научного фонда (проект 14-50-00068), финансовая поддержка которого дала возможность провести гистологический и иммуногистохимический анализы ткани ПЖ.


