Введение. Одним из направлений развития малоинвазивных хирургических технологий у детей и подростков является разработка везикоскопического (трансвезикального пневмоэндоскопического) доступа (ВД) при лечении аномалий и заболеваний пузырно-мочеточникового соустья и мочевого пузыря.
Впервые ВД в 1995 г. описали японские исследователи K. Okamura и соавт. [1], опубликовав данные о 12 пациентах, которым в течение 1992–1994 гг. выполняли тригонопластику. В 2001 г. I. Gill и соавт. [2] сообщили о 2 пациентах 10 и 11 лет с односторонним пузырно-мочеточниковым рефлюксом (ПМР), которым была выполнена реимплантация мочеточников по Коэну ВД с заполнением мочевого пузыря глицерином. В 2005 г. C. Yeung и соавт. [3] впервые предложили для заполнения мочевого пузыря вместо глицерина использовать углекислый, газ как в традиционной лапароскопии.
Накопленный за последние годы опыт выполнения оперативных вмешательств на мочевом пузыре с использованием ВД демонстрирует его эффективность на уровне 93% [1–16], что по существу равноценно результатам традиционной открытой хирургии – 92–98% [17, 18], и выше уровня успеха эндоскопического лечения ПМР – 85% после одно- и двукратного введения импланта [19].
Однако, несмотря на достаточно высокую эффективность, технология так и не получила широкого распространения. Среди факторов, ограничивающих использование ВД, основными, с нашей точки зрения, являются альтернативные малоинвазивные технологии эндоскопического лечения, а также ранний возраст пациентов, когда чаще всего формируется задача хирургической коррекции. По данным литературы, средний возраст пациентов, в отношении которых использовали ВД для коррекции уретеровезикального сегмента (УВС) и мочевого пузыря, составил чуть более 10 лет [1–16, 19–22]. В последнее время стали появляться сообщения об использовании ВД в отношении пациентов первого года жизни [7, 8, 20], однако пока рано говорить о тенденции к использованию ВД в отношении детей младшего возраста.
 Существующие ограничения на пути применения ВД определяют необходимость изучения его возможностей в хирургии различных патологических состояний мочевого пузыря и УВС, особенностей хирургической техники и течения раннего послеоперационного периода при использовании в детской урологической практике.
Существующие ограничения на пути применения ВД определяют необходимость изучения его возможностей в хирургии различных патологических состояний мочевого пузыря и УВС, особенностей хирургической техники и течения раннего послеоперационного периода при использовании в детской урологической практике.
Материалы и методы. С апреля 2013 по июль 2017 г. с использованием ВД одним из нас (Пироговым А.В.) оперированы 157 пациентов в возрасте от 2 мес. до 18 лет (средний возраст – 4,9±8,7 года), из них 79 девочек и 78 мальчиков (табл. 1).
Показания к операции были идентичными тем, при которых используется цистотомический доступ (табл. 2).
Односторонняя везикоскопическая уретероцистонеоимплантация выполнена 110 (70%) пациентам, двусторонняя – 44 (28%). Всего имплантировано 198 мочеточников. Трем (1,9%) детям произведено везикоскопическое иссечение дивертикула мочевого пузыря.

Уретероцистонеоимплантация по Коэну осуществлена 151 (96,1%) пациенту, по Гленну–Андерсону – 2 (1,3%), по Чумакову – 1 (0,6%).
Техника операции. Положение пациента на спине с разведенными в стороны ногами и подложенным под ягодицы валиком с целью создания наклона таким образом, чтобы промежность была ротирована кверху и максимально приближена к горизонтальному положению. Под контролем цистоскопа и на фоне тугого наполнения мочевого пузыря стерильной водой осуществляют временную фиксацию мочевого пузыря к передней брюшной стенке. У ребенка младшего возраста и при слабо выраженной подкожно-жировой клетчатке используют крупную колющую или режущую иглу с 0/0, 2/0 или 3/0 нитью (рис. 1, а). Пациентам более старшего возраста и при выраженном подкожно-жировом слое фиксацию выполняют путем проведения через пункционную иглу в просвет пузыря фиксирующей нити, пузырный конец которой выводят на переднюю брюшную стенку с помощью лигатурной петли, которую вводят в просвет пузыря через дополнительный прокол кожи (рис. 2, б).

Через переднюю брюшную стенку в мочевой пузырь вводят три троакара (рис. 2, а). Первый (5 мм), для оптики, – на середине расстояния между пупком и лоном, два манипуляционных (3 мм) – симметрично в правой и левой подвздошно-паховых областях с таким расчетом, чтобы ось сформированного впоследствии подслизистого тоннеля максимально совпадала с таковой введенных манипуляторов (рис. 2, б).
Жидкость в мочевом пузыре заменяют на углекислый газ, поддерживая его давление во время операции на уровне 10–12 мм рт.ст. В соответствующие троакары вводят лапароскоп и манипуляторы, накладывают шов-держалку на слизистую в зоне устья мочеточника и начинают выделение мочеточника с помощью крючка электрокоагуляции (рис. 3, а). Затем формируют подслизистый тоннель (рис. 3, б).

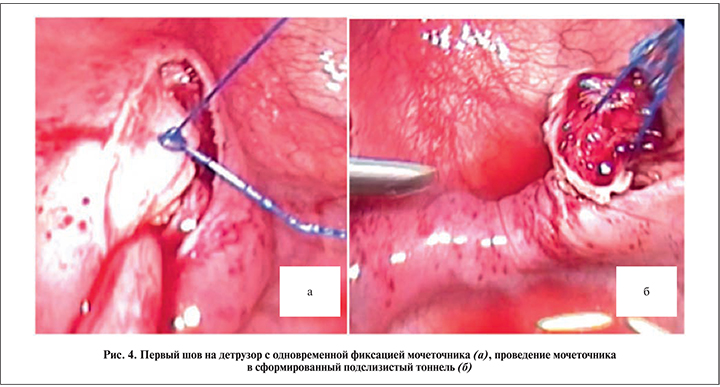
Налагают скользящий экстракорпоральный шов рассасывающейся мононитью (4/0, 5/0) на детрузор с захватом и фиксацией мочеточника (рис. 4, а). Ушивают детрузор в зоне выделения мочеточника. Мочеточник проводят в сформированный подслизистый тоннель (рис. 4, б).
Ушивают дефект слизистой мочевого пузыря над областью дооперационной проекции устья мочеточника (рис. 5, а). Формируют устье мочеточника в новом месте узловыми интракорпоральными швами (рис. 5, б). Резекцию и спатуляцию устья мочеточника при ПМР не производят.

61 (38,8%) ребенку старше 12 мес. мы не дренировали верхние мочевые пути, если после завершения формирования нового устья моча интенсивно выделялась из него в просвет пузыря (рис. 5, б). Детям до года и в случаях, когда функция сформированного устья вызывала сомнения, – 93 (59,2%) пациентам, верхние мочевые пути дренировали катетером 4–6 Fr, который вводили ретроградно через артифициальное устье сроком на 3,4±2,2 сут. Дистальный конец дренажной трубки выводили через уретру у девочек или через троакарные проколы в подвздошно-паховых областях у мальчиков. Всем пациентам дренировали мочевой пузырь уретральным катетером на срок 3,0±1,9 сут.
Результаты. Средняя продолжительность операций составила 126,8±46,7 мин: у больных до года – 136,0±43,8, у детей 1–3 лет – 130,1±43,5, у пациентов 4–17 лет – 122,4±65,8 мин. Средняя длительность пребывания в стационаре после хирургических вмешательств, выполненных с использованием ВД, составила 6,2±2,3 сут.
В 3 (1,9%) случаях на начальном этапе освоения методики нам пришлось прибегнуть к конверсии, из них у двух пациентов из-за погрешностей на этапе фиксации мочевого пузыря и установки троакаров возникла миграция манипуляторов в паравезикальную клетчатку и развилась околопузырная эмфизема, что привело к потере объема мочевого пузыря и не позволило продолжить операцию. Третьего пациента с двусторонним ПМР выраженные интраоперационные технические трудности привели к неоправданному удлинению времени операции.
Миграция газа в брюшную полость – наиболее частое интраоперационное осложнение у наших больных. Карбоксиперитонеум сформировался у 6 (3,8%) пациентов, последний устранен установкой иглы Вереша в пупочную область, что позволило беспрепятственно продолжить операцию эндоскопически.

Ранние послеоперационные осложнения возникли в 14 (9,0%) наблюдениях.
Преходящая обструкция в уретеровезикальном соустье имела место в 6 (3,8%) случаях, после удаления дренажей из верхних мочевых путей ликвидирована проведением консервативной терапии.
Острая полная обструкция дистального отдела мочеточника развилась у 3 (1,9%) пациентов в возрасте 3 мес., которым не проводилось дренирования верхних мочевых путей интраоперационно. Обструкция была устранена установкой временных пункционных нефростом.
Паравезикальная уринома возникла в 1 (0,6%) случае и скорее всего была обусловлена слишком глубоким проникновением через стенку мочеточника при фиксации последнего первым швом детрузора. Уринома была эвакуирована с использованием лапароскопического доступа.
У 1 (0,6%) мальчика отмечена миграция дистального конца интубирующего мочеточник дренажа через троакарный прокол в просвет мочевого пузыря, что мы связали с ненадежной его фиксацией к коже. Дренаж был удален трансуретрально.
Подтекание мочи из троакарного прокола произошло однажды (0,6%), купировано установкой уретрального катетера сроком на 7 сут.
Обсуждение. Анализ доступной нам литературы и наш опыт позволяют утверждать, что ВД является привлекательным из-за превосходного косметического результата, эффективности, сопоставимой с «золотым» стандартом, отсутствия выраженного болевого синдрома, наличия четкой интраоперационной границы, которая локализована мочевым пузырем и не позволяет случайно контактировать с окружающими органами, а также прекрасной визуализации. Однако возраст ребенка, прежде всего его производное – объем мочевого пузыря, в большинстве случаев служит сдерживающим фактором, ограничивающим его широкое распространение. Находя себе оправдание в тезисе «Слишком мало места…», многие хирурги сознательно его избегают, выбирая более привычный для них традиционный открытый или лапароскопический подход. Ранняя диагностика рефлюкса и обструкции УВС в большинстве случаев определяет необходимость выбора хирургического доступа в тех возрастных группах, когда емкость мочевого пузыря равна или чуть больше 100 мл.
Среди известных нам публикаций, посвященных ВД, только в трех работах представлены серии пациентов, включающие детей первого года жизни [7, 8, 20]. В данной работе мы представили данные об использовании ВД в отношении 25 детей в возрасте младше 1 года при объеме мочевого пузыря 70 мл и менее. Появление работ, посвященных использованию ВД в раннем возрасте, позволяет надеяться на изменение парадигмы и более широкое использование ВД в педиатрической урологии. Полагаем, что основным направлением дальнейших исследований должно быть изучение значения порогового объема мочевого пузыря, при котором использование доступа безопасно с точки зрения вероятности конверсии и обеспечения эффективности, сопоставимой с открытой хирургией.
Заключение. Несмотря на накопленный опыт, везикоскопическая операция остается достаточно трудоемким и сложным хирургическим вмешательством, требует длительного периода обучения даже урологов, обладающих хорошими мануальными навыками лапароскопической хирургии. Вместе с тем ВД позволяет выполнять весь спектр хирургических вмешательств на УВС и мочевом пузыре у детей, обеспечивая высокую эффективность и являясь существенно менее травматичным по сравнению с традиционным открытым цистотомическим доступом, позволяет добиваться высокого косметического результата.


