Введение. Целью первичной операции по поводу опухолей сТ1 по-прежнему является максимально радикальное удаление всех видимых образований и получение качественного материала для патоморфологического исследования. Именно результаты гистологического исследования помогают точно определить пациента в ту или иную группу риска, что влияет непосредственно на послеоперационное ведение. В связи с определяющей ролью качественного патоморфологического заключения ему придают все большее значение. Наиболее значимые «классические» параметры морфологического заключения – это степень дифференцировки (критерий G), а также глубина инвазии опухоли (критерий Т), для определения которых необходимо наличие элементов подслизистого и мышечного слоев в макропрепарате. Кроме того, в настоящее время доказана прогностическая роль наличия в макропрепарате элементов детрузора как независимого фактора, влияющего на раково-специфическую выживаемость [1, 2]. Однако существуют и не менее важные морфологические параметры – фокусы carcinoma in situ (CIS) в горизонтальном крае резекции, наличие лимфоваскулярной инвазии (LVI), а также нетипичные гистологические варианты опухоли (Variant Histology – VH). Наличие хотя бы одной из перечисленных характеристик переводит пациента в группу высокого и очень высокого риска, что кардинально меняет тактику ведения в послеоперационном периоде и в разы увеличивает как объем лечебных мероприятий (цистэктомия, БЦЖ- и химиотерапия, лучевая терапия), так и их стоимость (по сравнению с опухолями умеренного и низкого рисков) [3].
В связи с высокой значимостью патоморфологического заключения повышаются требования и к качеству макропрепарата, получаемого хирургом во время операции.
К сожалению, наиболее распространенной операцией при мышечно-неинвазивном раке мочевого пузыря до сих пор остается стандартная трансуретральная резекция (сТУР), которая не отвечает современным требованиям. Частоты выявления пучков детрузора в макропрепарате даже в центрах с большим опытом (так называемая ТУР высокого качества, или агрессивная ТУР) не превышает 50–80% [4–7]. В случаях отсутствия во фрагментах основания опухоли элементов детрузора после первичной резекции, согласно всем действующим рекомендациям (EAU, AUA, NICE, NCCN), требуется выполнение повторной ТУР в сроки до 6 нед.
В связи с этим методика сТУР отходит на второй план, уступая технике en-bloc, обеспечивающей значительно более высокое качество материала для патоморфологического исследования. Частота выявления детрузора как наиболее доказанного критерия адекватно выполненной en-bloc-резекции достигает 95–100% [3, 8].
Опухоли большого размера занимают особое место в группе папиллярного уротелиального рака. В силу крупного размера экзофитной части они изначально отличаются большей гетерогенностью как по G-критерию (фокусы high grade – HG, среди общего фона low grade – LG), так и по антигенному составу, чему в последнее время придается огромное значение (опухоли базального и/или люминального типа). В связи с этим важную роль приобретает тщательное исследование не только блока опухоль+основание (для точной оценки критерия Т и выявления LVI), но и максимально неповрежденной опухолевой массы для определения ее морфологической структуры (критерии G, VH) и при необходимости – иммунного фенотипа. Получаемые при сТУР «чипсы» опухолевой ткани не отвечают современным требованиям, предъявляемым препаратам для морфологического исследования. Они всегда характеризуются значительным термическим повреждением, более выраженным при монополярной и менее – при биполярной резекциях, а архитектоника опухоли, как правило, нарушена, что также снижает качество гистологического, иммуногистохимического и антигенного исследований. При выявлении необычных гистологических вариантов опухоли (плоскоклеточного, саркоматоидного, плазмоцитарного, микропапиллярного) в последнее время большое значение придают процентному соотношению «чистой» карциномы и вариантной гистологии в макропрепарате, что также затруднительно при наличии «чипсов», а не единого блока экзофитной части опухоли.
Также необходимо отметить важность оценки состояния слизистой оболочки, непосредственно граничащей с опухолью, с целью обнаружения сопутствующей carcinoma in situ (CIS). При мультивариантном анализе данный параметр подтвердил свою значимость как независимый фактор, влияющий на раково-специфическую выживаемость (CSS) и требующий реТУР [9]. Методика сТУР не обеспечивает качественного материала для исследования края резекции из-за фрагментарного характера материала и его термического повреждения.
В связи с этими соображениями повышается роль методики резекции en-bloc как способа, позволяющего получать термически неповрежденную, т.е. «нативную» опухолевую ткань для проведения комплексного (морфологического, иммунногистохимического и антигенного) исследования. В последние годы с активным внедрением в клиническую практику лазерных технологий метод en-bloc-резекции, описанный T. Kawada в 1997 г., получил дополнительный импульс развития и вновь находится в фокусе интереса [3, 10].
Если при опухолях небольшого и среднего размеров (до 3,5 см) методика резекции en-bloc широко применяется и не представляет больших трудностей, при крупных опухолях (более 3,5 см) возникают технические проблемы как с удалением опухоли, так и с извлечением макропрепарата. Крупные опухоли мочевого пузыря (>3,5 см) имеют более высокий уровень повышения стадии c сT1 до pТ2 (upstaging) по сравнению с опухолями небольшого размера. Кроме того, крупные опухоли, как правило, имеют более высокую степень злокачественности. Помимо массивности самой экзофитной части опухоли с расширением диаметра ее основания (особенно при опухолях G3 и G2) увеличивается и весь объем блока опухоль+основание (в основном за счет упругой ткани мышечного слоя), т.е. усложняется задача извлечения макропрепарата. Удаление крупных опухолей сопряжено с более высоким риском развития осложнений, таких как перфорация стенки мочевого пузыря или кровотечение, что требует от уролога совершенных навыков владения приемами трансуретральной хирургии.
Следует особо подчеркнуть, что методики извлечения макропрепарата с максимальным сохранением его диагностической ценности на настоящий момент детально не разработаны и имеют лишь описательный характер. В данной работе нами предлагается подробный анализ различных подходов к лазерной резекции en-bloc при удалении крупных опухолей мочевого пузыря.
Материалы и методы. В исследование вошли 12 пациентов (8 мужчин и 4 женщины) в возрасте от 58 лет до 71 года (средний возраст – 64 года) с диагностированными при УЗИ и МСКТ опухолями мочевого пузыря стадии сТ1. Размер опухолей варьировался от 3,5 до 6,2 см (средний размер – 4,4 см). Операции были выполнены тремя хирургами с большим опытом трансуретральных резекций опухолей мочевого пузыря. Распределение пациентов по группам было проведено, исходя из предпочтений хирурга. Операции сделаны на базе Института урологии и репродуктивного здоровья человека Сеченовского Университета (n=3) и Воскресенской районной больницы № 2 (n=9). Полученные интраоперационно биоптаты направляли на исследование в биопсийную лабораторию ЦПАО Сеченовского Университета; там же консультировали готовые стеклопрепараты из Воскресенской РБ. Критерием исключения из исследования стало выявление рТ2-опухоли (1 пациент).
Для выполнения операций был использован тулиевый волоконный лазер «Уролаз U1», фирмы IRE-Polus, мощностью 120 Вт. Использовались следующие параметры: длина волны – 1,94 мкм, энергия импульса – 1,0 Дж, частота 10 Гц, мощность 10 Вт. Диаметр волокна – 600 мкм.
Гольмиевый лазер Lumenis Pulse 100 H, мощностью 100 Вт. Использовались следующие параметры: длинный импульс, энергия импульса – 1,0 Дж, частота от 10 до 20 Гц. Диаметр волокна – 550 мкм.
Инструменты: резектоскоп 26 Ch фирмы Karl Storz, с постоянной ирригацией (типа Iglesias), лазероскоп с каналом для проведения лазерного волокна.
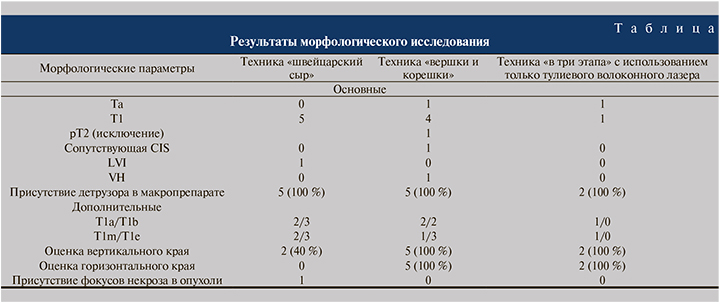
Морфологическую оценку макропрепаратов выполняли согласно рекомендациям ВОЗ (2016) [11]. Оценивали следующие основные морфологические параметры: дифференцировку опухоли (G), глубину инвазии опухоли (Т), наличие детрузора, LVI, фокусов CIS, VH. Дополнительные морфологические параметры включали субстадирование Т1, оценку горизонтального и вертикального хирургических краев (R. Horizontal, R. Vertical), а также наличие и процент участков некроза в опухоли. Субстадирование Т1 осуществляли по двум системам: Т1-metric и T1a/T1b субклассификациям.
Для удаления опухолей большого размера нами были разработаны следующие авторские методики.
Техника «швейцарский сыр» (5 наблюдений). Концепция данной методики заключается в удалении опухоли в два этапа: первым этапом удаляют опухоль с основанием единым блоком, вторым – проводят трансуретральную резекцию макропрепарата в полости мочевого пузыря при помощи петли резектоскопа и извлечение фрагментов (рис. 1).

 Внутрипросветную резекцию макропрепарата осуществляют до тех пор, пока остающийся блок не уменьшится настолько, чтобы извлечь его по тубусу резектоскопа. При данной методике в макропрепарате исходно большого размера в процессе резекции образуются полости, в итоге он начинает напоминать кусок швейцарского сыра с характерными для него «дырками» (рис. 2).
Внутрипросветную резекцию макропрепарата осуществляют до тех пор, пока остающийся блок не уменьшится настолько, чтобы извлечь его по тубусу резектоскопа. При данной методике в макропрепарате исходно большого размера в процессе резекции образуются полости, в итоге он начинает напоминать кусок швейцарского сыра с характерными для него «дырками» (рис. 2).
Извлечение макропрепарата по тубусу после частичной внутрипросветной резекции не представляет сложностей. Для en-bloc-резекции методом «швейцарский сыр», или «swisscheese», нами использовались различные источники энергии. В одном наблюдении это был тулиевый волоконный лазер (Tm fiber LRBT) в одном – гольмиевый лазер (HoLRBT), в двух проведена биполярная резекция, в одном наблюдении – монополярная резекция.
Техника «вершки и корешки» (5 наблюдений). Концепция данной методики – максимальное сбережение блока опухоль+основание. Первый этап заключается в трансуретральной электрорезекции экзофитной части опухоли при помощи петли резектоскопа (моно- или биполярной) до основания опухоли. После первого этапа должно остаться минимум 5–10 мм опухолевой ткани над основанием опухоли. Далее после точечного гемостаза отмывают резецированные фрагменты опухоли по тубусу. Второй этап заключается в en-bloc-резекции основания опухоли с прилежащим подслизистым слоем и частью детрузора. В макропрепарат при этом должны попасть как минимум поверхностные пучки мышечного слоя (рис. 3).

 Макропрепарат при данной методике состоит из двух частей: экзофитной части опухоли (вершки – the crown) и резецированного единым блоком, не разделенного блока опухоль+основание (корешки – the root), который после извлечения растягивали на пенопласте и фиксировали в таком виде (рис. 4).
Макропрепарат при данной методике состоит из двух частей: экзофитной части опухоли (вершки – the crown) и резецированного единым блоком, не разделенного блока опухоль+основание (корешки – the root), который после извлечения растягивали на пенопласте и фиксировали в таком виде (рис. 4).
В одном наблюдении операция полностью выполнена с использованием биполярной резекции, в четырех применялась комбинированная техника: ТУР экзофитной части осуществлена при помощи монополярной петли, а en-bloc основания – при помощи гольмиевого лазера.
Техника «в три этапа» с использованием только тулиевого волоконного лазера (2 наблюдения). Основные этапы данной методики: 1-й этап – отсечение экзофитной части опухоли с точечной коагуляцией, 2-й – морцелляция и аспирация данной части, 3-й этап – en-bloc-резекция основания опухоли с прилежащим слоем мышечной стенки, извлечение макропрепарата единым блоком по тубусу (рис. 5).
При всех описанных методиках после резекции основания опухоли осуществляли рандомную щипковую биопсию (или ТУР-биопсию) из 1–3 участков мышечного слоя из ложа удаленной опухоли для дополнительного контроля вертикального хирургического края. В конце операции дополнительно обрабатывали кратер и края резекции шариковым электродом (или лазерным воздействием) для абляции зоны резекции и профилактики геморрагических осложнений.

Результаты и обсуждение. У всех пациентов при гистологическом исследовании выявлен рак мочевого пузыря. Опухоли низкой степени злокачественности (LG) диагностированы у 5 (41,7 %) пациентов, высокой (HG) – у 7 (58,3 %) (ВОЗ, 2004/2016). По классификации ВОЗ (1973), распределение пациентов по критерию G было следующим: G1 – 1 (8,3 %), G2 – 6 (50 %), G3 – 5 (41,7 %).
Технические особенности методик.
Техника «швейцарский сыр». В нашей серии данная методика оказалась выполнимой во всех случаях. Конверсий в сТУР не было. В случае монополярной резекции опухоль располагалась в области дна с переходом на боковую стенку и во время резекции отмечен выраженный обтураторный рефлекс, потребовавший блокады обтураторного нерва местным анестетиком. Необходимо учитывать локализацию опухоли и по возможности не использовать электрохирургию без миорелаксантов, особенно в области боковых стенок. Также необходимо отметить, что для этапа внутрипросветной электрорезекции мочевой пузырь должен быть адекватно наполнен – это помогает избежать случайного повреждения стенок.
Техника «вершки и корешки». Данная методика также была выполнена во всех запланированных наблюдениях, и конверсии в сТУР не было. Однако на этапе освоения трудно определить оптимальную толщину оставляемого основания опухоли, достаточной для качественного морфологического исследования, с одной стороны, и позволит извлечь макропрепарат целиком по тубусу, с другой. Стоит отметить такое заметное преимущество данной методики, как комфортная резекция основания (особенно при использовании гольмиевого и тулиевого волоконных лазеров). После резекции экзофитной части опухоли и отмывания фрагментов резекция основания более легкая по сравнению с большой опухолью и сопоставима со стандартной en-bloc-резекцией опухоли небольшого размера. Однако необходимо учитывать злокачественный потенциал опухоли и выполнять резекцию по возможности с отступом в 10 мм и более глубоко (вплоть до контролируемой внебрюшинной перфорации). Хотелось бы отметить, что во всех наблюдениях при использовании лазера резекцию проводили в пределах границы поверхностного и глубокого мышечных слоев по краю резекции, а в области основания центральной части опухоли – до глубокого мышечного слоя и за него. Для коагуляции поверхности опухоли после резекции экзофитной части более эффективным оказался шариковый или валиковый электрод, нежели петля резектоскопа (точечный гемостаз был менее эффективен, чем спрей-гемостаз).
В данной группе у одной пациентки диагностирована стадия рТ2 (солитарная опухоль) с отрицательными краями резекции. Она была исключена из исследования (при реТУР не было дополнительных опухолей и CIS, рубец негативный) и в последующем ей была проведена тримодальная терапия.
Техника «в три этапа» с использованием только тулиевого волоконного лазера. Благодаря настройкам тулиевого волоконного лазера стало возможным прецизионное отсечение экзофитной части опухоли при условии сохранения адекватного гемостаза. Дополнительного гемостаза с использованием электрохирургии не потребовалось. Однако в отличие от двух предыдущих методик, при которых выполнялась резекция как папиллярных, так и солидных опухолей на широком основании, данная методика применялась нами при опухолях на нешироком основании.
По результатам морфологического исследования интраоперационного материала можно сделать следующие выводы.
Техника «швейцарский сыр»: в 100% наблюдений получены пучки мышечного слоя, проблем с дифференцировкой muscularis mucosae и muscularis propria не возникло. Блок опухоль+основание в результате резекции оказался не единым, а разрозненным, однако коагуляционные повреждения краев были умеренно выраженными (см. таблицу).
Для оценки по критерию G объем опухоли оказался достаточным, архитектоника опухоли была сохранной, объем опухоли по сравнению с нативным был уменьшен за счет коагуляционных повреждений в процессе резекции.
Вертикальный край резекции удалось проследить неполностью, однако в большинстве серий стекол определен край мышечного слоя, достаточный для оценки. Вертикальная дифференцировка опухоли и блока опухоль+основание прослеживалась хорошо. Край слизистой для оценки CIS также оказался фрагментарным, горизонтальный хирургический край точно оценить оказалось невозможным в связи с его фрагментарным характером (см. таблицу).
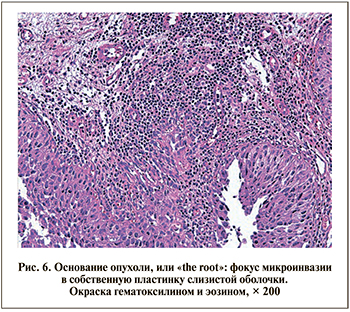 Техника «вершки и корешки». При данной методике во всех наблюдениях материал оказался наиболее информативным. Массив опухоли имел умеренно выраженные термические повреждения, однако с учетом больших размеров опухолей был достаточным для оценки как степени злокачественности, так и дополнительных параметров, таких как VH (в 1 наблюдении выявлен микропапиллярный тип опухоли менее чем в 10% биоптата). Блок опухоль+основание имел наивысшее качество в представленной серии техник, что позволило наиболее достоверно оценить наличие инвазии и провести субклассификацию опухоли по критерию Т. Помимо наличия элементов детрузора и целостного вертикального хирургического края по периферии основания опухоли присутствовала протяженная зона циркулярного края, позволившего во всех наблюдениях дать дополнительную оценку по сопутствующей CIS, а также и горизонтального края. Максимальная сохранность комплекса опухоль+основание при использовании методики «вершки и корешки» позволяет морфологу выявлять не только участки более глубокой инвазии опухоли, но и фокусы ее микроинвазии в собственную пластинку слизистой оболочки (рис. 6).
Техника «вершки и корешки». При данной методике во всех наблюдениях материал оказался наиболее информативным. Массив опухоли имел умеренно выраженные термические повреждения, однако с учетом больших размеров опухолей был достаточным для оценки как степени злокачественности, так и дополнительных параметров, таких как VH (в 1 наблюдении выявлен микропапиллярный тип опухоли менее чем в 10% биоптата). Блок опухоль+основание имел наивысшее качество в представленной серии техник, что позволило наиболее достоверно оценить наличие инвазии и провести субклассификацию опухоли по критерию Т. Помимо наличия элементов детрузора и целостного вертикального хирургического края по периферии основания опухоли присутствовала протяженная зона циркулярного края, позволившего во всех наблюдениях дать дополнительную оценку по сопутствующей CIS, а также и горизонтального края. Максимальная сохранность комплекса опухоль+основание при использовании методики «вершки и корешки» позволяет морфологу выявлять не только участки более глубокой инвазии опухоли, но и фокусы ее микроинвазии в собственную пластинку слизистой оболочки (рис. 6).
Техника «в три этапа» с использованием только тулиевого волоконного лазера. Необходимо отметить, что оценка опухоли по критерию G оказалась несколько затруднительной в связи с нарушением нативной структуры опухоли. Папиллярные структуры опухоли хаотически «перемешивались» в результате морцелляции, что существенно затрудняло морфологическое исследование. Несмотря на это, полученный материал экзофитной части опухоли позволил оценить степень дифференцировки и злокачественности опухоли по обеим классификациям (ВОЗ, 1973; ВОЗ, 2004/2016). Корректная оценка в морцелляте как процента площади участков с более низкой дифференцировкой, так и фокусов некроза в опухоли, а также VH была затруднительна. Основной макропрепарат, включающий блок опухоль+основание, имел аналогичное высочайшее качество, как в группе «вершки и корешки», что позволяло также полноценно оценить наличие инвазии и провести субклассификацию по критерию Т. Однако следует отметить, что вблизи основания присутствовал лишь небольшой фрагмент опухолевой ткани, что не могло компенсировать низкое качество материала в морцелляте.
В целом все три разработанные нами методики обеспечили достаточное для адекватного морфологического исследования качество макропрепарата. При технике «швейцарский сыр» часть материала (в том числе и основание опухоли) в ходе интрапузырной электрорезекции подвергается термическому повреждению, что является ее «слабым звеном». Наиболее перспективными с точки зрения обеспечения полноценного и комплексного морфологического заключения представляются две техники выполнения оперативного вмешательства – «вершки и корешки» и в «три этапа» с использованием только тулиевого волоконного лазера. Обе методики позволяют получать нативный блок опухоль+основание с зоной прилегающей слизистой оболочки и достаточно толстым мышечным слоем. Именно максимально сохранный неразделенный блок опухоль+основание без термического повреждения дает наиболее точную информацию о наличии и глубине инвазии (критерий Т), наличии или отсутствия LVI и позволяет корректно оценить вертикальный край резекции. Также очень важно отметить наличие довольно широкой зоны слизистой оболочки, прилегающей к опухоли (от до 10 мм), что позволяет получать достоверную информацию о сопутствующей CIS и состоянии горизонтального края резекции. Однако существенным недостатком техники «в три этапа» с использованием тулиевого волоконного лазера является худшее качество экзофитной ткани опухоли, получаемое в результате ее морцелляции, что затрудняет проведение комплексной морфологической оценки. Вероятно, более перспективным окажется использование контейнеров-эвакуаторов типа «endo-bag» для раздельного и наименее травматичного извлечения экзофитной части опухоли и блока опухоль+основание.
Заключение. В данной небольшой серии наблюдений показана возможность удаления опухолей мочевого пузыря больших размеров (от 3,5 до 6,2 см) тремя разработанными и апробированными нами способами. Все три предложенные методики показали достаточное качество материала с точки зрения проведения его полноценной морфологической оценки, однако следует упомянуть и некоторые негативные моменты.
Таким образом, в нашей серии наблюдений техника «вершки и корешки» оказалась безусловным лидером с точки зрения качества полученного в ходе операции материала для его последующей комплексной морфологической оценки.
Необходимо отметить, что все указанные способы удаления опухолей большого размера по-прежнему не позволяют соблюдать принципы абластики. Резецированные фрагменты опухоли в той или иной степени контактируют с поверхностью неизмененной слизистой, что теоретически может приводить к имплантации опухолевых клеток. В будущем мы планируем разработать и использовать специальные устройств типа endo-bag для извлечения фрагментов макропрепарата, что позволит максимально абластично, раздельно и с минимальным повреждением извлекать отсеченную экзофитную часть опухоли и блок опухоль+основание.
Хотелось бы подчеркнуть, что в данной работе нами представлены лишь первые результаты по применению новых и перспективных методик резекции крупных новообразований мочевого пузыря единым блоком. Для более четкого определения их клинической эффективности, детализации морфологических критериев оценки материала необходимо продолженное проспективное исследование с увеличением числа пациентов.



