Введение. Изучение мужского фактора бесплодия считается актуальным научно-практическим направлением во всем мире. Согласно данным литературы, репродуктивный потенциал мужского населения в мире ежегодно снижается, а бесплодных пар становится все больше [1–5].
У половины бесплодных супружеских пар мужской фактор проявляется изменениями параметров эякулята. Полное отсутствие сперматозоидов в эякуляте – азооспермия – самый серьезный вариант мужского бесплодия, поскольку не предполагает естественного зачатия. Данная патология встречается у 1% мужчин в популяции, частота азооспермии среди бесплодных мужчин составляет 10–15% [6–9].
По характеру и причинам нарушения сперматогенеза азооспермию классифицируют на обструктивную и необструктивную. Обструктивный вариант патологии встречается у 15–20% мужчин с азооспермией и развивается вследствие нарушения проходимости семявыносящих путей на разных участках [10–12].
На сегодняшний день существует два принципиальных подхода к лечению пациентов с обструктивной азооспермией: реконструктивная хирургия и применение программ ВРТ. Оперативное лечение может быть эффективно в случае кратковременной обструкции. Однако данные Американской урологической ассоциации свидетельствуют о невысокой частоте естественного зачатия после хирургической коррекции [13–15]. Достижение беременности с использованием методов ВРТ при обструктивной азооспермии возможно после получения сперматозоидов из яичка. С этой целью применяют пункционные и «открытые» методики. При этом, по данным разных авторов, «открытые» методы более эффективны [16–19].
Стоит отметить, что в современном мире супружеские пары все чаще задумываются о деторождении в более позднем репродуктивном возрасте. Проблема влияния возраста на фертильность женщины давно служит предметом изучения. Однако в литературе представлены данные о негативном воздействии возраста и на репродуктивную функцию мужчины [20, 21].
Целью исследования было оценить результативность применения методов ВРТ для лечения бесплодия у мужчин с обструктивной азооспермией.
Материалы и методы. Ретроспективное исследование проведено на основе данных урологического отделения СОКБ им. В. Д. Середавина и отделения ВРТ «МЦ “Династия”», полученных в период с 2009 по 2017 г. В исследовании вошли 77 супружеских пар, страдавших бесплодием, которые были разделены на две группы. Основную группу составили 18 супружеских пар, в которых у мужчин была диагностирована обструктивная азооспермия. В контрольную группу вошли 59 супружеских пар, в которых у мужчин присутствовали сперматозоиды в эякуляте.
Критерии включения в основную группу исследования со стороны мужчины: возраст старше 40 лет, наличие азооспермии, нормальный уровень фолликулостимулирующего гормона (ФСГ), MAR-тест менее 50%, отсутствие изменений кариотипа и микроделеций в AZF-регионе Y-хромосомы, отсутствие в анамнезе факторов с доказанным отрицательным влиянием на сперматогенез, отсутствие противопоказаний к проведению тестикулярной биопсии на момент начала программы ЭКО [5, 8, 9]. Критерии включения в контрольную группу исследования со стороны мужчины: возраст старше 40 лет, наличие подвижных сперматозоидов в эякуляте в любом количестве. Критерий включения в основную и контрольную группы со стороны женщины – отсутствие противопоказаний к гормональной стимуляции и вынашиванию беременности на момент начала программы ЭКО.
Критерии исключения из групп исследования со стороны мужчин: наличие злокачественных новообразований любой локализации, в том числе в анамнезе, острые воспалительные заболевания и/или хронические заболевания в стадии обострения, ВИЧ-инфекция, врожденные или приобретенные пороки развития половых органов.
Все пациенты с азооспермией были проинформированы о существующих рисках отсутствия сперматозоидов в полученном в результате тестикулярной биопсии материале, супружескими парами оформлены информированные согласия на использование спермы донора в случае отсутствия подвижных сперматозоидов в биоптате. В связи с тем что научное исследование было ретроспективным, добровольное информированное согласие на участие в нем пациенты не оформляли.
Исследование спермограммы с MAR-тестом проводили двукратно по рекомендациям ВОЗ с перерывом в 2 мес., в отсутствие сперматозоидов в эякуляте после центрифугирования при 400-кратном увеличении выставляли диагноз азооспермии [22]. Оценку осуществлял эмбриолог с помощью стереомикроскопа Carl Zeiss Axiostar Plus (Германия).
Определение уровня ФСГ, исследование кариотипа и AZF-региона Y-хромосомы пациентам с азооспермией назначалось урологом-андрологом в плане дообследования для дифференциальной диагностики причины азооспермии и разработки тактики лечения в программе ВРТ. Указанные исследования пациенты проходили в доступных лабораториях Самары и Самарской области.
Контролируемую овариальную гиперстимуляцию в программах ЭКО выполняли по стандартным протоколам. В «длинном» протоколе фазу десенситизации гипоталамо-гипофизарно-яичниковой системы начинали с 19–21-го дня предшествовавшего стимуляции цикла, использовали препарат агониста гонадотропин-рилизинг гормона (Диферелин 0,1 мг, «Beaufour Ipsen International», Франция). Стимуляцию суперовуляции в «длинном» протоколе и в протоколе с антагонистами гонадотропин-рилизинг гормона начинали со 2–3-го дня менструального цикла, использовали препараты рекомбинантного ФСГ (Пурегон, «Organon», Нидерланды; Гонал-Ф, «Merck Serono S.p.A.», Италия), человеческого менопаузального гормона (Менопур, «Ferring», Германия). В качестве триггера финального дозревания ооцитов использовали препарат хорионического гонадотропина человека (ХГЧ) в дозировке 10 тыс. МЕ (Прегнил, «Organon», Нидерланды; Гонадотропин хорионический, Московский эндокринный завод, Россия), 6500 МЕ (Овитрель, Merck Serono S.p.A., Италия).
Тестикулярную биопсию в программах ЭКО выполняли мужчинам с азооспермией по «открытой» методике TESE (testicular sperm extraction) [2, 3, 6]. Процедуру проводили в день трансвагинальной пункции (ТВП) женщины, полученный биоптат транспортировали в эмбриологическую лабораторию в буферной среде Flushing Medium Fepti Pro (Бельгия). Эмбриолог проводил механическое измельчение доставленных образцов с целью обнаружения сперматозоидов, пригодных для оплодотворения, с использованием инвертированного микроскопа Nikon Eclipse Ti-S (Япония). В случае отсутствия подвижных сперматозоидов в гомогенизированном материале образцы центрифугировали (центрифуга SIGMA 2-6/E, Германия), отбирали надосадочную жидкость и повторно оценивали осадок под микроскопом.
В отсутствие подвижных сперматозоидов в материале после центрифугирования для оплодотворения использовали предварительно выбранную пациентами сперму донора. Оплодотворение в основной и контрольной группах осуществляли методом ИКСИ, использовали только зрелые ооциты женщины (на стадии метафаза II), оплодотворение контролировали через 16–18 ч и считали успешным при визуализации двух отдельных пронуклеусов и двух полярных тел [4, 16, 21].
Поддержку лютеиновой фазы менструального цикла начинали в день трансвагинальной пункции, использовали препараты микронизированного прогестерона (Утрожестан, «Besins Healthcare», Бельгия) и дидрогестерона (Дюфастон, «Abbott Healthcare Products B.V.», Нидерланды) в дозировке 600 и 60 мг соответственно. Перенос эмбрионов проводили на 3-и, 4-е или 5-е сутки под ультразвуковым контролем. После переноса эмбрионов через 14 дней у пациенток в сыворотке крови определяли уровень β-субъединицы ХГЧ (β-ХГЧ), через 21 день после переноса эмбрионов проводили контрольное УЗИ с целью подтверждения клинической беременности.
Результаты оценивали по нескольким показателям: частота наступления беременности (ЧНБ; рассчитывали по данным анализа на β-ХГЧ), частота клинической беременности (ЧКБ; определяли по результатам первого контрольного УЗИ), число родов, число родившихся детей.
Обработку данных проводили на персональном компьютере с помощью пакета программ SPSS Statistics, версия 21. В работе использовали методы описательной статистики (средняя арифметическая величина, среднее квадратическое отклонение; медиана, межквартильный размах [25-й и 75-й квартили]). Статистическую разницу между группами определяли с помощью критерия Стьюдента и дисперсионного анализа по Фишеру–Снедекору, U-критерия Манна–Уитни. Проверку статистической значимости различий непараметрических данных проводили с помощью критерия Пирсона (χ2), χ2 с поправкой Йейтса (для малой выборки). Критическое значение уровня значимости принимали равным 0,05.
Результаты и обсуждение. В исследование были включены супружеские пары старшего репродуктивного возраста. Средний возраст мужчин основной группы составил 51±10,8 года, контрольной группы – 49±8,2 (р>0,05), средний возраст женщин – 39,0±5,4 и 40,0±6,1 года соответственно (р>0,05).
 Все мужчины основной группы помимо полного клинического обследования для программы ЭКО проходили дообследование у андролога, согласно которому у 18 (100%) пациентов получены нормальные уровни ФСГ (по референсным значениям лаборатории, выполнявшей анализ), отсутствие изменений кариотипа и микроделеций в AZF-регионе Y-хромосомы. На основании отсутствия сперматозоидов в эякуляте по показателям спермограммы, данных анамнеза, физикального осмотра, а также результатов пройденного дообследования данной когорте пациентов поставлен диагноз обструктивной азооспермии.
Все мужчины основной группы помимо полного клинического обследования для программы ЭКО проходили дообследование у андролога, согласно которому у 18 (100%) пациентов получены нормальные уровни ФСГ (по референсным значениям лаборатории, выполнявшей анализ), отсутствие изменений кариотипа и микроделеций в AZF-регионе Y-хромосомы. На основании отсутствия сперматозоидов в эякуляте по показателям спермограммы, данных анамнеза, физикального осмотра, а также результатов пройденного дообследования данной когорте пациентов поставлен диагноз обструктивной азооспермии.
В контрольную группу были включены мужчины 40 лет и старше, которые проходили полное клиническое обследование перед программой ЭКО. Показатели спермограммы в данной группе представлены в табл. 1. Стоит отметить, что, несмотря на наличие у 44,1% мужчин выраженной олигозооспермии, у всех пациентов в эякуляте были обнаружены сперматозоиды, пригодные для оплодотворения.
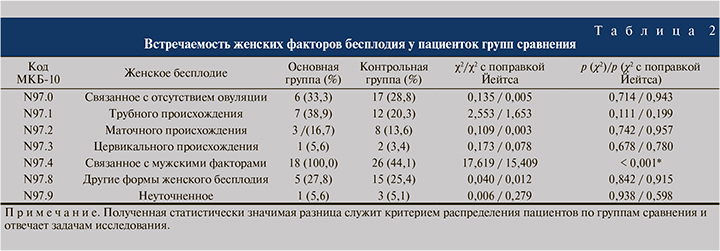
Женщины, участвовавшие в исследовании, также имели гинекологическую патологию, влиявшую на реализацию бесплодия в паре (табл. 2).
Стоит отметить, что статистически значимая разница между группами выявлена только по частоте бесплодия, связанного с мужским фактором, так как этот критерий лежал в основе распределения пациентов на группы. По остальным женским факторам бесплодия группы не различались.
В большинстве наблюдений отмечено сочетание нескольких факторов. Среди причин бесплодия, связанного с отсутствием овуляции, наиболее часто диагностировали синдром поликистозных яичников. Маточные формы бесплодия были представлены миомой матки и патологией эндометрия.
В другие формы бесплодие был включен эндометриоз.
Протоколы стимуляции суперовуляции в группах сравнения были распределены следующим образом: в основной группе «длинный» протокол был использован в 44,4% (8 женщин) наблюдений, протокол с антагонистами гонадотропин-релизинг гормона – в 55,6% (10 женщин), в контрольной группе – в 39% (23 женщины) и 61% (36 женщин) наблюдений соответственно (χ2=0,171; р=0,680). Довольно высокая частота применения «длинного» протокола обусловлена старшей возрастной группой пациенток, как следствие – снижением овариального резерва в когорте исследованных женщин, что требовало предварительной десенситизации гипоталамо-гипофизарно-яичниковой системы для получения большего числа зрелых ооцитов.
В результате контролируемой овариальной гиперстимуляции в основной группе было получено 8 [4–16] ооцитов, из них ооцитов на стадии МII – 6 [3–9], в контрольной группе – 10 [7–19] ооцитов (р>0,05), из них на стадии МII – 8 [5–13] (р>0,05).
По результатам тестикулярной биопсии, сперматозоиды, пригодные для оплодотворения, обнаружены в материале 15 (83,3%) пациентов. В трех наблюдениях подвижные сперматозоиды получены не были даже после центрифугирования образцов, оплодотворение проводили предварительно выбранной спермой донора.
 Оплодотворение как в основной, так и в контрольной группе в 100% наблюдений проводили методом ИКСИ. Перенос эмбрионов осуществляли на 3-и, 4-е, 5-е сутки культивирования (табл. 3). Переносили от одного до двух эмбрионов. Статистических различий по суткам переноса и числу перенесенных эмбрионов между группами не было.
Оплодотворение как в основной, так и в контрольной группе в 100% наблюдений проводили методом ИКСИ. Перенос эмбрионов осуществляли на 3-и, 4-е, 5-е сутки культивирования (табл. 3). Переносили от одного до двух эмбрионов. Статистических различий по суткам переноса и числу перенесенных эмбрионов между группами не было.
Как видно из табл. 4, по исследованным показателям статистически значимых различий между группами выявлено не было, что служит очень благоприятным прогностическим признаком в отношении лечения пациентов с азооспермией с использованием тестикулярной биопсии. В трех супружеских парах, в которых оплодотворение проводили спермой донора ввиду отсутствия подвижных сперматозоидов в материале после тестикулярной биопсии, беременность не наступила. В данных супружеских парах отмечен наиболее выраженный женский сочетанный фактор бесплодия.
Полученные высокие показатели в основной группе можно объяснить тем, что по данным научных исследований [1, 7, 15], обструктивный характер азооспермии не оказывает столь выраженного повреждающего влияния на сперматозоиды, как необструктивный вариант патологии и, возможно, как тяжелые формы олигозооспермии. Для пациентов с обструктивной азооспермией причиной бесплодия служит механическое препятствие в семявыносящих путях с сохранением нормального сперматогенеза, тогда как при олигозооспермии зачастую имеет место сочетание причин мужского бесплодия с потенциальным угнетением сперматогенеза. Стоит отметить, что у 26 (44,1%) пациентов контрольной группы имела место олигозооспермия с концентрацией сперматозоидов менее 10 млн/мл вплоть до единичных сперматозоидов в эякуляте.
В основной группе родов было 6, при этом родилось 8 детей (4 одним плодом и 2 двойни). В контрольной группе соответствующие показатели составили 14 (χ2 с поправкой Йейтса=0,168; р=0,683, по сравнению с основной группой) и 19 (12 одним плодом, 2 двойни, 1 тройня).
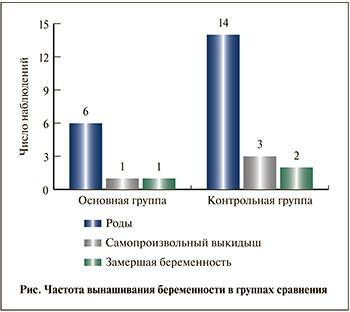 Частота вынашивания беременности в группах сравнения представлена на рисунке.
Частота вынашивания беременности в группах сравнения представлена на рисунке.
Потеря беременности в основной группе имела место в 2 (25%) наблюдениях, в контрольной – в 5 (26,3%). По этим показателям также не было выявлено достоверных различий между группами.
Заключение. Проведенное ретроспективное исследование результативности применения методов ВРТ для лечения бесплодия у мужчин 40 лет и старше с обструктивной азооспермией показало отсутствие статистически значимых различий в частоте наступления беременности, частоте клинической беременности и частоте вынашивания беременности по сравнению с парами, в которых у мужчин присутствовали сперматозоиды в эякуляте. Это может быть обусловлено сохранением нормальной структуры сперматозоидов у пациентов с обструктивной азооспермией, т.е. с изолированным механическим фактором бесплодия при сохранении сперматогенеза. Полученные данные убедительно доказывают эффективность применения тестикулярной биопсии для лечения бесплодия у мужчин с азооспермией, так как получаемые из биоптата сперматозоиды при данном варианте патологии пригодны к оплодотворению.



