Введение. Оптимальный подход ведения пациентов с пересаженными органами, позволяющий улучшать выживаемость пациента и трансплантата, предусматривает достижение баланса между профилактикой и лечением отторжения и риском развития инфекций. В течение первых 6 мес. после трансплантации почки (ТП) инфекции развиваются у 52% пациентов [1, 2].
По мнению S. Becker и соавт. в раннем посттрансплантационном периоде чаще других встречается инфекция мочевыводящих путей (ИМП) [3].
H. Green и соавт. сообщают, что в 13,3% случаев ИМП развивается в 1-й мес., в 14,7% – со 2-го по 6-й и в 72% – спустя более 6 мес. после ТП [4].
Инфекции различной локализации способны значительно ухудшать функцию почечного аллотрансплантата (ПАТ) непосредственно при развитии инфекционного процесса, а также инициировать острое отторжение, повышать активность хронического отторжения и ухудшать долгосрочный прогноз выживаемости трансплантатов и реципиентов [5].
В свою очередь нарушенная функция ПАТ становится важным предиктором развития инфекционных осложнений в позднем посттрансплантационном периоде [6].
Кроме известных урологических осложнений ТП (стриктура мочеточника, острый пиелонефрит, гематома ложа трансплантата, гидронефроз, некроз мочеточника с формированием мочевого затека, пузырно-мочеточниковый рефлюкс с присоединением пиелонефрита, лимфоцеле) развитию ИМП также способствуют источник получения органа (трупный или живой донор), сроки восстановления функции ПАТ, вид протокола иммуносупрессии, мочеточниковые стенты и длительное использование уретральных катетеров [7]. Инфекции мочевыводящих путей также способны реактивировать цитомегаловирус (ЦМВ), который может стать причиной острого отторжения ПАТ [8]. Существует предположение, будто глобальная иммуносупрессия может ингибировать регуляторные механизмы, играющие важную роль в поддержании толерантности к чужеродному антигену [9]. В связи с этим разработка и внедрение в клиническую практику новых методик, создающих основы для поддержания иммунологической толерантности, по сей день остаются главной стратегией в трансплантологии.
К одним из таких методов относится экстракорпоральная фотохимиотерапия (ЭФХТ), которая зарекомендовала себя как эффективный метод предупреждения и лечения отторжения при трансплантации сердца, легких, печени и почек. Известны результаты нескольких исследований, где курсы ЭФХТ были с успехом использованы для купирования устойчивых эпизодов отторжения [10, 11]. Имеются также единичные публикации о применении ЭФХТ в качестве профилактики острого отторжения ПАТ [12].
Результаты применения ЭФХТ после ТП больными хроническим гломерулонефритом не выявили увеличения частоты развития ИМП [13]. Однако в отечественной и зарубежной литературе не встречается публикаций, посвященных влиянию ЭФХТ на частоту ИМП у наиболее скомпрометированной группы больных, причиной хронической болезни почек (ХБП) у которых были урологические заболевания. На фоне сформированной у пациентов за долгие годы болезни толерантности ко многим классам антибактериальных препаратов и высокой устойчивости внебольничных штаммов микроорганизмов, вызывающих ИМП, к широко применяемым препаратам применение иммуносупрессии, в том числе ЭФХТ, может сопровождаться тяжелыми гнойно-септическими и инфекционными осложнениями.

В связи с вышесказанным целью данного исследования стало изучение эффективности экстракорпоральной фотохимиотерапии в качестве предупреждения отторжения почечного аллотрансплантата в сочетании со снижением частоты инфекционных осложнений у урологических больных.
Материалы и методы. В исследование вошли 48 пациентов, которые были реципиентами парных трансплантатов от 24 доноров. Основную группу составили 14 мужчин и 10 женщин в возрасте 40,4±11,2 года, которые получали ЭФХТ, группу сравнения – 13 мужчин и 11 женщин в возрасте 39,1±12,1 года. Длительность заместительной почечной терапии перед ТП в основной группе составила 23,2±8,2 мес., в группе сравнения – 24,6±7,4. Индекс совместимости доноров и реципиентов в основной группе составил 8 (4; 13), в группе сравнения – 9 (5; 13).
Критерии включения: ХБП урологической этиологии, возраст 18–60 лет, адекватный сосудистый доступ, отсутствие аллергии на 8-метоксипсорален и продукты цитрата, систолическое АД не ниже 90 мм рт.ст. на момент рандомизации. Исключали пациентов с сахарным диабетом, фоточувствительностью, эпизодами ИМП в течение 6 мес. до ТП, повторной ТП, предсуществующими антителами и другими факторами повышенного иммунологического риска.
Причиной ХБП в двух группах больных служили практически идентичные урологические заболевания: хронический пиелонефрит (15 и 17 пациентов основной группы и группы сравнения соответственно), поликистоз почек (4 и 5 пациентов соответ-ственно), гипертоническая нефропатия в сочетании с инфравезикальной обструкцией (2 пациента основной группы), мочекаменная болезнь (2 пациента основной группы и 1 – группы сравнения), аномалия развития мочеполовой системы (по 1 пациенту в каждой группе).
Больным пиелонефритом выполняли нефрэктомию до или одномоментно с ТП при условии отсутствия эффекта от антибиотикотерапии. Показанием к удалению поликистозных почек считали резкое увеличение их размеров, что препятствует пересадке трупной почки в подвздошную область, наличие гематурии, частые атаки пиелонефрита, разрывы кист, наличие конкрементов, постоянные боли в области поликистозной почки. Шести больным перед ТП была выполнена односторонняя нефрэктомия, 3 – поэтапная бинефрэктомия. Из двух больных гипертоническим нефросклерозом и инфравезикальной обструкцией одному во время ТП наложена эпицистостома, ликвидированная после бужирования стриктуры задней уретры, второму выполнена трансуретральная резекция предстательной железы. Обе операции проведены в отделении урологии МОНИКИ.
Процедуры ЭФХТ начинали с 4-х суток и с постепенным увеличением интервалов завершали на 180-е сутки после ТП. Методика заключалась в экстракорпоральной сепарации и накоплении 40–70 мл концентрата мононуклеарных клеток на аппарате Haemonetics, который подвергали воздействию ультрафиолета при длине волны 380–420 нм и после 90 мин инкубационного периода при 37°С реинфузировали пациенту. В качестве фотосенсибилизатора использован аммифурин в дозе 1 мг/кг, который пациент принимал за 2 ч до процедуры.
Оценивали частоту основных зарегистрированных событий в обеих группах наблюдения в течение 4 лет после ТП. Наличие или отсутствие отторжения трансплантата, хронической трансплантационной нефропатии (ХТН) или гломерулосклероза диагностировали с помощью биопсии трансплантата, проведенной пациентам обеих групп на 30-е и 180-е сутки после ТП или при наличии клинических и лабораторных признаков дисфункции трансплантата. Гистологическое исследование биопсийного материала проведено в соответствии с классификацией Banff 2007 г. Оценивали частоту инфекций мочевыводящих путей, ЦМВ-инфекции и их влияние на количество госпитализаций пациентов в течение 4 лет, а также выживаемость трансплантата и реципиента; приведены наиболее показательные отличия основной группы от группы сравнения в скорости клубочковой фильтрации и протеинурии на 180-е сутки после ТП.
На основании анализа количества клеток, экспрессирующих коактивационные молекулы CD28, и плотности коэкспрессии их на наивных лимфоцитах (MFI) на 4-е и 30-е сутки после ТП судили о возможности формирования иммунологической толерантности к антигенам донорского органа методом экстракорпоральной фотохимиотерапии.
 Статистический и корреляционный анализы проведены с использованием программы Statistica v.8. Определена выживаемость пациентов, продолжительность жизни до ИМП построением кривых по Каплану–Мейеру.
Статистический и корреляционный анализы проведены с использованием программы Statistica v.8. Определена выживаемость пациентов, продолжительность жизни до ИМП построением кривых по Каплану–Мейеру.
Результаты. Инфекции мочевыводящих путей. Учтены следующие формы инфекций:
- пиелонефрит ПАТ. Диагноз поставлен на основании клинических данных и результатов лабораторных, а также инструментальных методов исследования;
- пиелонефрит собственных почек, в том числе поликистозно измененных. Учтены как первичная атака пиелонефрита, так и обострение хронического пиелонефрита;
- инфекции, связанные с несостоятельностью уретероцистонеоанастомоза или некрозом мочеточника, осложненные экстравазацией мочи, стриктуры мочеточника, гидронефроз ПАТ;
- ЦМВ-инфекция, причем учтены как бессимптомная виремия, так и инфекция, потребовавшая стационарного лечения.
Медиана срока наблюдения составила 28 (10,45; 44,5 мес). На момент проведения исследования у 2 пар реципиентов срок после ТП составил 1 год, у 9 – 2, у 4 – 3 и у 9 пар – 4 года. Три пациента группы сравнения выбыли из исследования по причине трансплантатэктомии в раннем послеоперационном периоде (рецидивирующий пиелонефрит ПАТ, острое отторжение, тромбоз вены ПАТ), 1 реципиент группы сравнения – через 1 год после ТП ввиду трансплантатэктомии (фокально-сегментарный гломерулосклероз по данным биопсии) и 1 пациент группы сравнения умер в результате развившейся на фоне усиленной иммуносупрессии пневмоцистной пневмонии (табл. 1).
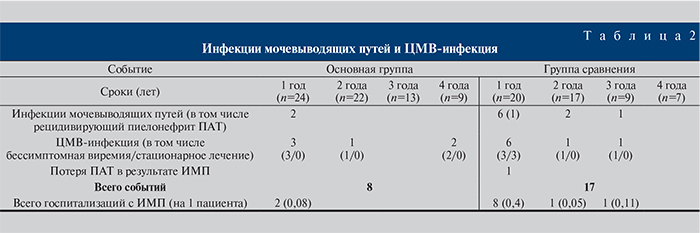
Сравнительный анализ показал, что абсолютное большинство случаев ИМП (17) имело место в контрольной группе, тогда как в основной группе клинически незначимый пиелонефрит ПАТ констатирован в 2 наблюдениях (табл. 2).
Важно, что у 1 пациента основной группы бессимптомная бактериурия стала проявлением основного заболевания – аномалии развития мочеполовой системы. При МСКТ выявлен двусторонний пассивный пузырно-мочеточниковый рефлюкс. Через 1 мес. после ТП больной выполнена билатеральная нефрэктомия. В дальнейшем эпизодов пиелонефрита не было, удовлетворительная функция ПАТ сохраняется в течение 4 лет. Второй случай пиелонефрита ПАТ в основной группе был обусловлен осложнениями цистоскопического извлечения стента мочеточника.
В бактериальных посевах мочи на 5-е сутки выявлены Еnterococcus spp. 103, на 12-е сутки – Enterobact. spp. 103, E. facium 104, через 3 мес. – отсутствие роста бактерий. Функция ПАТ до сих пор расценивается как удовлетворительная, эпизодов пиелонефрита ПАТ не было, в госпитализации пациент за 4 года не нуждался.
В свою очередь в группе сравнения наблюдали 9 случаев пиелонефрита. У 1 больного на 3-и сутки после ТП развился мочевой затек, обусловленный некрозом мочеточника. В бактериальных посевах мочи выявлен рост Сandida albicans 105, Pseudomonas aeruginosa 105, Klebsiela pneumoniae 105. На 5-е сутки пациенту выполнено реконструктивное оперативное вмешательство на мочеточнике. Через 1 мес. диагностирован рецидивирующий пиелонефрит ПАТ с ухудшением функции почки и развитием гидронефроза ПАТ, в бактериальном посеве – дрожжевые грибы 105, Кlebsiela pneumoniae 105, больной перенес очередную ревизию ложа ПАТ, в ходе которой обнаружены гематома, некроз мочеточника; выполнена очередная реконструктивная операция. Пациент выписан с улучшением функции ПАТ, однако менее чем через год госпитализирован с жалобами на слабость, боли в области ПАТ, повышение температуры тела до 38°С, рост уровня креатинина до 220 нг/мл. По данным УЗИ установлен гидронефроз ПАТ, выполнена трансплантатэктомия.
У 4 реципиентов основной группы и 8 – группы сравнения в крови выявлена ДНК ЦМВ. При этом у всех реципиентов основной группы инфекция протекала в виде бессимптомной виремии. У 3 реципиентов группы сравнения отмечены клинические проявления ЦМВ-инфекции, потребовалась госпитализация. В 2 случаях констатирована дисфункция ПАТ, а при морфологическом исследовании биоптата выявлены пограничные изменения. Проведено лечение (ганцикловир, пульс-терапия метилпреднизолоном, иммуноглобулин) с положительной динамикой. У 1 реципиента на фоне ЦМВ развилась тяжелая панцитопения, в связи с чем потребовались отмена микофеноловой кислоты и введение гранулоцитарно-макрофагального колониестимулирующего фактора роста.
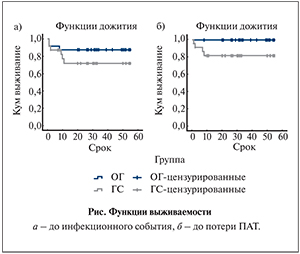
Как видно из табл. 2, доля пациентов группы сравнения, у которых ИМП были причиной госпитализации, в различные сроки анализируемого периода варьировалась от 5 до 40%. Причем основная масса госпитализаций приходится на первый год после ТП (8 эпизодов). Число пациентов, у которых ожидаемое событие, т.е. развитие ИМП, не произошло к определенному моменту времени, достоверно не различалось – 87,5 и 75% в основной группе и группе сравнения соответственно (Log Rank (Mantel-Cox)=0,231; рисунок, а).
Интересными представляются результаты сравнительного анализа выживаемости трансплантата (рисунок, б), показатели которой составили 100 и 83,3% в основной группе и группе сравнения соответственно (Log Rank (Mantel-Cox)=0,036). Три пациента группы сравнения перенесли трансплантатэктомию в течение первого года после ТП по причинам рецидивирующего пиелонефрита ПАТ, острого отторжения ПАТ и тромбоза вены ПАТ, 1 трансплантатэктомия выполнена через год после ТП (фокально-сегментарный гломерулосклероз). В функцию дожития не включен пациент контрольной группы, который умер в результате развившейся на фоне усиленной иммуносупрессии пневмонии.
При анализе лабораторных данных через 6 мес. после ТП отмечено достоверное преимущество основной группы по показателям скорости клубочковой фильтрации (56,7±6,2 против 41,5±5,1 мл/мин, р<0,001) и протеинурии (0,55±0,08 против 1,48±0,54 г/л, р<0,001).
Таким образом, подтверждается общеизвестный факт, согласно которому развитие ИМП в течение первых 5 лет после ТП служит фактором риска гибели ПАТ. Частично большее количество случаев полной утраты функции ПАТ можно объяснить статистически значимо большим числом кризов отторжения в группе контроля (4 случая), подтвержденных биопсией, и полным отсутствием такововых у пациентов, получавших ЭФХТ. В связи с этим перспективным остается внедрение ЭФХТ при ТП, способной предупредить развитие отторжения без увеличения риска ИМП у больных урологического профиля, что, безусловно, улучшит результаты ТП для данной категории больных.
Результаты иммунологических исследований.
В результате иммуносупрессии на 4-е сутки количество клеток, экспрессирующих коактивационные молекулы CD28, было почти в 2 раза меньше, чем в норме. При этом плотность коэкспрессии их на наивных лимфоцитах (MFI) уменьшалась пропорционально их количеству (r=0,58, p=0,01). Через 30 дней после ТП в группе сравнения не происходило существенного изменения количества клеток, экспрессирующих молекулы коактивации (57,7±18,2% и 52,7±23,2%; р>0,05) и MFI (22,7±6,0 и 19,6±7,0 Е; р>0,05). В то же время в основной группе отмечено статистически значимое уменьшение количества таких клеток (с 57,7±18,2 до 34,5±11,4%; р<0,05) и MFI (c 22,7±6,0 до 16,8±5,1 ЕД; р<0,05). Это свидетельствует об универсальности и более точной направленности ЭФХТ на ингибирование коактивационных молекул, через которые реализуется второй сигнальный путь активации Т-клеточного рецептора.
Заключение. В ходе настоящего исследования продемонстрировано, что ЭФХТ – это эффективный способ предупреждения отторжения ПАТ в сочетании с уменьшением частоты ИМП, что наиболее актуально для больных с урологической этиологией ХБП. Применение ЭФХТ после ТП сопровождается стабильной и с течением времени улучшающейся функцией ПАТ, что подтверждено лабораторными данными и результатами протокольной биопсии. Экстракорпоральная фотохимиотерапия позволяет селективно блокировать второй путь коактивации Т-хелперов и супрессоров, может служить ценным дополнением к стандартному протоколу иммуносупрессивной терапии, обеспечивая индукцию антигенспецифического ингибирования эффекторных Т-клеточных функций и формирование иммунологической толерантности к антигенам донорского органа.



