Введение. В литературе представлено немало публикаций, посвященных изучению мочевой инфекции как патогенетического фактора мочекаменной болезни (МКБ) [1–4]. При этом появляются отдельные сообщения, указывающие на специфическое камнеобразуюшее действие некоторых микроорганизмов, которые не участвуют в воспалительных процессах и не выделяются обычными способами культивирования [5–8].
В последнее время в литературе широко дискутируется вопрос о фенотипическом свойстве микробов проявлять «чувство кворума» («quorum sensius») или феномен «кооперативной чувствительности». «Чувство кворума» реализуется микробами в образовании биопленок, синтезе факторов патогенности, синтезе антибиотиков, в биолюминисценции [9–11]. Языком общения микробов между собой служат молекулы лактонов, пептидов, хинолонов и фурановых соединений [12–15].
Применительно к микроорганизмам данный феномен реализуется через три последовательных этапа: продукции микробами внеклеточных сигнальных молекул (автоиндукторов – коротких пептидов или гомосерин-лактонов), детекции этих молекул теми же и соседними микробами, генерации ответной реакции. Аутокаталитическое «раскручивание» этого цикла и составляет суть феномена, обозначаемого «quorum sensius» [14].
Феномен «кооперативной чувствительности» интересен потому, что предполагает возможность хромато-масс-спектрометрической индикации сигнальных низкомолекулярных соединений, обеспечивающих «коллективное агрессивное поведение» бактерий. Это лактоны, хинолоны, короткие пептиды, фурановые эфиры (фуранозил-диэфир бора и др.) [13, 15].
Цель исследования. Диагностическая оценка роли инфекционного фактора в патогенезе развития МКБ с помощью методов хромато-масс-спектрометрического анализа.
Материалы и методы. Материалом для исследования послужили клинико-лабораторные данные 316 пациентов, страдающих МКБ и проходивших стационарное лечение в урологическом отделении городской клинической больницы им. С.С. Юдина (ГКБ № 7) с февраля 2005 по январь 2015 г.
Всем больным проведено комплексное клиническое обследование, включившее лабораторные (исследование гематологических и биохимических показателей крови, клиническое и бактериологическое исследование мочи), а также современные хроматографические и масс-спектрометрические способы анализа мочи и крови. Комплекс лабораторных исследований осуществлен как в период стационарного пребывания больных, так и в ходе амбулаторно-поликлинического наблюдения.

Методические подходы к диагностике и патогенезу мочекаменной болезни выбраны нами с целью оценки механизмов развития уролитиаза – определения оптимальных условий развития в эпителиальной клетке нефрона почечно-канальцевого ацидоза (ПКА):
- во-первых, оценка кислородного статуса крови с использованием измеренных и расчетных параметров электрохимического анализа рН и газов крови в сочетании с многоволновой гемоксиметрией. Использование расчетных показателей так называемой доступности кислорода в сочетании с многоволновой гемоксиметрией позволяет определять ранние стадии развития процессов гипоксии или относительной гипероксии с образованием активных форм кислорода с последующим повреждающим воздействием на клеточные мембраны;
- во-вторых, оценка энергетических возможностей организма, согласно развитию энергозатратных канальцевых процессов, когда при патологических состояниях почек существенно возрастает поглощение кислорода. Образование плазмамембранного короткоживущего сигналтрансдуцирующего аденозинрибонуклеотид-5-трифосфата служит показателем активного энергозатратного метаболизма эпителиальной клетки нефрона;
- в-третьих, определение инфекционного фактора по уровню содержания активаторов «кооперативной чувствительности» микроорганизмов – лактонов, хинолонов и фурановых эфиров бора.
В случае выявления у больных лейкоцитурии свыше 4000 в 1 мл (по Нечипоренко) с целью выделения возбудителя и количественного определения степени бактериурии выполняли бактериологическое исследование мочи с определением чувствительности к антибактериальным препаратам. У всех больных независимо от степени лейкоцитурии выполнялся бактериологический посев мочи с определением титра бактериурии и характера микрофлоры. В 27,5% случаев бактериальный рост отсутствовал. Бактериурия в титре до 105 КОЕ/мл выявлена у 159 (50,3%) пациентов, в титре 105 КОЕ/мл и более (истинная бактериурия) – у 70 (22,2%). В большинстве наблюдений у 71 (31%) выявлена Escherichia coli, у 35 (15,3%) – Staphylococcus aureus. Отсутствие бактериальной флоры в основном было свойственно пациентам с первичным характером жалоб и неотягощенным урологическим анамнезом. Высокие титры E. coli, S. aureus, а также смешанной флоры характеризовали группы пациентов с осложненными формами МКБ.

Определение уровня литогенных веществ, летучих жирных кислот, фенолов и крезолов проведено с использованием хромато-масс-спектрометрической системы Hewlett–Packard с газовым хроматографом и масс-селективным детектором. Оценка уровня летучих жирных кислот (пропионовая, масляная, валериановая, капроновая и др.), фенолов и крезолов в моче проведена по методике B. M. Mitruka в модификации Л. Л. Шимкевича и В. Г. Истратова с экстракцией диэтиловым эфиром летучих компонентов прямым вводом в испаритель газового хроматографа. Идентификация соединений осуществлена с помощью химической станции, работающей в режиме Microsoft Windows.
Для оценки диагностической значимости разработанных хроматографических критериев использованы унифицированные критерии пригодности лабораторных тестов для диагностики определенной формы патологии, примененные R. Galen и В. В. Меньшиковым, основанные на решении теоремы Байеса (расчет вероятности распределения результатов исследования) [16, 17].
Расчет чувствительности, специфичности, положительной и отрицательной предсказуемости проведен по следующим формулам [18]:
- чувствительность=ИП/(ИП+ЛО);
- специфичность=ИО/(ИО+ЛП);
- положительная предсказуемость=ИП/(ИП+ЛП);
- отрицательная предсказуемость=ИО/(ИО+ЛО),
где
- ИП – истинно положительные наблюдения;
- ИО – истинно отрицательные наблюдения;
- ЛП – ложноположительные наблюдения;
- ЛО – ложноотрицательные наблюдения.
Диагностическая чувствительность теста (ДЧ) представляет собой процентное выражение частоты истинно положительных результатов теста больных данной болезнью:
ДЧ=ИП/Б х 100%.
Диагностическая специфичность (ДС) представляет собой процентное выражение частоты истинно отрицательных результатов теста у лиц, не страдающих данной болезнью:
ДС=ИО/НБ х 100%.
Диагностическая предсказуемость теста положительных результатов (ДП+) выражается процентным соотношением истинно положительных результатов к общему числу положительных результатов:
ДП+ = ИП/ИП+ЛП х 100%.
Диагностическая предсказуемость теста отрицательных результатов (ДП-) выражается процентным соотношением истинно отрицательных результатов к общему числу отрицательных результатов:
ДП- = ИО/ЛО+ИО х 100%.
Результаты. Все пациенты были разделены на три группы. В 1-ю группу вошли 167 пациентов, госпитализированных в стационар с диагнозом МКБ, впервые возникшим приступом почечной колики. Ко 2-й группе со сложными формами МКБ мы отнесли 98 пациентов с множественными камнями почек, коралловидными конкрементами, одновременным наличием камня почки и мочеточника, камнями единственной почки с латентным течением хронического пиелонефрита. В 3-ю группу был включен 51 пациент с камнями различной локализации мочевыводящего тракта, в активной фазе пиелонефрита, сопровождающейся лихорадкой и выраженными лабораторными изменениями (осложненное течение МКБ).
В периферической крови пациентов 1-й группы нами определены показатели кислотно-основного равновесия крови и кислородного статуса (табл. 1).
Полученные результаты свидетельствуют о развитии метаболического компенсированного ацидоза с изменениями рН крови, рСО2, содержания оснований (ВЕ), SvО2 и РvО2, а также одного из основных показателей гипоксии – лактата.
В периферической крови пациентов 2-й и 3-й групп констатирован стойкий метаболический ацидоз, в конечном итоге приводящий к развитию субкомпенсированного и декомпенсированного ПКА соответственно (табл. 2).
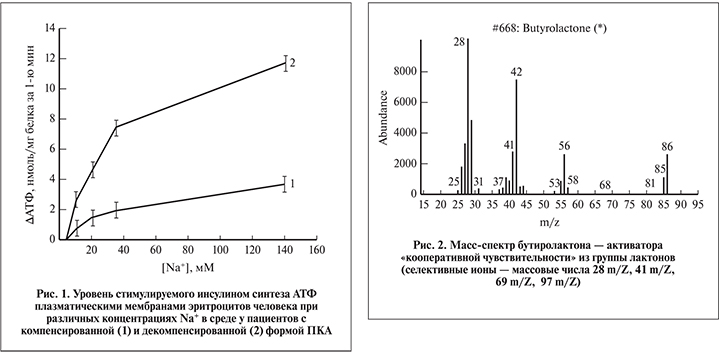
Зная, что плазматическая мембрана человека является натриевой мембраной, мы оценили участие возможных АТФаз в сигналстимулируемом плазмамембранном синтезе АТФ (Na+/K+-АТФаза). Повышение концентрации Na+ стимулировало синтез АТФ, максимум которого наблюдался при физиологической концентрации Na+ в среде (рис. 1).
Увеличение уровня синтеза плазмамембранного короткоживущего сигналтрансдуцирующего АТФ у больных декомпенсированной формой ПКА свидетельствовало об активности энергозатратного метаболизма эпителиальной клетки нефрона.
Наряду с детальным изучением мочи нами проведен анализ активаторов «кооперативной чувствительности» в сыворотке крови больных уролитиазом.
С этой целью хроматографически идентифицированы активаторы, соответствующие следующим классам соединений:
- лактоны – бутиролактон, альдонолактоны, пропинолактон, бутаноиллактон и 3-оксододекоиллактон;
- хинолоны – этилхинолон, дигидроизохинолон, хинонимины, тетрагидро-изохинолон;
- фурановые эфиры – тетрагидрофуран, 2-фуранметанамин, 2-фуранметанол, фуракозилдиэфир бора.
Для определения специфичности тестов хроматографической индикации сигнальных соединений использованы две группы контроля. Первой группой контроля были чистые бульонные культуры грамотрицательных бактерий Pseudomonas aeruginosa с титром >107 КОЕ/мл, грамположительных бактерий S. aureus с титром >107 КОЕ/мл, а также смесь грамположительных и грамотрицательных бактерий с титром каждой культуры в смеси 104 КОЕ/мл (т.е. суммарно более 107 КОЕ/мл; табл. 3).
Вторым контролем служила кровь больных уролитиазом без выраженных инфекционных осложнений (пациенты с компенсированной и субкомпенсированной формами ПКА; табл. 4).
В зависимости от типа оксикислот, образующих лактоны, различают β-, γ-, δ- и ε-лактоны. На основании характеристических ионов лактонов нами был проведен анализ сыворотки крови больных декомпенсированной формой ПКА (табл. 5).

Индикация лактонов проведена хромато-масс-спектрометрическим методом, а также методами высокоэффективной жидкостной хроматографии. На рис. 2 представлен масс-спектр активатора «кооперативной чувствительности».
В группе больных осложненными формами МКБ выявлены хинолоны, группы дигидроизохинолонов, а также субъединицы хинолонов и метаболиты группы хинониминов (табл. 6, рис. 3).
Наряду с определением концентраций лактонов и хинолонов в сыворотке больных 3-й группы нами проведен анализ содержания фурановых соединений и их субъединиц.
Концентрация фуранозил-диэфира бора в исследуемой группе варьировалась от 0,002 до 0,004 ммоль/л (табл. 7, рис. 4).
Пороговые значения содержания активаторов «кооперативной чувствительности» составили для больных осложненным течением МКБ для лактонов 0,011±0,002 ммоль/л, для хинолонов – 0,008±0,0009, для фурановых эфиров – 0,006±0,0007 ммоль/л.
При этом уровень содержания активаторов «кооперативной чувствительности» у больных той же группы суммарно составил для лактонов 0,026±0,0013ммоль/л, для хинолонов – 0,015±0,0012, для фурановых эфиров – 0,018±0,0010 ммоль/л. Таким образом, пороговые значения превышены для лактонов в 2,36 раза, для хинолонов – в 1,87, для фурановых эфиров – в 3,0 раза, что свидетельствовало о степени выраженности сопутствовавшего калькулезного пиелонефрита.
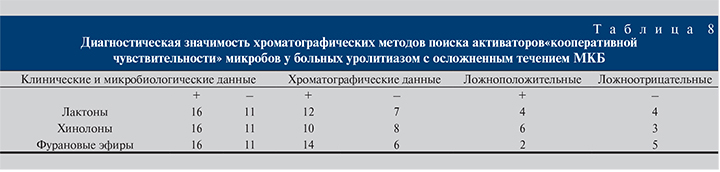
В табл. 8 представлены данные о диагностической значимости хроматографической индикации сигнальных соединений на основании унифицированных критериев пригодности лабораторных тестов.
Диагностическая значимость хроматографических методов поиска сигнальных соединений активаторов «кооперативной чувствительности» микробов у больных осложненным течением МКБ и, соответственно, декомпенсированной формой ПКА составила:
- для лактонов: ДЧ – 66,6%, ДС – 42,8%, ДП положительная – 66,6%, ДП отрицательная – 42,8%;
- для хинолонов: ДЧ – 70,0%, ДС – 25,0%, ДП положительная – 40,0%, ДП отрицательная – 62,5%;
- для фурановых эфиров: ДЧ – 64,2%, ДС – 66,6%, ДП положительная – 85,7%, ДП отрицательная – 16,6%.
Обсуждение. Оценивая результаты проведенного обследования, мы склонны считать, что процесс камнеобразования возможен в условиях высокого уровня литогенных веществ, обусловливающих метастабильное состояние мочи, готовое к агрегации кристаллических структур.
По нашему мнению, с целью улучшения качества диагностических и лечебно-профилактических мероприятий для больных с различным типом камнеобразования целесообразно использование хромато-масс-спектрометрического анализа, позволяющего определять приоритетные клинико-лабораторные показатели.
Для неосложненных форм МКБ характерно высокое содержание в моче литогенных веществ при умеренной активности активаторов камнеобразования и отсутствии клинически значимого роста микрофлоры в анализах мочи.
Течение сложных форм МКБ характеризуется высоким содержанием не только литогенных веществ, но и активаторов камнеобразования, что в совокупности с определением титра бактериурии и вида возбудителя позволяет диагностировать степень активности сопутствующего воспалительного процесса в отсутствие клинических проявлений пиелонефрита.
Хромато-масс-спектрометрическая картина у пациентов с осложненным течением МКБ характеризуется крайне высоким уровнем литогенных веществ и степенью участия активаторов процесса камнеобразования. Немаловажной особенностью больных этой группы служит наличие в моче высоких титров возбудителей госпитальной инфекции. Оценивая возможности патогенетической терапии, целесообразно прежде всего решить вопрос об эффективной антибактериальной терапии пиелонефрита с дальнейшим привлечением препаратов, стабилизирующих функцию почек. Только после нормализации и стабилизации состояния функции почек можно решать вопрос об адекватной терапии кислотно-основного состояния почек и нормализации метаболических нарушений.
Заключение. Полученные с помощью методов хроматографической индикации сигнальных соединений данные о роли инфекционного фактора в генезе развития МКБ позволили сделать вывод о возможности использования показателей активаторов «кооперативной чувствительности» микробов у больных с различными формами уролитиаза для оценки тяжести течения патологического процесса.



