Введение. Почечно-клеточный рак (ПКР) составляет около 2–3% от всех злокачественных опухолей
[1–2]. Особенностью ПКР является то, что у 4–10% больных он может сопровождаться формированием
опухолевых венозных тромбов с распространением последних по почечной и нижней полой вене (НПВ)
вплоть до правого предсердия [3, 4].
Оперативное удаление опухолевого тромба из НПВ связано с риском развития послеоперационных осложнений [5, 6]. По данным различных авторов, операционная смертность варьируется от 1,4 до
13%, а общая частота послеоперационных осложнений достигает 30–60% [3, 7].
Пятилетняя выживаемость после радикальной нефрэктомии с тромбэктомией из НПВ у больных
ПКР без отдаленных метастазов составляет 32–64% [7, 8]. При наличии отдаленных метастазов и метастазов в лимфатические узлы результаты лечения ухудшаются. Комбинация активной хирургической тактики с системной противоопухолевой терапией больных опухолевыми тромбами НПВ позволяет повысить показатели выживаемости. Цель исследования – изучить результаты комбинированного лечения пациентов с ПКР после нефрэктомии с тромбэктомией из НПВ.
Материалы и методы. С 2005 по 2011 г. нефрэктомия с тромбэктомией из НПВ произведена 32 больным. В исследование были включены пациенты только с протяженными (более 3–4 см) II–IV уровня [7] тромбами НПВ (стадии Т3b и Т3с) согласно новой редакции классификации TNM 2009 г. [9]. Среди них мужчин было 21 (65,6%), женщин – 11 (34,4%). Возраст больных составил от 35 до 76 (58,3±10,1) лет.
Больных с благоприятным прогнозом по критериям MSKCC было 12 (37,5%), с промежуточным – 14
(43,7%) и с неблагоприятным – 6 (18,8%). Статус по шкале Карновского более 90% определен для 24 (75%) больных, 80% – для 7 (21,8%), 70% – для 1 (3,1%).
В 23 наблюдениях тромб исходил из опухоли правой почки, в 9 – из опухоли левой почки. Стадия
Т3b была диагностирована у 26 (81,2%) больных: протяженность тромба в среднем составила 5,1±1,75
см, стадия Т3с – для 6 (18,8%) пациентов: протяженность тромба была в среднем 14,8±0,98 см (рис. 1).
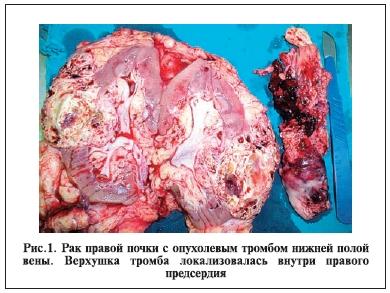
Светлоклеточный вариант ПКР выявлен у 29 (90,6%) больных, папиллярный – у 1 и смешанный – у 2 пациентов. В 9 (28,1%) наблюдениях опухоли имели умеренную (G2) степень дифференцировки, в 23 (71,9%) – низкую (G3). Только у 3 (9,6%) больных не было метастазов в лимфоузлах и отдаленных метастазов. Метастазы в регионарных лимфоузлах выявлены у 16 (50%) пациентов. Отдаленные метастазы (в одном или в нескольких органах) диагностированы у 24 (75%) пациентов: в легких – у 17 (56,3%), в костях – у 5 (15,6%), в печени – у 5 (15,6%), в надпочечнике – у 2 (6,3%) и в головном мозге – у 1 (3,1%) больного.
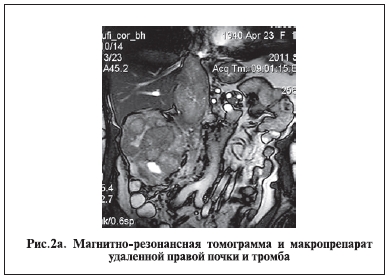
Для планирования хода и объема операции, выбора адекватного доступа важное значение имеет точная топическая диагностика локализации и протяженности тромба. Магнитно-резонансная томография (рис. 2), ультразвуковое исследование с цветным допплеровским картированием (рис. 3) и мультиспиральная компьютерная томография позволяют с высокой точностью определить наличие тромба в НПВ, его протяженность, размеры, состояние кровотока по НПВ и коллатералям [10, 11].

Во всех наблюдениях нефрэктомию с тромбэктомией производили из лапаротомных доступов типа Мерседес и Шеврон. Эти доступы позволяют успешно осуществлять тромбэктомию из НПВ при тромбах, исходящих как из правой, так и из левой почки. При наддиафрагмальных тромбах выполняли диафрагмотомию и перикардотомию по М. И. Давыдову [3]. Вне зависимости от стороны поражения операцию начинали с мобилизации двенадцатиперстной кишки по Кохеру, выделения НПВ и почечных вен. Предварительную регионарную лимфаденэктомию выполняли при наличии увеличенных лимфоузлов для улучшения манипуляций на магистральных сосудах и для ранней перевязки почечной артерии. После удаления почки лимфаденэктомию выполняли в расширенном варианте. У трех больных нефрэктомию с тромбэктомией сочетали с атипичной резекцией печени. Для реинфузии крови применяли аппарат Cell-Caver.
Послеоперационные осложнения были разделены на группы в соответствии с классификацией Клавиен–Диндо [12].
После нефрэктомии с тромбэктомией из НПВ 19 (63,3%) больным была назначена имм-нотерапия
интерфероном α2, трем из них – в адъювантом режиме. В 11 (36,7%) наблюдениях назначена таргетная терапия ингибиторами тирозинкиназ.
Выживаемость больных изучали с помощью метода Каплана–Майера. Статистический анализ проводили с использованием лицензионного пакета программ для STADIA 4.5 и STATISTICA/W (лицензия № 105, владелец НижГМА). Результаты обрабатывали методами вариационной статистики с использованием критерия Стьюдента, а также с применением программного обеспечения StatEx-2004.2 и электронных таблиц Excel с достоверной вероятностью (р<0,05).
Результаты. Методичное и деликатное выполнение всех этапов операции позволило избежать интраоперационных осложнений и неконтролируемых кровотечений. Интраоперационная кровопотеря составила в среднем 842 мл (минимальная 250 мл, максимальная 4000 мл). При корреляционном анализе получен низкий коэффициент (r=0,3) зависимости объема кровопотери от протяженности тромба НПВ. Основная кровопотеря возникала на этапе удаления пораженной
опухолью почки из резко расширенных коллатеральных вен забрюшинного пространства.
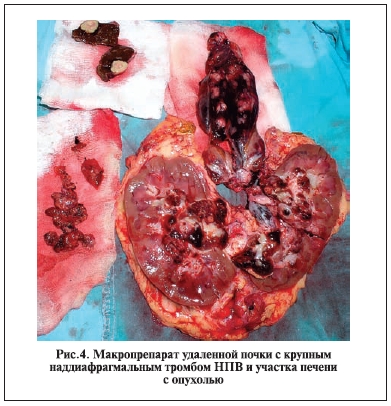
У 18 (56,3%) больных осложнений не было. У одного пациента установлено осложнение I степени (анемия, корригируемая препаратами железа). Вторая степень осложнений зафиксирована у 10 (31,3%) пациентов, им после операции проводилась гемотрансфузия. Осложнение IIIА степени развилось у 1 (3,1%) больного 35 лет, которому были выполнены нефрэктомия с тромбэктомией и резекция печени (опухоль более 10 см, длина тромба 15 см, верхушка тромба локализовалась в правом предсердии; рис. 4). До операции у больного был асцит и гидроторакс. После операции данному пациенту потребовались плевральные пункции и дренирование перикарда по поводу гемоперикарда под местной анестезией.
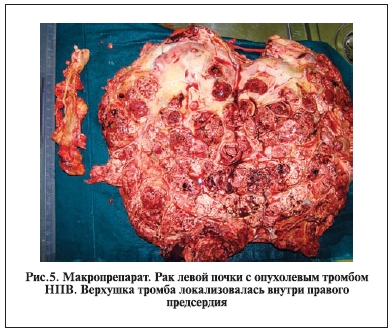
Осложнение IIIВ степени (ишемический некроз и перфорация нисходящей ободочной кишки) диагностировано также у 1 (3,1%) больного после левосторонней нефрэктомии с резекцией брыжейки ободочной кишки и удаления наддиафрагмального тромба НПВ (рис. 5). Данному пациенту были выполнены релапаротомия и колостомия. В последующем колостома была закрыта, после операции пациент живет уже 3,5 года. Осложнений IV степени не было. В раннем послеоперационном периоде умер 1 (3,1%) пациент (V степень), причиной смерти стала тромбоэмболия легочной артерии.
При корреляционном анализе установлена высокая (r=0,7) зависимость развития послеоперационных
осложнений от размеров тромба, объема кровопотери (r=0,6) и низкая – от размеров опухоли (r=0,4). В то же время нами не выявлено зависимости развития осложнений от возраста больных (r=0,1), статуса по шкале Карновского (r=0,0), статуса по MSKCC (r=0,0).
Все остальные пациенты (31 человек) после операции прожили более 6 месяцев. Средний показатель общей выживаемости определен на уровне 22,1±2,8 мес (медиана 17 мес). Вероятность выживания до 5-летнего рубежа составила 36%, до 3-летнего – 38%. Трехлетняя выживаемость при N0 (69%) оказалась достоверно выше, чем при N1–2, – 25% (р=0,014). Вероятность выживания до трехлетнего рубежа у пациентов, получавших иммунотерапию, не превышала 37,1%, а в группе таргетной терапии составила 50% (р=0,04).
Выявлена статистически достоверная разница выживаемости больных в зависимости от критериев MSKCC: при благоприятном прогнозе – 45%, при промежуточном – 34% и при неблагоприятном – 16% (р=0,0004). Выживаемость больных над- и поддиафрагмальными тромбами достоверно не различалась (р=0,14).
Обсуждение. Лечение больных ПКР, осложненным опухолевым тромбозом НПВ, до сих пор остается
сложной проблемой. Внедрение новых неинвазивных методов топической диагностики опухолевого тромба [10, 11], совершенствование оперативной и анестезиологической техники расширили возможности оказания помощи больным с различной протяженностью опухолевого тромба, что обусловило хорошие непосредственные результаты оперативного лечения [6, 13, 14]. Послеоперационная летальность составила 0–13%, частота осложнений – 6,7–60% [4–7, 14–16].
По нашим данным, летальность составила 3,1%, осложнения III–IV степеней по Клавиен–Дандо –
6,2%. Опыт клиники Мейо [5] в оперативном лечении опухолевых тромбов НПВ показал зависимость количества послеоперационных осложнений от протяженности тромба в НПВ: при уровне тромба 0 (почечная вена) осложнения возникли в 8,6% наблюдений; при уровне I (устье почечной вены) – в 15,2%, II (подпеченочный отдел НПВ) – в 14,1%, III (ретропеченочный отдел НПВ) – в 17,9%, IV (внутрипредсердный) – в 30,0%, р<0,001). Нами также выявлена высокая корреляционная зависимость частоты осложнений от размера тромба.
У значительного числа больных ПКР с опухолевым тромбом в НПВ имеются метастазы в регионарных лимфатических узлах – 26% и отдаленные метастазы – 54% [17]. По нашим данным, эти показатели
составили 50 и 75 % соответственно, чем и объясняется низкий показатель 5-летней выживаемости – 36%. Наличие метастазов негативно сказывается на отдаленных результатах нефрэктомии с тромбэктомией из НПВ [18, 19]. В нашей работе 3-летняя выживаемость оказалась достоверно выше при N0 69%, чем при N1–2, – 25% (р=0,014), что согласуется с результатами других исследований [15, 18, 20].
По данным литературы [5, 15, 17, 18], выживаемость больных опухолевыми тромбами НПВ категории T3b и T3c не различается, в то время как выживаемость пациентов при локализации тромба в почечной вене статистически достоверно выше. Нами также не было выявлено разницы в выживаемости больных ПКР стадий T3b и T3c.
Плохое прогностическое значение наличия опухолевого тромба в НПВ и относительно невысокие показатели выживаемости больных после оперативного лечения диктуют необходимость мультимодальной терапии ПКР [6, 17 20, 21]. В ранее проведенных исследованиях было показано преимущество нефрэктомии с тромбэктомией с послеоперационной иммунотерапией по сравнению лишь с оперативным лечением, только с иммунотерапией и без лечения [17]. В последнее время стали появляться работы, посвященные эффективному использованию таргетных препаратов в неоадъювантом [22, 23] и адъювантном режимах больными ПКР с опухолевым тромбом НПВ [24–26]. Результаты исследований демонстрируют преимущества таргетной терапии местно-распространенного и метастатического ПКР по сравнению с иммунотерапией.
Заключение. Нефрэктомия с тромбэктомией из НПВ ассоциируется с высоким риском развития периоперационных осложнений, частота и вид которых зависят в большей степени от размеров тромба и объема кровопотери. Совершенствование оперативной техники, анестезиологического и реанимационного пособий позволяют снизить число и тяжесть осложнений. У 90,4% больных ПКР с протяженными опухолевыми тромбами НПВ имеются метастазы в отдаленные органы и (или)
в регионарные лимфоузлы, что негативно отражается на выживаемости больных после проведенной нефрэктомии с тромбэктомией из НПВ. Системная таргетная терапия улучшает отдаленные результаты лечения этих больных. Факторами, влияющими на выживаемость, являются наличие лимфогенных метастазов, критерии прогноза поMSKCC. Стадии Т3b и Т3с распространения опухолевого тромба НПВ при почечно-клеточном не являются независимым прогностическим фактором.


