Введение
Проблемы гинекологии и урологии рассматривались вместе с древних времен. Так как у женщин мочевыводящие пути эмбриологически и анатомически тесно связаны с репродуктивной системой, возможно влияние заболеваний одной системы или хирургических вмешательств на ней на функцию другой. Н. Кelly считал, что гинекология и женская урология неразделимы. Основные исследования недержания мочи у женщин в XIX и начале XX вв. велись как урологами, так и гинекологами, что позволило более глубоко изучать данную проблему [1].
Одной из актуальных проблем климактерия являются урогенитальные расстройства, возникающие преимущественно через 2–5 лет после менопаузы. Они связаны с атрофическими процессами, развивающимися одновременно во влагалище и нижних мочевых путях, имеющих единое эмбриологическое происхождение и являющихся органами-мишенями половых гормонов [2].
И в настоящее время умы многих ученых и практических врачей занимает серьезная медицинская и социальная проблема на стыке двух специальностей (урологии и гинекологии) – недержание мочи у женщин. Такой повышенный интерес к этому весьма сложному и недостаточно изученному вопросу вызван высокой частотой распространения различных форм недержания мочи и то, что все большее количество больных не хотят мириться с этим заболеванием [3]. Недержание мочи – это заболевание, которое не представляет смертельной угрозы, тем не менее отрицательно сказывается на качестве жизни пациенток. Это состояние вызывает тяжкие эмоциональные страдания. Недержание мочи подавляющим образом влияет на психику, отягощает социальную жизнь. Когда количество одномоментно теряемой мочи или частота эпизодов ее непроизвольной потери достигают какого-то индивидуально критического уровня, жизнь женщины становится невыносимой [4].
Эстрогенный дефицит, возникающий в климактерии, способствует развитию атрофических процессов в урогенитальной сфере женщины, что приводит к появлению или усугублению проблемы недержания мочи [5].
Взаимосвязь между появлением недержания мочи и менопаузой была изучена в работе J. M. van Geelen, в которой учитывались менопауза, операции на органах малого таза и осложненные роды через естественные родовые пути [6]. Из всего этого только менопауза в значительной мере способствовала появлению недержания мочи у женщин в климактерии. По данным Rekers (1992), частота недержания мочи у женщин в хирургической менопаузе выше, чем у тех, у кого менопауза наступила физиологически [7]. По данным Доброхотовой (2000) [8], у женщин, перенесших гистерэктомию из-за нарушения кровоснабжения яичников биологическое, старение наступает раньше на 3–4 года. Автор связывает нарушение кровоснабжения яичников с таковым стероидогенеза в них и как следствие – более раннее угасание функции с более ранним развитием урогенитальных расстройств у этих женщин.
Большинство исследований показали, что появление и степень недержания мочи повышаются с возрастом. Исключение составили работы Jolleys (1988) [9] и Rekers (1992) [10]. По данным [9], частота встречаемости недержания мочи у женщин в постменопаузе ниже, чем у нормально менструирующих женщин.
В связи с интимностью вопроса и отсутствием доступной информации о проблеме инконтиненции многие женщины стесняются заявить о своем недуге. Кто-то просто не знает, что данная патология излечима, связывает недержание мочи с нормальным проявлением процесса старения и занимается самолечением, или просто приспосабливается к данной проблеме по мере своих возможностей.

Этиология и патогенез
Недержание мочи является ключевым симптомом расстройств тазового дна [11]. Удержание мочи как в состоянии покоя, так и при напряжении осуществляется, как полагают, взаимодействием трех механизмов:
- Сопротивлением в покое замыкательного аппарата мочевого пузыря. Замыкательный аппарат мочевого пузыря формируется из гладкомышечных волокон детрузора, которые непосредственно переходят и сливаются с мускулатурой задней уретры. Возможно, в области заднего сегмента шейки мочевого пузыря образуется утолщение, которое носит условное название Sphinkter trigonalis. При заполнении мочевого пузыря мочой рефлекторно происходит наполнение кровью венозного сплетения язычка, вследствие чего объем его увеличивается и внутреннее отверстие мочеиспускательного канала закрывается.
- Поддерживающим аппаратом, включающим мышцы тазового дна и мочеполовую диафрагму, поддерживающих определенное неподвижное положение мочевого пузыря и сохраняющих неподвижность пузырно-уретрального соединения, а также адекватную иннервацию всех перечисленных компонентов.
- Величиной самого физического напряжения.
Тесные анатомические связи между мочевым пузырем и стенкой влагалища способствуют тому, что на фоне патологических изменений тазовой диафрагмы, включающей, естественно, и мочеполовую, происходит опущение передней стенки влагалища, которая влечет за собой и стенку мочевого пузыря. Последняя становится содержимым грыжевого мешка, образуя цистоцеле. Цистоцеле увеличивается и под влиянием собственного внутреннего давления в мочевом пузыре, в результате чего образуется порочный круг. Д. О. Отт (1914) в своих трудах подчеркнул, что устранение смещений и выпадений органов малого таза достигается прежде всего восстановлением и укреплением мышц тазового дна. Однако и в отсутствие анатомических изменений, т.е. опущения передней стенки влагалища, недержание мочи также возможно.
Таким образом, в удержании мочи большое значение имеет функция замыкательного аппарата мочевого пузыря, стабильность уретральной анатомической поддержки, включающей мышцы тазового дна и мочеполовую диафрагму [12]. Все эти структуры эстрогензависимы, поэтому функциональное состояние вышеперечисленных структур меняется с течением времени, тем более наступлением менопаузы, т.е. наростанием эстрогенодефицита [13].
Недержание мочи и эстрогенодефицит
Контроль над мочеиспусканием комплексный, в котором дефицит эстрогенов – это один из многих возможных патогенетических факторов развития недержания мочи.
Считают [14], что эстрогены вызывают:
- пролиферацию влагалищного эпителия и уротелия, увеличение синтеза гликогена, восстановление популяции лактобацилл во влагалищном биоптате, а также восстановление кислого pH не только во влагалище, но и в нижней трети мочевыводящих путей;
- улучшение кровоснабжения всех слоев уретры, восстановление ее мышечного тонуса, качества коллагеновых структур, пролиферацию уротелия, увеличение количества слизи;
- нормализацию сократительной активности детрузора вследствие улучшения кровообращения. Обладая свойствами ингибиторов кальциевых каналов, эстрогены способствуют снижению симптомов гиперактивности мочевого пузыря;
- улучшение кровообращения, трофики и сократительной активности мышц тазового дна, коллагеновых структур, входящих в состав связочного аппарата малого таза, что также способствует удержанию мочи и препятствует опущению стенок влагалища.
По данным R. M. Levin и соавт. (1996) [15], недержание мочи у женщин (в основном) имеет три этиологических фактора, которые вовлекают процессы, лежащие в основе уретральной дисфункции и клеточной дистрофии:
- Снижение адренергической иннервации со снижением плотности адренорецепторов и/или тонического ответа.
- Ишемия/гипоксия, вызывающие снижение окислительной энергии и избыток Са++ с последующей клеточной дистрофией, денервацией и сниженным уретральным тонусом.
- Атрофия слизистой или снижение комплианса (податливости). Этот постулат был основан на биохимических/фармакологических наблюдениях за экспериментальными животными и нуждается в детальном изучении с целью применения по отношению к человеку.
Для создания адекватного повышения внутриуретрального давления одновременно с ростом внутрибрюшного и внутрипузырного давлений до значения, достаточного для поддержания положительного градиента уретрального давления при напряжении помимо описанных выше механизмов необходимы [16–20]:
- полноценное состояние уротелия и наличие слизи в просвете уретры;
- эластичность коллагеновых структур, входящих в состав соединительной ткани уретры;
- сохраненный тонус гладкой мускулатуры уретральной стенки;
- полноценная васкуляризация уретры.
Все описанные структуры являются эстроген-зависимыми [21–24] и подвергаются развитию атрофических процессов при возникновении возрастного эстрогенного дефицита. Данные исследования в ФГБОУ ВО «Первый МГМУ им. И. М. Сеченова» [2] подтверждают тот факт, что с увеличением длительности постменопаузы увеличивается степень эстрогенного дефицита, что подтверждается данными не только кольпо- и уретроцитологического, но и гормональных исследований.
 По данным [25, 26], треть положительного давления закрытия уретры поддерживается васкуляризацией.
По данным [25, 26], треть положительного давления закрытия уретры поддерживается васкуляризацией.
В сосудах проявляются возрастные изменения, которые отражаются на снижении максимального давления уретры с возрастом. Исследования [27, 28] определили, что сосуды мочевого пузыря и мочеиспускательного канала становятся шире и теряют свою извилистость после наступления менопаузы, стенки их истончаются. Т. Rud в 1980 г. показал, что экзогенные эстрогены повышают максимальное давление закрытия уретры, возможно за счет воздействия на сосудистые сплетения [26]. По данным некоторых авторов, эстрогены повышают периуретральный кровоток и этот факт, вероятно, является частью возможного положительного действия эстрогенов при стрессовом недержании мочи, повышая эластичность кровеносных сосудов собственной пластинки уретры. J. E. Greenland и соавт. (1997) считают, что первым этапом снижения уретрального давления является уменьшение кровенаполнения периуретральных сосудов, а более поздней фазой является гипоксия гладкой мускулатуры уретры [29].
Треть положительного давления закрытия уретры поддерживается тонусом сосудов уретры и мочевого пузыря [30, 31]. В сосудах проявляются изменения, которые отражаются на снижении максимального давления уретры с возрастом [32]. Интересны исследования Asmussen и соавт. (1983) и Versi и соавт. (1985) [33–35]. Одно из дистальных сосудистых сплетений уретры располагается прямо над наружным отверстием уретры и не изменяется с возрастом. Другое сосудистое сплетение (проксимальное) локализуется под шейкой мочевого пузыря. Сосуды этого сплетения становятся шире и теряют свою извилистость после наступления менопаузы, стенки их истончаются [36, 37]. У женщин сосудистая пульсация, синхронная с сердцебиением, может быть зарегистрирована во время проведения профилометрии уретры [38]. Было замечено, что амплитуда этой пульсации снижается после наступления менопаузы и вновь поднимается при проведении заместительной гормонотерапии [37].
Полученные в ФГБОУ ВО «Первый МГМУ им. И. М. Сеченова» данные [2] допплерографического исследования сосудов мочевого пузыря и уретры, а также сопоставление их с показателями профилометрии уретры, возрастом пациенток, длительностью постменопаузы совпали с предположением указанных выше авторов. Анализ частоты различных степеней тяжести стрессового недержания мочи в группах пациенток с наличием и отсутствие пульсации на профилограммах и показателей кровотока уретры позволяют предположить, что, возможно, этот факт играет роль в развитии стрессового недержания мочи и ответной реакции на проводимую терапию [2].
Эстрогеновые рецепторы в значительном количестве были обнаружены в биоптатах уретры. В нескольких работах иммуногистохимическими методами (методами моноклональных антител) количественно и качественно были определены эстрогеновые рецепторы практически во всех структурах урогенитального тракта: нижней трети мочеточников, в мочевом пузыре, мышечном слое сосудистых сплетений уретры и уротелии, матке, мышцах и эпителии влагалища, его сосудах, мышцах тазового дна и связочном аппарате малого таза [39–41].
Распределение рецепторов в самом мочевом тракте не везде одинаково [42]. Плотность рецепторов в отдельных структурах урогенитального тракта различна, что, по-видимому, является результатом тонкой дифференцировки тканей в процессе эмбриогенеза [43, 44] (см. таблицу). В нижней части мочевого тракта рецепторы к эстрогенам локализованы в уретре, треугольнике Льето и заднем отделе шейки мочевого пузыря. Это обстоятельство объясняет возможность прямого влияния эстрогенов на структуры уретры и мочепузырный треугольник.
Наличие эстрогеновых рецепторов и чувствительность к эстрогенам области нижней части мочевого тракта объясняются не только механизмами эмбриологического развития. Возможно, это следствие локальной дифференцировки в пределах самого эпителия, находящегося под контролем стромы, имеющей массу эстрогеновых рецепторов [44]. Установлено существование двух типов эстрогеновых рецепторов: α и β. Оба подвида обладают практически одинаковым сродством к эстрадиолу. Локализация α- и β-эстрогеновых рецепторов различна в органах и тканях – от одного типа рецепторов до их сочетания. К примеру, α- и β-эстрогеновые рецепторы обнаружены в центральной нервной системе, кровеносных сосудах, сердце, костях, молочных железах, яичниках, матке (простате и яичках у мужчин). Только α-эстрогеновые рецепторы обнаружены в легких, почках, мочевом пузыре и кишечнике. Точный тип распределения рецепторов половых стероидов в структурах нижнего мочевого тракта женщины и их значение для контроля удержания мочи в настоящее время неясны и требуют дальнейшего изучения [45].
По мнению [46], дефицит эстрогенов приводит к биохимическим, клеточным, анатомическим и бактериологическим изменениям в мочевом тракте вследствие вагинальной атрофии, сфинктерной недостаточности и повышения чувствительности мочевого пузыря.
Нарушение структуры соединительной ткани или дисплазия соединительной ткани имеют прямую связь с развитием недержания мочи, пролапсом тазовых органов и возникновением паравагинальных дефектов. Типы коллагена и его количество различны у здоровых женщин и у больных недержанием мочи. D. P. Keane (1997) исследовал коллаген нерожавших женщин в перименопаузе с недержанием мочи и сравнил с аналогичной группой здоровых пациенток [39]. При анализе биоптатов эндопельвикальной фасции у нерожавших женщин с признаками недержания мочи имелось значительное снижение коллагена по сравнению со здоровыми. U. Ulmsten (1997) и соавт. обнаружили, что у женщин с недержанием мочи на 40% снижено содержание общего коллагена в круглой связке и разрезе кожи по сравнению со здоровыми женщинами [47]. Они предполагают, что снижение коллагена приводит к нарушению поддерживающего урогенитального аппарата и способствует гипермобильности шейки мочевого пузыря. В этих работах также имеются указания на наличие грыж живота, варикозного расширения вен нижних конечностей и генитального пролапса у женщин с недержанием мочи.
Возможно, что у женщин эстрогенный дефицит при старении вызывает ускоренные дегенеративные процессы в соединительной ткани, что влияет на механизм уретральной поддержки и может способствовать развитию в климактерии недержания мочи [48].
Дислокация уретровезикального сегмента происходит в основном вследствие ослабления связок, обеспечивающих его правильное анатомическое положение.
К ним относятся уретротазовая и пубоуретральная связки. Прогрессирующее снижение уровня эстрогенов в климактерии приводит к образованию ткани, имеющей в 1,6 раза более высокую концентрацию коллагена, чем в пременопаузе [49]. Более того, изменяются свойства коллагена: снижается растворимость пепсином, являющаяся показателем увеличения количества поперечных сшивок (соединений) и отдельных фибрилл. Полагают, что эти изменения обусловлены уменьшением обменных процессов коллагена и вызывают снижение эластичности соединительной ткани [50]. Снижение соотношения протеогликан/коллаген влияет на формирование фибрилл коллагена, увеличение числа поперечных соединений, диаметра и функции фибрилл способствуют утрате эластичности и прочности соединительной ткани. Описанные изменения в парауретральной соединительной ткани связывают с биологическим старением.
Заместительная гормонотерапия восстанавливает соотношение протеогликан/коллаген до перименопаузального уровня и улучшает обменные процессы. Именно этот механизм положительного влияния заместительной гормонотерапии лежит в основе восстановления эластичности соединительной ткани и терапевтического действия при стрессовом недержании мочи [51].
Таким образом, эстрогенный дефицит в климактерии является важнейшим фактором, влияющим на состав соединительной ткани и ее биохимические характеристики.
Возможно, что эстрогенный дефицит может играть свою роль до определенного момента, а затем его последствия усугубляются необратимыми изменениями, что указывает на необходимость при появлении первых симптомов начала заместительной гормонотерапии [1, 52, 53].
Лечение стрессового недержания мочи в климактерии
Уже сегодня известно более 400 способов оперативного лечения недержания мочи у женщин. Среди отечественных и зарубежных авторов остается неоднозначным подход к выбору тактики ведения таких больных. Решая проблему лечения недержания мочи, большинство специалистов склоняются к тому, что наиболее эффективным методом коррекции является хирургическое лечение. В то же время хорошо известно, что оперативное лечение не всегда приводит к исчезновению недержания мочи, а в ряде случаев вызывает появление новых расстройств мочеиспускания. При своевременном обращении к врачу качество жизни пациенток позволяет улучшать консервативное лечение, но в большинстве случаев заболевание имеет длительный анамнез и требует выполнения обширной операции. Применение предложенных ранее хирургических методов коррекции недержания мочи, их модификации и комбинации на протяжении длительного времени доказали свою безопасность и эффективность. Вне всякого сомнения, упражнения Кегеля и упражнения для укрепления мышц тазового дна, улучшающие кровообращение в малом тазу, всегда будут входить в комплекс консервативного лечения недержания мочи у женщин [54].
Совершенствование хирургической техники и научно-технические достижения на современном этапе привели к созданию на основе высоких технологий так называемых новых оперативных пособий, отличающихся низкой травматичностью, минимальным объемом хирургического вмешательства при сохранении высокой эффективности, – слинговые пластики при помощи синтетических материалов.
Лечение должно основываться на индивидуальном выборе метода хирургической коррекции с учетом обширности поражения тазового дна, степени пролапса внутренних половых органов, а также возраста пациентки. Решение проблемы недержания мочи чрезвычайно важно и с точки зрения огромного влияния данной проблемы на качество жизни пациенток, страдающих данной патологией.
Местное применение эстрогенов при урогенитальных расстройствах считается оптимальным в лечении вагинальной атрофии и расстройств мочеиспускания, в том числе недержания мочи.
Еще в 1941 г. Salmon и соавт. опубликовали первое сообщение, описывающее терапию эстрогенами по поводу недержания мочи у женщин после 50 лет [26, 55], хотя об использовании эстрогенов в лечении «старческого вагинита» впервые сообщил Davis в 1935 г.
В работе G. Elia и соавт. (1993) можно найти данные о том, что уретра, так же как и влагалище, находится под влиянием эстрогенов и на фоне заместительной гормонотерапии атрофированная в периоде менопаузы слизистая уретры становится более зрелой, что в свою очередь положительно влияет на снижение симптоматики стрессового недержания мочи [56].
По данным [57], заместительная эстрогенотерапия оказывает положительный эффект при лечении стрессового недержания мочи путем увеличения уретрального давления. Автором было замечено, что оральное или вагинальное применение эстрогенов уменьшает проявление симптоматики у 60–70% пациенток с истинным недержанием мочи при напряжении.
Полагают, что независимо от способа введения эстрогенов (орального, влагалищного, трансдермального, внутримышечного) эстрогенотерапия приводит к положительным результатам в лечении стрессового недержания мочи у женщин в периоде менопаузы [2].
Эффект эстрогенов, применяемых местно, достигается двумя способами: локальной диффузией, которая может быть связана с негеномным механизмом действия эстрогенов, или вагинальной абсорбцией.
Полагают, что независимо от способа введения эстрогенов (орального, влагалищного, трансдермального, внутримышечного) эстрогенотерапия приводит к положительным результатам в лечении стрессового недержания мочи у женщин в периоде климактерия [58–60].
Таким образом, местная заместительная гормональная терапия, будучи эффективной и безопасной, может использоваться пациентками с легкой степенью недержания мочи, а также в качестве подготовки к операциям, выполняемым вагинальным доступом и в послеоперационном периоде [61].
Морфологическое исследование парауретральной ткани
Исследованиями последних лет, включившими и данные результатов биопсии парауретральной ткани, убедительно показано, что соединительная ткань женщин, удерживающая мочу, значительно отличается от таковой женщин с недержанием мочи как по общему количеству, так и по качеству коллагена [61].
На кафедре урологии и нефрологии ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России также имеются результаты морфологического исследования парауретральной ткани, полученной от 20 пациенток с рецидивом недержания мочи после пластических операций по поводу цистоцеле и стрессового недержания мочи, во время повторного оперативного вмешательства – слинговой операции TVT или IVS. Для световой микроскопии материал фиксировали в 10%-ном нейтральном формалине, забуференном по Лили. Далее проводили стандартным способом и заливали в парафин. Впоследствии делали срезы толщиной 4–5 мкм. Приготовленные стеклопрепараты окрашивали гематоксилином и эозином, затем для выявления коллагеновых волокон – пикрофуксином по Ван Гизону и резорцин-фуксином по Вейгерту для выявления эластических волокон. Парафиновые срезы изучали в универсальном микроскопе Leica DM 4000B, фотографировали с помощью цифровой камеры Leica DFC320 и компьютерной программы Leica QWinV3.
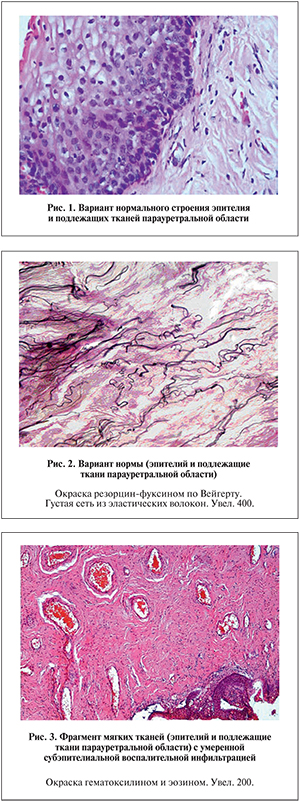
У 5 женщин с парауретральными кистами во время операции был взят материал для морфологического исследования и рассматривался в качестве варианта нормы.
На рис. 1 представлен вариант нормы.
Эластические волокна формировали густую нерегулярную сеть из переплетающихся волокон темно-синего цвета (окраска по Вейгерту), на которых располагались коллагеновые волокна, на рис. 2 представлен вариант нормы.
Анализ отдаленных результатов оперативного лечения стрессового недержания мочи у женщин и причин рецидивов на основании морфологического исследования
С учетом состояния постменопаузы тем же 20 пациенткам с рецидивом недержания мочи после пластической операции нами назначалась местная заместительная гормонотерапия, что 8 (40%) пациенткам позволило избежать оперативного вмешательства, так как состояние заметно улучшилось. Назначался вагинально препарат Овестин в свечах или в виде вагинального крема, начинали с ежедневного применения, постепенно снижая частоту приема до поддерживающей дозы (1–2 раза в неделю) на протяжении 3–6 месяцев с последующим ультразвуковым исследованием гениталий и молочных желез. Оставшимся 12 (60%) пациенткам было выполнено оперативное вмешательство с использованием синтетической ленты (TVT или IVS), при этом после выделения средней трети уретры из парауретрального пространства бралась ткань для морфологического исследования.
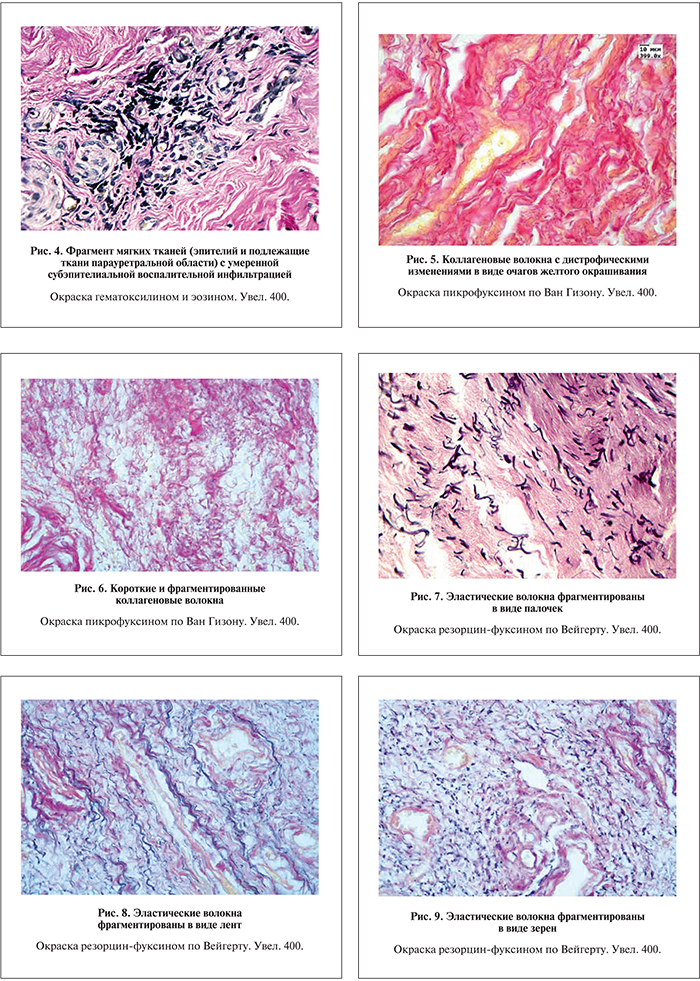
При окраске гематоксилином и эозином во всех исследуемых материалах была обнаружена воспалительная инфильтрация, располагающаяся субэпителиально. Степень выраженности инфильтрата – от слабой до выраженной. Преимущественный состав воспалительного инфильтрата – лимфомакрофагальный (рис. 3, 4).
При окраске пикрофуксином по Ван Гизону зафиксированы дегенеративные изменения коллагеновых волокон, проявившиеся очагами желтого окрашивания, в то время как коллагеновые волокна на всем протяжении окрашиваются пикрофуксином в темно-красный цвет (рис. 5).
Коллагеновые волокна имели извитой вид, располагались в виде густой переплетающейся сети. Часть волокон была фрагментирована с поперечными разрывами, утолщениями по ходу волокна.
В целом в морфологической картине отмечали чередование очагов разряжения, где большинство коллагеновых волокон были короткими, фрагментированными, слабоизвитыми, и очагов с явным увеличением содержания коллагеновых волокон, вплоть до формирования очагов склероза со значительным утолщением коллагеновых волокон и пучков (рис. 6).
При окраске на эластические волокна резорцин-фуксином по Вейгерту в мягких тканях отмечено, что эластические волокна распределены неравномерно, их количество было резко снижено. Кроме этого были отмечены изменения эластических волокон в виде набухания и образования глыбок. Значительная часть волокон была представлена в виде зерен («зернистый» распад эластических волокон), палочек или лент, хорошо окрашенных резорцин-фуксином в темно-синий цвет (рис. 7–9).
Можно сделать вывод, согласно которому в исследуемых парауретральных тканях выявлены морфологические изменения коллагеновых волокон: фрагментация, дегенеративные изменения (желтое окрашивание по ходу волокна), утолщение их с формированием полей склероза. Наряду с этими изменениями выявлены дегенеративные изменения эластических волокон (их зернистый распад, фрагментация, снижение количества). Все это может приводить к значительной утрате эластических свойств исследуемых тканей, нарушая их растяжимость и повреждая мышечно-эластический каркас.
Таким образом, обнаруженные морфологические изменения парауретральных тканей у женщин с рецидивом недержания мочи, а именно фиброз – как следствие длительного нарушения анатомической позиции пузырно-уретрального сегмента или оперативного вмешательства, приводят к снижению эластичности тканей, нарушению микроциркуляции и свидетельствуют о неполноценности соединительной ткани или дисплазии соединительной ткани. На наш взгляд, именно повреждения соединительнотканного матрикса (коллагеновых и эластических волокон) и явились возможной причиной рецидива недержания мочи, что определяет необходимость применения синтетических материалов. Также мы доказали по данным проведенных нами морфологических исследований, что женщинам в постменопаузе патогенетически обосновано назначение местной заместительной гормонотерапии при рецидиве недержания мочи, что в ряде случаев позволяет избегать оперативного вмешательства и улучшать качество жизни.
Заключение
Мочевая и половая системы женщин имеют общее эмбриональное происхождение, рецепторы к эстрогенам локализуются и в нижних мочевыводящих путях. Исходя из этого, эстрогены при интравагинальном введении эффективно влияют на функцию нижних мочевыводящих путей. Терапия эстрогенами широко используется для лечения недержания мочи у женщин в климактерии. Общее эмбриологическое происхождение мочевого тракта и влагалища, присутствие рецепторов к эстрогенам повсеместно в поддерживающих тканях, сосудистых и слизистых структурах, влияние эстрогенов на нервно-мышечную активность нижнего урогенитального тракта говорят о необходимости заместительной гормонотерапии для женщин с расстройствами мочеиспускания в климактерии. Эстриол имеет относительно короткий период действия и незначительный риск осложнений. Терапевтический и профилактический эффекты действия эстриола на урогенитальный тракт поразительны. С другой стороны, если недержание мочи у женщины существовало с детства, возникло после родов или операции и прогрессирует с течением времени, очень мало надежды на то, что только эстрогенотерапия улучшит или уменьшит инконтиненцию.



