Введение. Общепринятым в мире стандартом оперативного лечения инфравезикальной обструкции, вызванной доброкачественной гиперплазией предстательной железы (ДГПЖ), считается трансуретральная резекция простаты (ТУРП) [1]. Однако при больших размерах узлов гиперплазии (более 80–100 см3) в большинстве случаев частота осложнений и рецидивов заболевания не позволяет считать ТУРП методом выбора [2]. Частота рецидивов после ТУРП при размерах ДГПЖ более 100 см3 составляет более 30% в течение 5 лет после операции, что в 3 раза выше, чем данный показатель при размерах узлов до 100 см3 [3].
За последние годы наибольшее распространение при средних и больших размерах доброкачественной гиперплазии предстательной железы стали получать не резекционные, а энуклеирующие методики удаления аденоматозных тканей. Наиболее популярной методикой остается трансуретральная гольмиевая (Ho-Yag) энуклеация ДГПЖ. Многочисленные данные европейских, американских и азиатских исследователей, а также собственный опыт свидетель- ствуют о ее высокой эффективности и безопасности [2–6]. Тем не менее у данной методики есть два серьезных недостатка, мешающих ее повсеместному распространению: высокая стоимость оборудования – высокомощного гольмиевого лазера и лазерных волокон; необходимость удаления аденоматозных тканей из полости мочевого пузыря с помощью морцеллятора, что также в определенной степени усложняет операцию и повышает ее стоимость. Все это характерно и для трансуретральной энуклеации ДГПЖ с помощью тулиевого лазера (Thu-Yag).
 Возможность выполнения электроэнуклеации с помощью стандартного оборудования для трансуретральной резекции без использования лазера длительное время оставалась заманчивой и перспективной. Появление специальных петель для биполярной и монополярной электроэнуклеации открыло новые возможности в лечении пациентов с ДГПЖ [7–9].
Возможность выполнения электроэнуклеации с помощью стандартного оборудования для трансуретральной резекции без использования лазера длительное время оставалась заманчивой и перспективной. Появление специальных петель для биполярной и монополярной электроэнуклеации открыло новые возможности в лечении пациентов с ДГПЖ [7–9].
В настоящей работе представлен наш первый опыт применения новой методики – трансуретральной монополярной электроэнуклеации ДГПЖ.
Материалы и методы. С января по май 2013 г. на базе урологического отделения ГКБ № 57 Москвы 38 пациентам с инфравезикальной обструкцией, вызванной ДГПЖ, была выполнена трансуретральная монополярная энуклеация (основная группа). Ограничений в возрасте при включении в исследование не было. Учтя предшествующий опыт лазерной и биполярной энуклеации, говорящий о наибольшей эффективности подобных методик при так называемой зрелой ДГПЖ, отобрали больных со средними и большими размерами узлов гиперплазии (более 60 см3). В исследование сознательно не включили пациентов с очень большими размерами узлов гиперплазии (более 150 см3), так как на этапе освоения метода считали это нецелесообразным, хотя в настоящее время применяем эту методику для удаления ДГПЖ любых размеров.
У всех пациентов показанием к операции была неэффективность предшествующей консервативной терапии ДГПЖ. На этапе включения в исследование всем пациентам проведено комплексное клинико-лабораторное обследование, включившее пальцевое ректальное исследование, оценку жалоб по шкале I-PSS и QoL, проведение ультразвукового исследования и урофлоуметрии с определением максимальной объемной скорости мочеиспускания (Qmax), общеклинических анализов крови и мочи, микробиологического исследования мочи, анализа крови на простатспецифический антиген (ПСА). Для исключения рака простаты по показаниям выполнили биопсию предстательной железы.
С целью сравнения эффективности и безопасности метода в те же сроки была набрана контрольная группа из 44 пациентов приблизительно с теми же размерами ДГПЖ, которым была выполнена стандартная монополярная ТУРП. Этим больным было проведено аналогичное комплексное клинико-лабораторное обследование.
Критерии исключения из исследования: наличие в анамнезе оперативных вмешательств на органах малого таза (в том числе и по поводу ДГПЖ), камни мочевого пузыря и стриктуры уретры, сахарный диабет, неврологические заболевания, наличие цисто- стомического дренажа. Результаты предоперационного обследования больных обеих групп представлены в табл. 1.
Все операции были выполнены одной операционной бригадой. При проведении сравнительного исследования учтены следующие показатели: продолжительность операции, изменение концентрации гемоглобина и натрия в плазме крови, время функционирования промывной системы, сроки дренирования мочевого пузыря уретральным катетером, продолжительность госпитализации, частота развития осложнений (послеоперационная тампонада мочевого пузыря, недержание мочи, задержка мочеиспускания, необходимость гемотрансфузии, количество повторных операций по поводу после- операционного кровотечения).
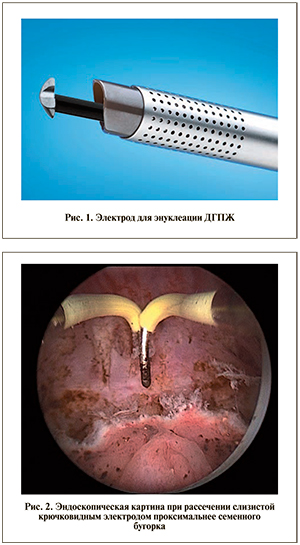
Трансуретральную монополярную энуклеацию ДГПЖ и ТУРП выполнили в условиях эндоскопической операционной с использованием аппаратуры и инструментов для стандартной трансуретральной резекции предстательной железы. Во всех случаях применяли резектоскоп Karl Storz (Германия) размером 26 F с постоянным промыванием. Для энуклеации использовали специальный электрод-толкатель (рис. 1), а также стандартный набор электродов для монополярной электрохирургии (резекционная петля, шарик-коагулятор и крючковидный электрод).
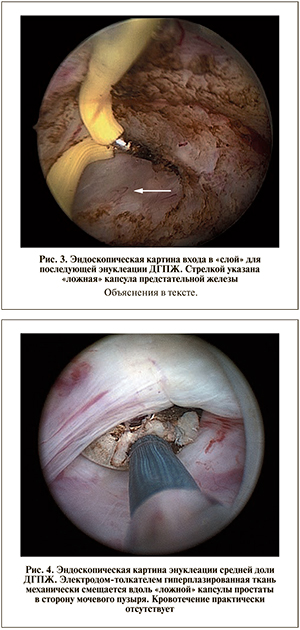
Техника трансуретральной электроэнуклеации простаты. Первым этапом выполняют диагностиче- скую уретроцистоскопию, во время которой уточняют размер и конфигурацию узлов гиперплазии, осматривают наружный сфинктер мочевого пузыря, устья мочеточников, слизистую мочевого пузыря. Далее выполняют маркировку слизистой и ее рассечение между наружным сфинктером и предстательной железой по всей окружности уретры (рис. 2). Данный этап операции может быть выполнен как стандартной петлей, так и крючковидным электродом, и на этом этапе очень важно достичь «ложной» капсулы простаты, которая имеет глянцевую белесоватую поверхность (рис. 3). «Ложная» капсула состоит из нескольких листков фиброзной ткани с наличием интерстициальной ткани между ними и находится на границе между аденомой и предстательной железой. При аденомэктомии «ложную» капсулу обычно разделяют на два слоя путем тупой диссекции, при этом один слой покрывает удаленную аденому, другой – оставшуюся периферическую ткань. Именно эту зону очень важно обнажить, т.е. попасть «в слой» для правильного выполнения последующей энуклеации.

Следующие этапы операции выполняются в зависимости от размеров и конфигурации ДГПЖ, предпочтения и опыта оперирующего уролога. Если аденома большая, целесообразно сначала отделить ее доли друг от друга, следуя классической технике гольмиевой энуклеации [7], что в значительной степени способствует интраоперационной ориентации. Для этого на 5 и 7 часах условного циферблата с помощью стандартной петли или крючковидного электрода делают продольные борозды от шейки мочевого пузыря до поперечной маркировочной линии проксимальнее семенного бугорка. Далее энуклеируют среднюю долю с помощью электрода-толкателя и перед вылущиванием боковых долей производят их дополнительное разделение на 12 часах условного циферблата также с помощью петли или крючковидного электрода (эту манипуляцию можно делать сразу вместе с созданием продольных борозд, для того чтобы не менять электроды). Впоследствии электродом-толкателем вылущивают обе боковые доли, которые, так же как и среднюю, либо смещают в мочевой пузырь для последующей морцелляции, либо полностью не отделяют от шейки мочевого пузыря, а срезают с помощью резектоскопа – в этом случае морцеллятор не требуется. Сразу обращаем внимание на то, что резекция флотирующих тканей, фиксированных в области шейки мочевого пузыря лишь с помощью небольшого тканевого мостика, – очень непростая и довольно опасная задача даже для очень опытных урологов. Ориентация затруднительна, ткани практически не имеют точки опоры, легко смещаются, трудно захватываются петлей резекто- скопа, при их резекции нередко наносится дополнительная травма. Кроме того, довольно часто возможно отделение крупных фрагментов ткани, которые смещаются в мочевой пузырь и их очень непросто оттуда удалить (отсутствует точка опоры).
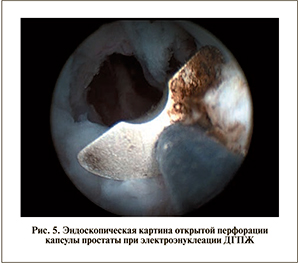
 Непосредственно энуклеацию выполняют с помощью монополярного электрода-толкателя. Если правильно идентифицирован «слой», ткани довольно легко смещаются механически электродом-толкателем вдоль ложной капсулы простаты в сторону просвета мочевого пузыря; электрохирургия применяется только для рассечения спаек, коагуляции сосудов и отделения долей (рис. 4). Такой способ энуклеации называется «blunt enucleation» («тупая», или «холодная», энуклеация), его можно выполнять как толкателем, что удобнее, так и тубусом резектоскопа, которые как бы заменяют палец уролога, вылущивающего аденоматозные узлы при открытой операции.
Непосредственно энуклеацию выполняют с помощью монополярного электрода-толкателя. Если правильно идентифицирован «слой», ткани довольно легко смещаются механически электродом-толкателем вдоль ложной капсулы простаты в сторону просвета мочевого пузыря; электрохирургия применяется только для рассечения спаек, коагуляции сосудов и отделения долей (рис. 4). Такой способ энуклеации называется «blunt enucleation» («тупая», или «холодная», энуклеация), его можно выполнять как толкателем, что удобнее, так и тубусом резектоскопа, которые как бы заменяют палец уролога, вылущивающего аденоматозные узлы при открытой операции.
Смещенные в мочевой пузырь гиперплазированные ткани подвергают морцелляции. Для этого необходимо сменить рабочий элемент резектоскопа на нефроскопическую оптику для создания прямого рабочего канала или сменить резектоскоп на специальный морцескоп. По рабочему каналу эндоскопа в мочевой пузырь вводят ригидный зонд механиче- ского морцеллятора, соединенного с аспиратором. Ткани механически измельчают и одновременно аспирируют в тканеприемник. Выполняя морцелляцию, необходимо быть предельно осторожным, чтобы лезвия морцеллятора не повредили стенку мочевого пузыря.
Операцию завершают дренированием мочевого пузыря двух- или трехходовым (когда требуется постоянное орошение мочевого пузыря) уретральным катетером. Натяжения уретрального катетера обычно не требуется. Сроки дренирования мочевого пузыря в большинстве случаев составляют 1–2 дня.
Урологи, имеющие опыт выполнения энуклеирующих методик, могут осуществлять электроэнуклеацию единым блоком, без разделяющих борозд, однако это технически более сложно.
По завершении стационарного лечения спустя 1, 6 и 12 мес проведено контрольное обследование для оценки стабильности полученных результатов. Результаты обследования и лечения занесены в специальную компьютерную программу, подвергнуты статистической обработке с определением стандартного отклонения. Различия считали достоверными при р менее 0,05.
Результаты. Основные показатели интра- и послеоперационного периода в обеих группах приведены в табл. 2.
Из окончательного анализа по причине неявки на контрольные обследования из основной группы выбыли 2 пациента, из контрольной – 6. Результаты обследования в сроки 1, 6 и 12 мес представлены в табл. 3.
Согласно данным, приведенным в табл. 3, положительные результаты, достигнутые по окончании операций, оставались стабильными на протяжении 12 мес. В табл. 4, 5 приведены интра- и послеоперационные осложнения, отмеченные при выполнении операций в обеих группах пациентов.
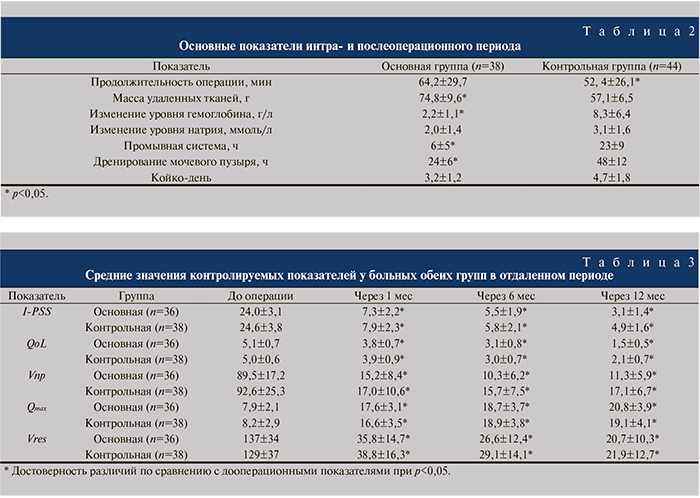
Как видно из табл. 4, 5, в целом частота осложнений была невысокой в обеих группах. Ни у одного из пациентов не возникло необходимости в проведении гемотрансфузии. В одном наблюдении во время энуклеации боковой доли ДГПЖ произошла открытая перфорация капсулы простаты (рис. 5), в другом – незначительное повреждение слизистой мочевого пузыря при морцелляции, что потребовало более продолжительного дренирования мочевого пузыря уретральным катетером. Это говорит о том, что техника энуклеации имеет определенные сложности, связанные с возможной потерей «слоя» и отсут- ствием традиционных эндоскопических ориентиров, характерных для стандартной ТУРП. В основной группе в одном наблюдении было также отмечено стрессовое недержание мочи, что, по-видимому, было связано с повреждением вентральной части наружного сфинктера во время энуклеации боковых долей. Спустя 3 мес тип мочеиспускания был восстановлен консервативными мероприятиями.
Ни одного случая тампонады мочевого пузыря и развития простатита и орхоэпидидимита зарегистрировано не было
Обсуждение. Данные многочисленных исследований показывают, что отдаленные результаты ТУРП, особенно при больших размерах доброкачественной гиперплазии, уступают результатам открытой аденом- эктомии в отношении частоты развития так называемых «ложных» рецидивов заболевания [1, 10–13]. Эти различия связаны с тем, что при трансуретральной резекции не всегда и не всеми урологами удаляются все аденоматозные ткани, а лишь создается широкий «канал» или «воронка» для адекватного оттока мочи [1, 2, 9, 13]. Периферические ткани боковых долей, апикальные и вентральные ткани аденомы нередко остаются неудаленными. Чем больше размеры ДГПЖ, тем большая масса тканей остается неудаленной. При выполнении открытой аденомэктомии ткани удаляются пальцем оперирующего уролога вдоль хирургической капсулы, что обычно позволяет удалить их практически полностью и избежать в дальнейшем развития «ложных» рецидивов заболевания.
 Одной из малоинвазивных альтернатив открытой аденомэктомии является лапароскопическая или экстраперитонеоскопическая, при которой аденоматозные узлы удаляют через переднюю брюшную стенку с помощью лапароскопической техники. При этом радикальность операции сопоставима с таковой открытой аденомэктомии [14].
Одной из малоинвазивных альтернатив открытой аденомэктомии является лапароскопическая или экстраперитонеоскопическая, при которой аденоматозные узлы удаляют через переднюю брюшную стенку с помощью лапароскопической техники. При этом радикальность операции сопоставима с таковой открытой аденомэктомии [14].
Так называемые энуклеирующие методики трансуретрального удаления ДГПЖ приобретают все большую популярность. Для их выполнения используют различные лазеры, моно- и биполярные резекционные петли, вапортроды различных конструкций, крючковидные и пуговчатые электроды и др. Среди всех этих методик наиболее распространена трансуретральная энуклеация с помощью гольмиевого (HoLEP) и тулиевого (ThuLEP) лазеров, которые стали широко внедряться в клиническую практику благодаря работам P. Gilling и развитию морцелляции энуклеированных тканей [2–6]. Мы также обладаем определенным опытом гольмиевой энуклеации, однако высокая стоимость оборудования, по нашему мнению, служит фактором, ограничивающим ее широкое применение [6]. Основываясь на собственном опыте и данных литературы [2–6], полагаем, что лазерную «энуклеацию» правильнее называть резекцией или вапорезекцией, особенно на этапе освоения этих методик. Дело в том, что при использовании гольмиевого и особенно тулиевого лазеров, обладающих уникальными свойствами качественной резекции с одновременной вапоризацией и коагуляцией, совсем не обязательно точно идти в «слое» для смещения гиперплазированной ткани в мочевой пузырь – лазеры обеспечивают быстрое и практически бескровное рассечение и отделение любого фрагмента аденоматозной ткани, что в значительной степени облегчает выполнение операции. И лишь опытные урологи, выполняя гольмиевую (тулиевую, диодную, калий-титанил-фосфатную [КТР] и др.) энуклеацию, точно следуют «слою», пользуются в основном методикой «blunt»-энуклеации, применяя лазер лишь для дополнительного рассечения, коагуляции и вапоризации тканей. При электроэнуклеации, если слой не идентифицирован, качественную операцию выполнить очень сложно. В связи с этим, с нашей точки зрения, электроэнуклеация как разновидность «blunt»-энуклеации – более сложный в освоении, но и более радикальный метод оперативного лечения ДГПЖ. В качестве подтверждения наших рассуждений можно обратиться к основополагающим работам и мета-анализам, посвященным гольмиевой энуклеации, – в большинстве из них имеется существенная разница между предоперационным объемом ДГПЖ и массой удаленных тканей, что косвенно подтверждает преимущественно резекционный характер данной методики [2–5].
Биполярная трансуретральная электрохирургия – еще один перспективный метод оперативного лечения ДГПЖ. Использование биполярной энергии позволяет практически полностью избегать многих рисков монополярного электровоздействия: ожогов и электроповреждений, синдрома «водной интоксикации организма» («ТУР-синдрома») и др.; немаловажна возможность использования ее больными с любыми электрокардиостимуляторами и токопроводящими металлоконструкциями. Применение биполярной электроэнергии позволяет свести к минимуму вероятность развития эректильной дисфункции и повреждения наружного сфинктера мочевого пузыря. Вопрос о риске развития геморрагических осложнений при использовании биполярной электрохирургии по сравнению с монополярной остается открытым. Ряд авторов считают риск кровопотери при использовании биполярной электрохирургии минимальным, однако, по данным других исследований, гемостаз не служит преимуществом этой методики [11, 12]. Мы придерживаемся аналогичного мнения.
Внедрение в клиническую практику специальных биполярных и монополярных энуклеирующих электродов открыло новые возможности в лечении ДГПЖ. Мы имеем опыт выполнения биполярной энуклеации в физиологическом растворе (TUEB – TransUretral Enucleation with Bipolar). Методика, разработанная компанией «Olympus» (Япония), хорошо зарекомендовала себя в клинической практике; в ее основу также положена техника «blunt»-энуклеации [7]. Для ее выполнения используется специальная двойная петля, верхняя часть которой является механическим толкателем. В настоящей работе для энуклеации применен новый монополярный электрод в виде «лопаты», который одновременно является и толкателем. Техника монополярной и биполярной энуклеации ДГПЖ практически одинакова, но при прочих равных условиях биполярная электрохирургия безопаснее монополярной, что следует учитывать при выполнении операции (при перфорационных или геморрагических осложнениях монополярной энуклеации имеется потенциальная опасность развития синдрома «водной интоксикации организма»).
Форма и характер роста гиперплазированных долей также играют свою роль. Так, энуклеация при «подпузырной» форме роста железы технически сложнее и сопряжена с более высоким риском перфорации капсулы под шейкой мочевого пузыря. Кроме того, при близком расположении устьев мочеточников к внутрипузырно расположенным долям аденомы риск их повреждения несколько выше при энуклеации, чем при ТУРП, поэтому в подобных ситуациях для профилактики повреждения мочеточниковых устьев целесообразно удалять близлежащие ткани с помощью петли или отмечать слизистую мочевого пузыря рядом с устьем. При расположении апикальных тканей боковых долей дистальнее семенного бугорка и их удалении с помощью энуклеирующих методик также велика вероятность повреждения наружного сфинктера мочевого пузыря. При этом наиболее вероятно повреждение верхней полуокружности сфинктера при выраженном изгибе задней уретры. Для профилактики травмы сфинктера необходимо перед началом энуклеации производить разметку слизистой в области апикальных тканей и не выходить за нее впоследствии.
Важно понимать, что для выполнения «blunt»-энуклеации следует точно войти «в слой» вдоль «ложной» капсулы, что позволяет безопасно и практически бескровно удалять узлы весьма большого объема, механически смещая их в мочевой пузырь. В противном случае неизбежны потеря ориентации, «шинкование» железы, перфорация капсулы и другие осложнения, значительно усложняющие выполнение операции. Для большей эффективности механического компонента энуклеации потенциально важно отсутствие выраженного фиброза в области ложной капсулы; ввиду этого использование ингибиторов 5α-редуктазы перед энуклеацией не такое оправданное, как перед трансуретральной резекцией. Однако данное обстоятельство, по нашему мнению, не есть противопоказание, так как, во-первых, мы пока не заметили выраженных трудностей при выполнении операции больным, длительно применяющим препарат, и во-вторых, в отличие от гольмиевой или тулиевой энуклеации при использовании электрохирургии всегда есть возможность комбинации с резекцией, так как операция выполняется тем же инструментом и используется тот же промывной раствор.

По нашему мнению, трансуретральная энуклеация наиболее эффективна для удаления желез средних и больших размеров (более 40–60 см3). Выполнение энуклеации желез объемом менее 40 см3 считаем нерациональным, так как подобные железы успешно, безопасно и довольно быстро удаляются в ходе традиционной трансуретральной резекции без использования дополнительного оборудования.
Обсуждая современное оперативное лечение ДГПЖ, мы сознательно не останавливаемся на чисто вапоризирующих методиках, основанных как на электрохирургическом, так и на лазерном воздей- ствии. Тканеуносящий эффект любой вапоризации не сопоставим ни с ТУРП, ни, тем более, с открытой операцией и энуклеирующими методиками [15].

Полученные нами данные свидетельствуют о высокой эффективности и относительной безопасности монополярной электроэнуклеации. К преимущества нового метода лечения ДГПЖ относятся возможность удалять большую по сравнению со стандартной ТУРП массу тканей и потенциально меньшее количество геморрагических осложнений. Вместе с тем в одном случае в начале освоения метода была отмечена перфорация капсулы, в другом – травма мочевого пузыря при морцелляции тканей, что потребовало более длительного дренирования мочевого пузыря. Значимых различий в частоте развития осложнений послеоперационного периода отмечено не было.
Хотим заметить, что в нашем исследовании объем простаты спустя полгода после операции был одинаков в обеих группах, в то время как большинство исследователей отмечают меньшие объемы в группе пациентов, которым проводилась энуклеация [9]. По нашему мнению, данное обстоятельство обусловлено большим опытом выполнения трансуретральной резекции и принятой в клинике методикой радикального удаления аденоматозных тканей [13].
Заключение. Первый опыт выполнения трансуретральной электроэнуклеации простаты и результаты ее сравнения со стандартной ТУРП позволяют считать данный метод эффективным и безопасным для оперативного лечения пациентов с ДГПЖ. Дальнейшее наблюдение за оперированными пациентами и накопление опыта позволят сделать окончательное заключение о месте операции среди методов оперативного лечения ДГПЖ и стабильности достигнутых результатов.



