Введение. Рак предстательной железы (РПЖ) занимает 1-е место в структуре онкологической заболеваемости в мире и 2-е место (после рака легких) среди причин онкологической смертности у мужчин в промышленно-развитых странах [1]. На протяжении последних 20 лет определение содержания простатспецифического антигена (ПСА) является фактически единственным одобренным и активно использующимся диагностическим и прогностическим биомаркером РПЖ [2]. Вместе с тем данные современных клинических исследований показывают, что тест на содержание ПСА дает массу как ложноположительных, так и ложноотрицательных результатов [3]. Все это свидетельствует о важности и необходимости разработки нового метода дианостики РПЖ, по простоте выполнения сопоставимого с анализом по определению уровня ПСА, но более информативного.
α1-Антитрипсин (ААТ) – один из основных компонентов сыворотки крови. Он ингибирует сериновые протеазы и является белком острой фазы. Главной мишенью ААТ является эластаза нейтрофилов. Кроме того, он подавляет активность трипсина, хемотрипсина, калликреина, катепсина G, плазмина, тромбина и других ферментов тканевых протеаз [4]. Предшественник ААТ состоит из 418
аминокислот с сигнальным пептидом в 24 аминокислоты. Зрелый белок включает 394 аминокислоты
и имеет молекулярную массу примерно 52 кД, 15 % от которых составляет углеводная часть [5]. ААТ
секретируется преимущественно гепатоцитами, а также моноцитами, нейтрофилами, макрофагами и
альвеолярными эпителиальными клетками [6].
ААТ может являться диагностическим маркером различных заболеваний. Дефицит ААТ – генетическое заболевание, сопряженное с риском развития эмфиземы легких у взрослых, гепатита и холестаза у
взрослых и детей, рака мочевого и желчного пузыря, злокачественной лимфомы и реже – панникулита
[7, 8]. В ряде исследований было обнаружено повышение концентрации ААТ при различных хронических заболеваниях: циррозе печени [9], гепатите [10], язве двенадцатиперстной кишки [11] и др. Повышение концентрации ААТ было также выявлено при различных онкологических заболеваниях,
таких как печеночно-клеточная карцинома [12], рак поджелудочной железы [13], первичная карцинома легких [14], рак желудка [15], карцинома гортани [16], рак кишечника [17], рецидив рака груди [18], рак шейки матки [19]. Сравнительный анализ опухолевых и здоровых тканей различного происхождения показал корреляцию между низкой локальной продукцией ААТ и более агрессивным ростом опухоли [20]. Авторы объяснили это обнаруженной антиангиогенной активностью ААТ (белок вызывал апоптоз эндотелиоцитов), которая не зависела от его антипротеолитической активности.
Ключевой стадией развития опухоли является прогрессирование из локализованной опухоли в метастазирующий рак. В процессе инвазии происходят адгезия опухолевой клетки к базальной мембране, локальный протеолиз внеклеточного матрикса и дальнейшая миграция клетки. Поскольку протеазы могут участвовать в деградации компонентов внеклеточного матрикса, именно они должны
играть главную роль в прогрессировании опухоли. Повышенная концентрация ААТ может являться
защитным механизмом от действия протеолитических ферментов в процессе роста опухоли. Все
перечисленные данные говорят о важной роли ААТ в процессе канцерогенеза.
Целью данной работы являлось изучение концентрации ААТ в образцах сыворотки крови с оценкой
достоверности найденных различий у пациентов с РПЖ, аденомой предстательной железы (АПЖ) и
здоровых волонтеров.
Материалы и методы. Образцы сыворотки крови были получены от 15 пациентов в возрасте 53–81
года с первично диагностированным РПЖ (n=12) и аденомой предстательной железы (АПЖ) (n=3),
проходивших обследование или лечение в урологических клиниках РМАПО, Первого МГМУ
им. И. М. Сеченова, в отделении урологии Городской клинической больницы им. С. П. Боткина, в
Российском научном центре рентгенорадиологии, и от 11 здоровых добровольцев в возрасте 19–24 лет.
Все образцы были заморожены при -80°С. Перед использованием аликвоты медленно размораживали
на льду, суспендировали и центрифугировали 5 мин при 10 тыс. об/мин.
Все реактивы, за исключением особо оговоренных случаев, были производства фирмы “Sigma-Aldrich”.
Получение антисыворотки. Кроличьи поликлональные антитела получали с использованием коммерческого ААТ (“Sigma”). Для этого были проведены серии иммунизаций кроликов породы шиншилла с интервалом в 2 нед по 1 мг белка на 1 кролика. Для первой иммунизации 1 мг белка растворяли в 0,5 мл фосфатно-солевого буфера (ФСБ) с полным адъювантом Фрейнда (“Thermo scientific”, 77140), суспендировали в 2 мл шприце 5 мин, вводили по следующей схеме: 2 по 250 мкл в оба бедра, 2 по 250 мкл под холку с обеих сторон. Все последующие иммунизации проводили с добавлением неполного адъюванта (“Thermo scientific”) по той же схеме. После 4-й иммунизации был достигнут высокий титр антител (1:200 тыс.). Далее был проведен тотальный забор крови. Кровь ставили в термостат при 37°С на 30 мин, затем при 4°С на всю ночь и после центрифугирования отделяли антисыворотку.
Очистка антител. Поликлональные антитела очищали с помощью аффинной хроматографии. Для
этого ААТ связывали с бромцианактивированной сефарозой 4B (“GE Healthcare”) (по протоколу производителя). После этого 1,2 мл колонки с пришитыми 2 мг ААТ инкубировали с 3 мл антисыворотки
в течение 2 ч при комнатной температуре. Проскок собирали для повторной инкубации. Колонку промывали 3-кратно равным объемом ФСБ, проскок собирали. Антитела элюировали по 400 мкл 100
мМ раствором глицина (рН=2), собирали 15 фракций, нейтрализовали 1М трис (рН=9), измеряли
оптическую плотность при 280 нм. Чистоту выделенных антител проверяли с помощью электрофореза по Леммли в 11 %-ном полиакриламидном иле. Нужные фракции объединяли и переводили в ФСБ
гель-фильтрацией на Sephadex G-25, определяли оптическую плотность при 280 нм, рассчитывали
концентрацию антител (коэффициент экстинкции был принят равным 1,37), с помощью иммуноферментного анализа (ИФА) повторно проверяли активность антител. Биотинилировали 0,5 мг антител. Полученные антитела хранили при 4°С с добавлением 0,05% NaN3.
Иммуноферментный анализ. На планшет для ИФА высокой сорбции сенсибилизировали антитела
в концентрации 10 мкг/мл по 100 мкл в лунку в течение 1,5 ч. После 3-кратной отмывки ФСБ с
0,05 %-ным Твином инкубировали с 0,1 %-ным раствором БСА в отмывочном буфере в течение 45
мин. Далее инкубировали с раствором антигена в блокирующем буфере и отмывали 3-кратно. После
инкубации с биотинилированными антителами в рабочем разведении 100 нг/мл следовала инкубация
с конъюгатом стрептавидина с пероксидазой хрена в рабочем разведении. Реакцию проявляли с помощью коммерческого набора (TMB substrate kit, “Thermo Scientific”, 34021) в соответствии с инструкциями производителя. Реакцию останавливали добавлением в лунку 50 мкл концентрированной серной кислоты и измеряли оптическую плотность при 450 нм на планшетном спектрофотометре (Zenyth 3100, “Anthos”).
Измерение концентрации ААТ. Концентрацию ААТ в сыворотках определяли с помощью описанного
ниже метода ИФА, а также иммунотурбидиметрическим методом в соответствии с инструкциями
производителя (Sentinel diagnostics). Измерения проводили в 96-луночных планшетах, пропускающих
в УФ-области (Corning), с помощью планшетного спектрофотометра (Zenyth 3100, “Anthos”).
В качестве калибровочных образцов были использованы разведения белка ААТ в пределах концентраций 0,1–300 нг/мл с шаговым разведением в 3 раза (8 разведений). Выбрали область с линейной зависимостью оптической плотности от концентрации ААТ и подобрали плотности, попадающие в эту область (1:600 тыс.). Калибровочные образцы и исследуемые образцы сыворотки тестировали на одной 96-луночной планшете в двух повторах.
Статистическую обработку данных проводили в программе STATISTICA 8.0 (StatSoft, Tulsa, OK,
США). Для оценки достоверности различий групп по одному признаку (концентрации ААТ в сыворотке) был выбран непараметрический U-тест Манна–Уитни, позволяющий попарно сравнивать группы разного объема с небольшими выборками. Разницу между группами считали достоверной, если достигаемый уровень значимости р был менее 0,05. Результаты и обсуждение. По итогам проведения
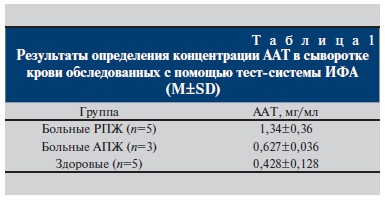
ИФА (табл. 1) было показано достоверное увеличение концентрации ААТ в сыворотке крови больных
РПЖ в отличие от здоровых волонтеров (p=0,009) и пациентов с АПЖ (p=0,025), а также достоверное
увеличение концентрации исследуемого белка при АПЖ по сравнению с группой здоровых волонтеров
(p=0,025).
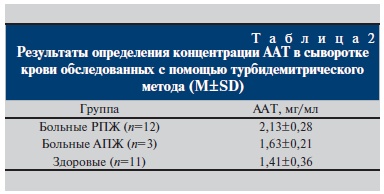
Для упрощения методики и ускорения проведения измерений тестировали возможности иммунотурбидиметрического метода определения ААТ. Метод основан на специфической реакции между анти-ААТ поликлональной антисывороткой и ААТ в растворе
при оптимальной рН раствора. Мутность раствора в присутствии иммунокомплекса пропорциональна
концентрации аналита в исследуемых образцах. Как видно из табл. 2, при РПЖ уровень ААТ в сыворотке достоверно выше, чем у здоровых добровольцев (p=0,00022) и больных АПЖ (p=0,0304), что
соответствует данным, полученным методом ИФА. Достоверных отличий показателей в группах пациентов с АПЖ и здоровых при использовании иммунотурбидиметрического метода выявлено не было (p=0,2429).
Обсуждение. Протеолитические ферменты играют важную роль в развитии опухоли. Изменения,
касающиеся содержания ингибитора протеаз ААТ при опухолевых заболеваниях различного происхождения, исследовались во многих работах. В большинстве из них обнаружено повышение уровня ААТ при раке [12–19]. Можно сделать вывод о целесообразности измерения содержания ААТ в сыворотке с прогностической целью.
В нашей работе сравнивались два метода определения ААТ в сыворотках пациентов с первично диагностированными АПЖ и РПЖ и здоровых добровольцев: ИФА с использованием очищенных поликлональных антител и иммунотурбидимитрический метод. Оба метода позволили выявить достоверное повышение концентрации ААТ в сыворотках крови пациентов с первично диагностированным РПЖ (p<0,03) по сравнению с больными АПЖ и здоровыми добровольцами. Эти данные согласуются с показателями, полученными методом радиальной иммунодиффузии [21, 22]. Однако в работе этих авторов группа РПЖ состояла из леченых больных и пациентов с первично диагностированным заболеванием, сравнивалась только с группой здоровых волотнеров. Ранее было показано, что высокие концентрации ААТ при печеночно-клеточной карциноме, раке легких и колоректальном раке могут быть ассоциированы с неблагоприятным прогнозом [23–25].
Основным источником ААТ являются клетки печени. В то же время имеются сведения, что некоторые типы опухолей также могут секретировать белок ААТ [6, 26]. Однако ААТ, секретируемый опухолевыми клетками, обладает измененным типом гликозилирования с увеличенным содержанием триветвящихся олигосахаридов [21, 26]. Ранее нами также было установлено, что изменения гликозилирования начинаются в клетках уже при АПЖ [21]. Используемый нами метод ИФА более чувствителен к изменениям концентраций ААТ в сыворотке (нижний предел детекции 3×10–7 г/л), чем иммунотурбидиметрический метод (нижний предел детекции – 0,1 г/л).
Использование более чувствительного метода позволило устанавливать достоверные отличия показателей группы АПЖ от группы здоровых волонтеров и показать, что повышение концентрации ААТ происходит уже при АПЖ, так же как и изменения в гликозилировании этого белка.
Кроме того, было важно проверить, изменяется ли содержание ААТ после гормональной терапии. Для
этого мы сравнивали уровень ААТ у одного и того же пациента до и после гормональной терапии. При
измерении методом иммунотурбидиметрии уровень ААТ после гормональной терапии (до брахитерапии) снизился почти в 1,5 раза до значений, характерных для пациентов с АПЖ. Это позволяет рассматривать ААТ в качестве потенциального маркера положительного ответа пациента на гормональную терапию. Для проверки этих результатов требуется проведение исследований на бόльших выборках.
Заключение. Использование сывороточных биомаркеров РПЖ представляется наиболее перспективным для ранней диагностики этого заболевания. Измеренные концентрации ААТ достоверно увеличиваются в ряду здоровые–больные АПЖ–больные РПЖ. Повышенная концентрация ААТ в сыворотке крови может являться тревожным фактором при диагностике заболеваний предстательной железы. Применение турбидиметрического метода для определения концентрации ААТ в сыворотке крови позволяет значительно ускорить анализ. Поскольку ААТ относится к мажорным белкам, чувствительности метода достаточно для детекции ААТ в сыворотке крови и его можно рекомендовать для ранней диагностики РПЖ.
Работа была проведена при финансовой поддержке ведомственной программы МГУ им. М. В. Ломоносова
по развитию постгеномных исследований и технологий.



