Введение. Рак предстательной железы (РПЖ) считается сегодня одной из самых серьезных медицинских проблем среди мужского населения. В структуре онкологической заболеваемости мужчин в ряде стран он стоит на втором-третьем местах после рака легкого и колоректального рака соответственно, а в США занимает первое место. Заболеваемость РПЖ в разных странах колеблется от 10 до 150 случаев на 100 тыс. населения в год [1]. К тому же в настоящее время РПЖ занимает второе место среди основных причин смерти от рака у мужчин [2]. Более того, с 1985 г. наблюдается небольшое увеличение числа летальных исходов от РПЖ в большинстве стран, включая страны и регионы, в которых он не распространен [3]. РПЖ чаще встречается среди пожилых мужчин. Вследствие этого он представляет большую проблему в развитых странах, где доля пожилых мужчин выше. Так, в развитых странах РПЖ составляет около 15% случаев рака у мужчин, тогда как в развивающихся странах – 4% [4]. Следует отметить, что уровень заболеваемости РПЖ существенно различается в зависимости от региона. Например, в Швеции, которая отличается высокой продолжительностью жизни и относительно низкой смертностью от заболеваний, связанных с курением, РПЖ являлся наиболее распространенной злокачественной опухолью у мужчин и составил 37% всех новых случаев рака в 2004 г. [5].
К основным средствам предварительной диагностики РПЖ относятся пальцевое ректальное исследование (ПРИ) и определение уровня простатспецифического антигена (ПСА) в сыворотке крови.
Определенную информацию дает трансректальное ультразвуковое исследование (ТРУЗИ). Однако
окончательный диагноз ставится при обнаружении аденокарциномы в биопсийном или послеоперационном материале предстательной железы. Патоморфологические исследования также позволяют стадировать и определять распространенность опухоли [6].
Одним из направлений работы Окружного урологического отделения (ОУО) Центрального административного округа (ЦАО) Москвы, расположенного на базе городской поликлиники № 68, является ранняя диагностика РПЖ в рамках действующей в городе подпрограммы целевых профилактических медицинских осмотров мужского населения. Больные с подозрением на РПЖ обращаются в ОУО ЦАО преимущественно по направлениям урологов городских поликлиник ЦАО.
Целью данного исследования явилась оценка результатов трансректальных биопсий предстательной железы (ПЖ), выполненных в течение 3 лет в амбулаторных условиях ОУО ЦАО на базе дневного стационара поликлиники.
Материалы и методы. С 9 ноября 2008 г. по 8 ноября 2011 г. в ОУО ЦАО выполнено 876 трансректальных биопсий ПЖ под ультразвуковым контролем. Для 769 (87,8%) пациентов биопсия была первичной, для 95 (10,8%) – повторной (второй), для 12 (1,4%) – повторной (третьей). Возраст пациентов составил от 40 до 86 лет (медиана – 67 лет). Объем ПЖ (по данным ТРУЗИ) варьировался от 13 до 193 см3 (в среднем 52,54 см3).
Уровень общего ПСА (ПСАобщ) в сыворотке крови перед биопсией колебался от 0,31 до 1000 нг/мл,
причем у 873 пациентов этот показатель находился в интервале от 1 до 493 нг/мл (медиана – 6,6); имелись еще 3 наблюдения с крайними значениями: 0,3; 0,9 и 1000 нг/мл.
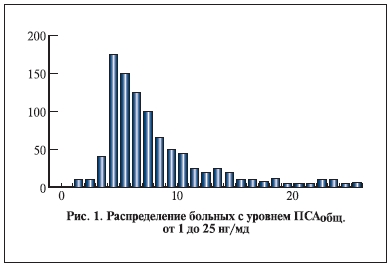
Почти все значения ПСАобщ (93%, n=812) расположены в интервале от 0 до 25 нг/мл, еще 4% (n=37) – от 25 до 50 нг/мл. Причем в интервале от 1 до 493 нг/мл половина (51%) всех показателей пришлась на значения от 5 до 10 нг/мл.
Распределение больных с уровнем ПСАобщ в пределах 1–25 нг/мл представлено на рис. 1.

В 829 (94,6%) наблюдениях перед биопсией наряду с общим ПСА был определен также уровень свободной фракции ПСА (ПСАсвоб) в сыворотке крови. Соотношение ПСАсвоб/ПСАобщ составило от 0,13 до 50% (в среднем 12,87%), плотность ПСА – от 0,008 до 10,56 нг/мл/см3 (в среднем 0,311 нг/мл/см3).
Для выполнения биопсии ПЖ больных с отягощенным соматическим статусом урологи территориальных поликлиник обычно направляют на госпитализацию в урологические отделения стационаров города. Подготовка пациента, направленного в ОУО ЦАО, включает тщательную оценку результатов амбулаторного обследования, проведенного в территориальной поликлинике и в ОУО (общий
анализ крови, коагулограмма, анализы крови на ПСА, глюкозу, сифилис, вирусные гепатиты В и С,
ВИЧ, общий анализ мочи, ТРУЗИ ПЖ с определением количества остаточной мочи, ЭКГ, консультация терапевтом), 7-дневное воздержание от приема антикоагулянтов и антиагрегантов, 2 очистительные клизмы. За сутки до биопсии пациент начинает прием антибактериального препарата (обычно
ципрофлоксацина по 0,5 г 2 раза в сутки либо в зависимости от результата бактериологического исследования секрета ПЖ или эякулята, если таковое выполнялось, другого антибиотика). Большинству
пациентов биопсия выполняется на фоне приема α1-адреноблокатора. Утром в день биопсии пациент
госпитализируется на койку дневного стационара поликлиники, подписывает информированное
согласие на проведение диагностической манипуляции. В качестве премедикации мы используем
внутримышечное введение нестероидного противовоспалительного препарата (обычно кеторолака
трометамин 1 мл/30 мг) в сочетании с блокатором гистаминовых Н1-рецепторов (хлоропирамина гидрохлорид 1 мл/20 мг).
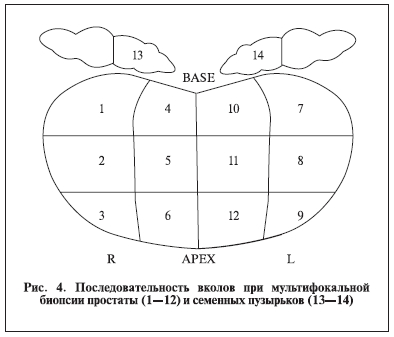
Для определения числа забранных проб ткани ПЖ (при первичной биопсии и уровне ПСА от 2 до 10 нг/мл) мы используем так называемую венскую номограмму, в которой число проб зависит от возраста пациента и объема ПЖ, что позволяет избегать не только излишней, но и недостаточной диагностики (табл. 1) [7].

Манипуляцию выполняет врач, имеющий действующие сертификаты по урологии и ультразвуковой
диагностике, при участии специально подготовленной медицинской сестры. Пациента укладывают в
смотровое кресло с ногами, согнутыми в коленях. Выполняется асептическая обработка перианальной
области кожным антисептиком. С целью обезболивания в ампулу прямой кишки вводится гель для
местного применения “катеджель с лидокаином” (100 г содержат лидокаина гидрохлорид 2 г и хлоргексидина дигидрохлорид 0,05 г) в количестве 12,5 г (1 шприц), экспозиция – 8–10 мин. Наш 3-летний опыт выполнения биопсии трансректальным доступом позволяет утверждать, что данного вида анестезии вполне достаточно и в абсолютном большинстве случаев дополнительного обезболивания не требуется.
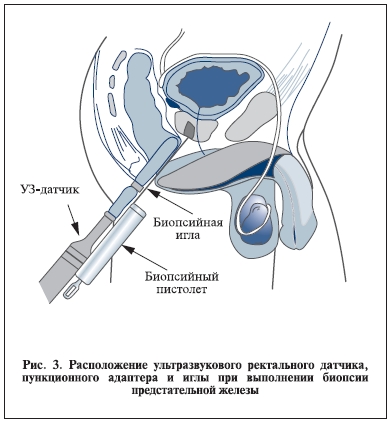
Используются ультразвуковой сканер SSD-900 ALOKA (Япония) с ректальным датчиком, видеопринтером, пункционным адаптером, механическое устройство для скоростной пункционной биопсии (“пистолет”) Pro-Mag ULTRA “PBN Medicals Denmark A/S” (Дания) (рис. 2) и стерильная одноразовая игла G16. На ультразвуковой ректальный датчик надевается презерватив, смазанный гелем. Затем на датчике фиксируется пункционный адаптер для проведения иглы. После этого непосредственно на фиксированный ранее пункционный адаптер надевается второй презерватив с гелем.
До введения датчика выполняется ПРИ, при этом определяются локализация и размер подозрительных на наличие РПЖ участков. Затем в прямую кишку вводится ультразвуковой датчик с пункционным адаптером и выполняется ультразвуковое исследование ПЖ и семенных пузырьков (рис. 3) в продольной и поперечной плоскостях.
Для того чтобы избежать непроизвольного резкого движения пациента во время первого вкола
иглы, мы в присутствии больного до начала процедуры биопсии производим так называемый холостой выстрел.
На изображение ПЖ на экране ультразвукового сканера с помощью специальной опции аппарата
накладывается пунктирная направляющая, вдоль которой и происходит перемещение биопсийной
иглы в процессе биопсии.
При заборе материала биопсийная игла вводится в ткань на глубину, как правило, 22 мм, при этом
длина столбика ткани составляет 17 мм, а диаметр – около 1,2 мм. Каждый столбик ткани ПЖ помещается в отдельную пробирку типа “эппендорф” с 10%-ным (pH-нейтральным) формалином,
маркированную в соответствии с долей железы, локализацией укола в пределах конкретной доли (рис. 4). Материал фиксируется в течение 20–24 ч.
Общая продолжительность манипуляции составляет не более 15–20 мин. По ее окончании выполняется ПРИ для оценки степени ректоррагии, после чего в зависимости от полученных данных производится временная мануальная компрессия зоны биопсии с целью гемостаза и/или установка в прямую кишку марлевого мазевого (левомицетин 0,75 г, метилурацил 4 г, основа до 100 г) тампона. В редких случаях с гемостатической целью в прямую кишку дополнительно вводится катетер Фолея с последующей компрессией раздутым баллоном кровоточащих сосудов (на несколько часов). Инъекции гемостатиков (этамзилат) выполнялись по показаниям.
После проведения манипуляции пациент в сопровождении медперсонала переводится в палату дневного стационара, где под наблюдением находится в течение 3–4 ч (контроль АД, пульса, ректального марлевого тампона, количества и качества мочеиспусканий). В случае отсутствия острой задержки мочеиспускания, уретроррагии, значимых ректоррагии и макрогематурии больной выписывается под наблюдение уролога территориальной поликлиники. Антибактериальная терапия
продолжается в течение 4 сут., при наличии показаний продлевается.
Патогистологические исследования столбиков ткани ПЖ выполнялись в отделении патологической анатомии МНИОИ им. П. А. Герцена.
Каждый фрагмент ткани простаты выпрямляли и измеряли, длину столбика ткани (в мм) заносили
в протокол исследования. Фрагменты заливали в парафин, тщательно распределяя в кассете для
получения полноценных срезов. Затем изготавливали серийные срезы толщиной 4–5 мкм, окрашивали гематоксилином и эозином. Проводили гистологическое исследование непрерывных полноценных срезов ткани простаты с указанием площади поражения в процентах (в случае выявления рака), а
также степени дифференцировки РПЖ (сумма баллов по Глисону). В исключительных случаях выполняли уточняющие иммуногистохимические исследования.
Статистическая обработка данных проводилась методами описательной статистики, частотного и
дисперсионного анализов; результаты считали статистически значимыми при p<0,05.
Результаты и обсуждение. Результатом выполненных за 3 года 876 биопсий ПЖ стали 372 (42,5%)
случая впервые выявленного РПЖ. По гистологическому строению во всех случаях имела место аденокарцинома. В результате первичной биопсии рак выявлен среди 43,4% (334/769; 95% ДИ – 40–47) больных, в результате повторной (второй) биопсии – среди 36,8% (35/95; 95% ДИ – 27–48), в результате третьей – среди 25% (3/12; 95% ДИ – 6–57) (табл. 2). Таким образом, после первичной биопсии ПЖ каждый десятый случай рака, который мог быть выявлен этой диагностической процедурой, оставался невыявленным и только в результате двух повторных биопсий эти 10% обнаруживались. Вероятность выявления РПЖ при каждой следующей биопсии снижалась (от 43,4% при первичной биопсии до 36,8% при вторичной и до 25% при третичной биопсии).
Таблица 2. Выявляемость РПЖ в зависимости от количества выполненных биопсий.
Таблица 3. Распределение результатов гистологического исследования в зависимости от показателей ПСА.
Результаты патоморфологического исследования столбиков ткани ПЖ, полученных при трансректальных биопсиях, представлены в табл. 3. В группе пациентов с уровнем ПСАобщ ниже 2,5 нг/мл преобладала АПЖ с ПИН низкой степени; в группах пациентов с уровнем ПСА 2,5–4 и 4–10 нг/мл
практически с равной частотой встречалась АПЖ с ПИН низкой степени и РПЖ; в группах пациентов
с ПСА 10–20 и более 20 нг/мл существенно превалировал РПЖ.
Анализ распределения уровня ПСАобщ для разных гистологических вариантов (рис. 5) показывает, что
при РПЖ значения показателя ПСАобщ статистически значимо смещены в сторону высоких значений (p=0,04; критерий Стьюдента с поправкой Бонферрони): в 2/5 случаев (примерно 40%) при РПЖ ПСАобщ выше 10 нг/мл это в 3–10 раз больше, чем при других гистологических вариантах заболеваний простаты.
Рисунок 5. Распределение результатов гистологического исследования в соответствии с уровнем ПСАобщ.
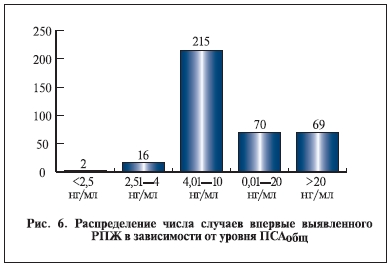
В 215 (57,8%) наблюдений из 372 РПЖ был впервые выявлен в группе пациентов с уровнем ПСАобщ 4,01—10 нг/мл (рис. 6), что свидетельствует о результативности проводимой в Москве с 2002 по 2011 г. работы, когда анализы крови на ПСА выполнялись практически каждому мужчине в возрасте 50–79 лет, обратившемуся к любому врачу своей территориальной поликлиники. Это позволило фиксировать у пациентов повышение уровня ПСА в сыворотке крови, когда данный показатель находится еще в пределах так называемой серой зоны, что несомненно способствует ранней диагностике РПЖ.
В группе пациентов с ПСАсвоб/ПСАобщ >15% по результатам патогистологического исследования
биоптатов ПЖ преобладала АПЖ с ПИН низкой степени. В группе пациентов с ПСАсвоб/ ПСАобщ
<15% чаще выявлялся РПЖ (см. табл. 3). У 286 (81,7%) из 350 пациентов с впервые выявленным
РПЖ ПСАсвоб/ПСАобщ было менее 15%, что подтверждает положение о целесообразности тестирования данного показателя на этапе определения показаний к выполнению биопсии ПЖ [8].
В группе пациентов с плотностью ПСА≥0,15 нг/мл/см3 по сравнению с пациентами с плотностью
ПСА≥0,15 нг/мл/см3 было на 50,7% меньше случаев АПЖ (см. табл. 3), на 51% – количество случаев
АПЖ в сочетании с ПИН низкой степени и на 90,6% больше случаев РПЖ. Однако, поскольку РПЖ в
результате биопсии все же выявлен среди 27,4% пациентов с плотностью ПСА<0,15 нг/мл/см3 (у 128
из 467) и не выявлен среди 40,3% пациентов со значением данного показателя более 0,15 нг/мл/см3 (у
165 из 409), для определения показаний к биопсии ПЖ плотность ПСА следует рассматривать в комплексе с другими параметрами (ПСАобщ, ПСАсвоб/ПСАобщ данные ПРИ и ТРУЗИ). Вместе с тем, по
нашим данным, частота выявления ПИН высокой степени и АМП выше в группе пациентов с плотностью ПСА<0,15 нг/мл/см3, что может показаться не совсем логичным.
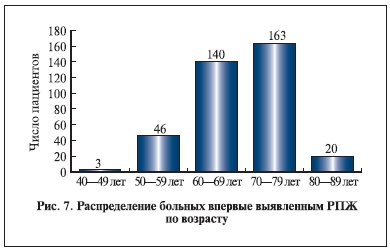
РПЖ чаще диагностировали среди мужчин в возрасте 70–79 (43,8%) и 60–69 (37,6%) лет (рис. 7).
Выявляемость РПЖ с использованием стандартных методик биопсии значительно снижается при увеличении объема ПЖ (рис. 8). Поскольку средний объем ПЖ всех пациентов, подвергшихся биопсии, составил 52,54 (130–193) см3, следовало бы ожидать относительно равномерной выявляемости рака в группах больных с разными объемами простаты. Однако возможность обнаружить РПЖ с использованием стандартных методик биопсии при объеме простаты более 70 см3 значительно
снижается. Из этого следует, что при объеме ПЖ более 70 см3 даже при первичных, но особенно при
повторных биопсиях следует использовать расширенную (сатурационную) технику, предусматривающую возможность получения большего числа столбиков ткани. Однако использование данной методики сопряжено с повышенной опасностью осложнений (кровотечение, острая задержка мочеиспускания, острый простатит), поэтому проведение ее в амбулаторных условиях нежелательно.
Рисунок 8. Распределение больных с впервые выявленным РПЖ в зависимости от объема ПЖ.
Как видно из табл. 4, более злокачественные формы РПЖ встречались при более высоких цифрах ПСАобщ, ПСАсвоб/ПСАобщ≥15% и плотности ПСА≥0,15 нг/мл/см3, что соответствует данным литературы [8, 9].
Таблица 4. Степень дифференцировки РПЖ (сумма баллов по Глисону) в зависимости от уровня ПСАобщ.
За весь период выполнения трансректальных биопсий ПЖ в амбулаторных условиях были зарегистрированы следующие осложнения: макрогематурия, возникшая в домашних условиях, потребовавшая госпитализации в урологический стационар, – 1 (0,1%) больной; острый простатит, развившийся в домашних условиях, потребовавший госпитализации в урологический стационар, – 2 (0,2%); ректальное кровотечение, потребовавшее экстренного перевода больного из дневного стационара поликлиники в урологический стационар, – 2 (0,2%); острая задержка мочеиспускания, не потребовавшая госпитализации, – 4 (0,5%).
Выводы
1. Биопсия ПЖ является рутинной и относительно безопасной диагностической манипуляцией, выполнение которой возможно в амбулаторных условиях, желательно – на базе дневного стационара. Больные с отягощенным общесоматическим статусом для выполнения биопсии должны госпитализироваться в урологическое отделение многопрофильной больницы.
2. Биопсия, выполненная трансректальным доступом, хорошо переносится пациентами. Для анастезии в абсолютном большинстве случаев достаточно введения в ампулу прямой кишки “катеджеля с
лидокаином” с экспозицией 8–10 мин.
3. Для определения числа забранных проб ткани ПЖ (при первичной биопсии и уровне ПСА от 2 до
10 нг/мл) целесообразно использовать так называемую венскую номограмму. При объеме ПЖ
более 70 см3 даже при первичных, но особенно при повторных биопсиях, а также при уровне ПСА
более 10 нг/мл следует использовать расширенную (сатурационную) технику. Однако использование
данной методики в амбулаторных условиях нежелательно в связи с опасностью осложнений (кровотечение, острая задержка мочеиспускания, острый
простатит).
4. Выявляемость РПЖ во многом определяется качеством патогистологического исследования
биопсийного материала. Для повышения данного показателя мы рекомендуем в каждом случае составлять карту ПЖ и использовать число контейнеров с биоматериалом, равное числу полученных столбиков ткани.
5. Нами выполнено 69,7% биопсий при уровне общего PSA 4,01–10 нг/мл. В 57,8% наблюдений РПЖ
был впервые выявлен в группе пациентов именно с таким уровнем общего ПСА, что подтверждает
целесообразность скрининга РПЖ, проводимого в Москве в течение последних 10 лет, когда анализы
крови на ПСА выполнялись практически каждому мужчине 50–79 лет, обратившемуся к любому
врачу своей территориальной поликлиники. Это позволяет своевременно фиксировать у пациентов
повышение уровня ПСА сыворотки крови, когда данный показатель находится еще в пределах так
называемой серой зоны, что несомненно способствует ранней диагностике РПЖ.
6. При РПЖ значения показателя ПСАобщ статистически значимо смещены в сторону высоких цифр.
7. На этапе определения показаний к биопсии ПЖ целесообразно определять ПСАсвоб/ПСАобщ, так как для 81,7% пациентов с впервые выявленным РПЖ соотношение ПСАсвоб/ПСАобщ было менее 15%.
8. Показатель плотности ПСА для определения показаний к биопсии ПЖ следует учитывать в комплексе с другими параметрами – ПСАобщ, ПСАсвоб/ПСАобщ, данные ПРИ и ТРУЗИ.
9. Более злокачественные формы РПЖ (в соответствии с суммой баллов по Глисону) встречаются
при более высоком уровне ПСАобщ, ПСАсвоб/ПСАобщ <15% и плотности ПСА>0,15 нг/мл/см3.



