Введение. Существующая избирательность локализации узлов аденомы и рака в разных дольках
предстательной железы [1, 2] определяет интерес к изучению конструкции мышечных элементов вокруг желез в каждой из ее долек и к их микроокружению. Еще O. Lowsley [3], J. McNeal [4] выявили различия архитектоники желез центральной и периферической зон простаты. Подобных сведений относительно переднемедиальных долек (промежуточной зоны по J. McNeal) в литературе не представлено. Отсутствуют данные о различиях в конструкции микрососудистых сетей вокруг разных по строению желез простаты и в участках мышечной ткани с разной ориентацией миоцитов и поперечнополосатых мышечных волокон. Установлена важная роль характера ангиогенеза, состояния гемомикроциркуляторного русла в патогенезе и, соответственно, в прогнозе рака простаты [5–7]. Имеются данные о более высоком удельном объеме микрососудов в узлах аденомы простаты [8].
Целью настоящего исследования было выявить особенности структурной организации микрососудистых комплексов мышечных пучков и желез в патологически неизмененной простате лиц мужского пола разных возрастов.
Материалы и методы. Конструкция микроциркуляторного русла и его микроокружения изучена на
материале аутопсий 103 простат человека, полученных от плодов начиная с 20-й недели эмбрионального развития, и лиц мужского пола в возрасте до 83 лет. Исследование проведено на тотальных и субтотальных срезах органа, выполненных в горизонтальной, фронтальной и сагиттальной плоскостях относительно оси уретры. Использовали гистологические окраски гематоксилином и эозином, а также галлоцианином и пикрофуксином (по ван Гизону). Коллагеновые и ретикулярные волокна окрашивали азокармином по Heidenhain. Щелочную фосфатазу выявляли по методу Gomori. Для изучения гемомикроциркуляторного русла использован безинъекционный метод В. В. Куприянова (1965) и аденозин-свинцовый метод А. М. Чилингаряна (1977) в модификации А. Г. Сапожникова и П. Ф. Степанова [9]. Морфометрические параметры основных структурных компонентов и гемомикроциркуляторного русла различных отделов простаты определены на препаратах, импрегнированных по В. В.Куприянову, окрашенных аденозин-свинцовым методом, азокармином по Heidenhain. Для морфометрического исследования использованы микроскоп Leica DM 2000, цифровая камера Leica D-LUX 3, программа Leica IM500.
В нижнезадней, нижнелатеральной, верхнемедиальной и переднемедиальной дольках простаты подсчитана толщина гладкомышечных пучков первого и второго порядков и их слоев, интервалы между пучками; оценивали их ориентировку (строгая, предпочтительная и случайная) путем замера углов между объектами и направляющей линией [10].
Статистическая обработка результатов морфометрического исследования проведена с использованием программ Microsoft Excel 2003 и Statistica 6,0 for Windows.
Результаты. По периферии простаты плодов 20–22 нед выявлены миоциты в виде пучков и отдельно лежащих клеток. В переднем отделе органа расположен слой поперечнополосатых мышечных волокон, ориентированных во фронтальной плоскости. Латерально и дорсально от простатической части уретры обнаружены эпителиальные тяжи и трубочки. Гемомикроциркуляторное русло органа представлено протокапиллярами и формирующимися сетями микрососудов. Степень дифференцировки стенки микрососудов выше на периферии органа. Встречаются железистые трубочки, приобретающие визуально определяемый просвет. Они неплотно окружены пучками гладких миоцитов. Гладкомышечные пучки расположены главным образом по периферии органа в наружной зоне. Большинство пучков локализуется в плоскости близлежащего участка капсулы простаты. Они образуют волнообразные структуры, между которыми в соединительнотканных прослойках заключены эпителиальные зачатки.
На 24–26-й неделях развития железистый эпителий выявляется в виде тяжей, трубочек, формирующихся концевых отделов желез (на периферии органа) и выводных протоков (ближе к центру органа). Пучки миоцитов разной толщины приобретают циркулярную и продольную ориентацию к оси выводных протоков и не имеют строгой ориентации вокруг формирующихся железистых альвеол и трубочек.

В 38–40 нед уже имеются сформированные нижнелатеральные дольки, выводные протоки и концевые
отделы желез, которые имеют просвет. Ближе к уретре выявлены выводные протоки и эпителиальные
тяжи. Вокруг желез по мере их развития сформированы вначале узловые микрососуды, имевшие вид
капиллярного кольца с отходящими от него капиллярными почками, затем однослойные капиллярные
и капиллярно-посткапиллярные сети. Вокруг растущих выводных протоков обнаружены однослойные капиллярные сети, ориентированные вдоль оси протока (рис. 1). Впереди уретры в пучках поперечнополосатых мышечных волокон и миоцитов других участков простаты сформированы микрососудистые комплексы, капиллярные сети которых ориентированы продольно по отношению к кровоснабжаемым пучкам миоцитов и волокон (рис. 2). Усложнение формирующихся микрососудистых комплексов в простате плодов 36–40 нед происходит преимущественно по типу роста "капилляра от капилляра".
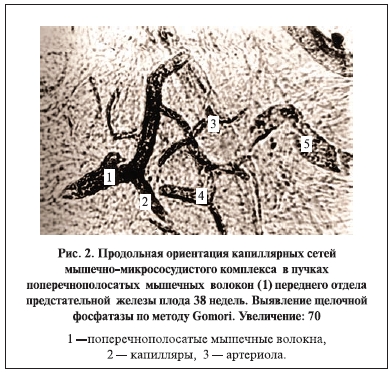
У новорожденных увеличено количество ориентированных пучков миоцитов. Вокруг железистого эпителия капилляры расположены в основном циркулярно, а возле сформированных концевых отделов
желез образованы однослойные капиллярно-посткапиллярные "корзинчатые" сети.
В течение первого года жизни секреторная функция эпителия постепенно снижается во всех отделах простаты. При этом почти на 25% уменьшается суммарный объем кровеносного русла, особенно его микрососудистой части (p<0,01). Такое резкое снижение объема гемомикроциркуляторного русла произошло за счет капиллярно-венулярного звена, причем доля капилляров в структуре простаты уменьшилась (p<0,01) по сравнению не только с новорожденными, но и с плодами последних недель пренатального периода. Снижение функциональной нагрузки на гемомикроциркуляторное русло способствует формированию в нем артериоловенулярных анастомозов.
В период 4–7 лет в прилежащих к боковой поверхности уретры участках начинается формирование
желез переднемедиальных долек. Этот процесс сопровождается достоверным (p<0,01) повышением возле них удельного объема капилляров. К 7 годам артериолы и венулы в передних отделах простаты
в пучках поперечнополосатых мышечных волокон и миоцитов приобретают извитой ход. Ориентация
их и отходящих от них прекапилляров – поперечная или косая относительно оси мышечного пучка.
Затем прекапилляры начинают ориентироваться вдоль оси пучка и отдают капилляры, имеющие преимущественно такую же ориентацию.
К 16 годам формируются типичные разветвленные альвеолярно-трубчатые железы. Вокруг формирующихся и растущих железистых долек увеличивается количество миоцитов и эластических волокон. Образуется “мышечный футляр” простаты.
Для желез простаты юношей (17–21 год) характерна цикличность секреторных процессов. Увеличение размеров концевых отделов желез, высокая секреторная активность эпителия сопровождаются формированием разветвленных многослойных микрососудистых сетей. Ветвления микрососудов на поверхности концевых отделов с активной секрецией имеют вид “аркад” за счет большого количества межкапиллярных связей между системами разных артериол. Между "аркадными" сетями наряду с капиллярными выявляются артериолоартериолярные, венуловенулярные и артериоловенулярные анастомозы, чаще – с регулируемым кровотоком. Капилляры внутреннего к просвету концевого отдела железы слоя многослойной сети могут непосредственно контактировать с эпителием. Капилляры "заходят" во все выросты эпителия в просвет железы и даже как бы "раздвигают" базальный слой эпителия (рис. 3).

К 22 годам вокруг желез еще более разветвленный вид приобретают микрососудистые “корзинки”, а микрососудистые сплетения выводных протоков построены по типу сосудистых аркад. Для них характерно наличие двух, чаще трех, рядов прекапиллярно-капиллярно-посткапиллярных дуг, ориентированных по ходу протока (рис. 4). Для простаты мужчин первого периода зрелого возраста (22–35 лет) характерна разная направленность и плотность расположения пучков миоцитов вокруг и между альвеолами концевых отделов желез различных долек органа. Содержание секрета в просветах разных желез неодинаково. Как правило, в одном и том же органе, в разных участках даже одной дольки степень заполнения секретом концевых отделов и выводных протоков различна.

В зрелом возрасте миоархитектоника простаты максимально усложняется, достигая своего пика к 30
годам. Миоциты одного слоя объединены в пучки, в которых они имеют предпочтительную ориентацию. Количество миоцитов, окружающих выводные протоки, значительно увеличивается, что указывает на повышение эвакуаторной функции. Вокруг концевых отделов пучки миоцитов располагаются в два-три слоя с различной ориентацией. Миоциты внутреннего слоя обычно ориентированы циркулярно, а наружного – продольно. В участках, где количество миоцитов максимально, пучки объединяются в пласты.

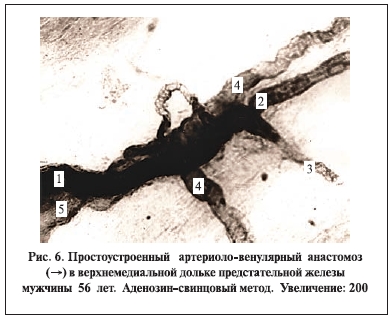
В процессе возрастной инволюции, имеющей индивидуальные особенности, происходит увеличение размеров кистозно расширенных просветов концевых отделов желез при параллельном снижении доли эпителия, что связано с его атрофией. При этом уменьшается удельный объем мышечной ткани. В большей степени на периферии долек гладкие мышечные клетки приобретают хаотичное расположение. Снижаются удельные объемы капилляров и всего гемомикроциркуляторного русла, что вызвано разреженностью микрососудистых сетей при увеличении диаметра микрососудов, но еще
сохраняется “корзинчатость” строения железистомикрососудистых комплексов (рис. 5, 6). Они больше напоминают таковые у детей, т.е., как правило, становятся однослойными. Разреженность микрососудистых сетей вызывает достоверное (p<0,001) уменьшение удельных количеств всех видов
микрососудов.
Обсуждение. Полученные данные о структурных преобразованиях желез, мышечных элементов и
компонентов соединительной ткани в простате человека свидетельствуют о том, что в разные возрастные периоды процессы роста и дифференцировки различных ее структур протекают неравномерно, постоянно изменяются взаимоотношения основных компонентов органа и звеньев его кровеносного русла. Железы верхнемедиальной дольки простаты раньше других участков достигают функциональной зрелости. В мелких концевых отделах желез нижнезадней и нижнебоковой долек секрет появляется у подростков после 13 лет, а железы переднемедиальной дольки только начинают формироваться в 7–8 лет. В 16–17 лет активная секреция присуща всем железам простаты, как сформировавшимся, так и растущим. Морфологические отличия желез верхнемедиальной и нижнебоковой долек простаты начинают определяться с 12 лет.
Кровеносное русло простаты развивается и преобразуется адекватно потребностям кровоснабжаемых
структур. В 20–22 нед эмбриогенеза оно представлено венами и единичными артериями, расположенными по периферии органа, протокапиллярами и формирующимися сетями микрососудов внутри органа. Процесс развития и переориентации микрососудистых сетей вокруг формирующихся желез и мышечных пучков в простате в конце эмбриогенеза приводит к образованию модульных конструкций гемомикроциркуляторного русла: микрососудисто-железистых и микрососудисто-мышечных комплексов.
Процессы возрастной инволюции в простате и ее кровеносном русле протекают вне строгой привязанности к возрасту мужчины и носят индивидуальный характер. Общая тенденция инволютивных изменений гистоструктуры простаты позволяет предполагать, что инволюция органа начинается с паравазальных зон. Причиной, по нашему мнению, является повышение гидродинамической нагрузки на венозное русло простаты. Все дальнейшие преобразования структур органа укладываются в картину развития стойкого хронического венозного застоя.
Выводы
1. Внутриорганное кровеносное русло простаты формируется в соответствии с развитием основных
структурных компонентов органа, изменяясь в периоды их преобразования.
2. Конструкция микрососудисто-железистых комплексов отражает морфофункциональное состояние
кровоснабжаемых желез и имеет возрастные отличия.
3. В простате человека характер взаиморасположения и степень взаимоудаленности пучков гладких миоцитов и простатических желез в различных дольках неодинаковы, определяются строением последних и интенсивностью их секреции в зависимости от групповой принадлежности (периуретральные, подслизистые и главные) и возраста.


