Введение. Метаболический синдром (МС) определяют как совокупность абдоминального ожирения, нарушения углеводного и липидного обменов и артериальной гипертензии; он расценивается как фактор высокого риска развития сахарного диабета и заболеваний сердечно-сосудистой системы [1], хотя встречается и более широкое понимание МС как нарушение обмена веществ в целом [2, 3].
Согласно международному консенсусу [4], МС подразумевает наличие как минимум трех из пяти признаков:
- центральное ожирение (объем талии более 102 см),
- повышенный уровень триглицеридов в плазме крови (≥1,7 ммоль/л),
- повышенное артериальное давление (систолическое ≥130 мм рт.ст. и/или диастолическое ≥85 мм рт.ст.) или пациент получает гипотензивную терапию,
- уровень глюкозы в крови натощак ≥6,1 ммоль/л или пациент получает лечение по поводу сахарного диабета,
- снижение уровня липопротеидов высокой плотности <1,03 ммоль/л или пациент получает терапию по поводу дислипидемии.
Комплексное обследование 171 бесплодного мужчины показало, что только у 44,4% из них не было ни одного компонента МС [5]. Исследователи не установили связи между МС и качеством эякулята, за исключением достоверно более частого нарушения морфологии спермиев. Также не обнаружено корреляции между МС, лейкоспермией и бактериоспермией. Однако пациенты, имевшие три и более компонентов МС, достоверно чаще демонстрировали признаки воспаления предстательной железы (увеличение ее объема, эхогенная неоднородность при УЗИ, повышение уровня IL-8) [5]. Причем чем более выражен МС, тем более выражено воспаление предстательной железы, которое определяли по данным УЗИ и уровню IL-8 [6, 7]. Следует отметить, что очаги обызвествления в паренхиме предстательной железы все авторы трактовали как простатолитиаз, хотя отечественные исследователи показали, что зачастую эти участки являются кальцинированными очагами самоизлеченного туберкулеза [8–12].
Усматривают безусловную связь между тяжестью МС и степенью выраженности морфологических нарушений спермиев, но отрицают корреляцию между интенсивностью воспаления предстательной железы у больного МС и качеством его эякулята [13]. И. А. Тюзиков [14] отметил склонность инфекции предстательной железы к персистенции у мужчин с сахарным диабетом и также рекомендовал наряду с коррекцией МС восстанавливать уровень половых гормонов.
Показано, что доля инфертильных мужчин среди пациентов с МС статистически значимо выше [15]. Метаболический синдром провоцирует и усугубляет хроническую системную воспалительную реакцию [16], что особое значение может иметь для больных туберкулезом. Гипогонадизм, свойственный лицам с МС, может быть обусловлен и хроническим воспалением, ингибирующим синтез тестостерона [17, 18]. Дислипидемия и провоспалительный статус сопровождаются увеличением интенсивности перекисного окисления липидов, обусловливающего повреждение мембраны спермиев, изменение их морфологии и подвижности [19]. У мужчин с ожирением достоверно хуже параметры спермограммы [20].
Несмотря на довольно большое число работ, посвященных изучению связи МС и мужского бесплодия, к единому заключению прийти трудно, так как все исследования проведены на ограниченных выборках.
Метаболический синдром негативно влияет на один из ведущих параметров фертильности эякулята – морфологию спермиев. Сочетание МС и хронического инфекционно-воспалительного процесса в предстательной железе способствует развитию гипогонадизма, что в свою очередь усугубляет течение хронического простатита и МС, формируя таким образом порочный круг. Влияние МС на фертильность эякулята у больных туберкулезом предстательной железы (ТПЖ) не изучено.
Цель исследования. Определение влияния метаболического синдрома на показатели эякулята у больных (ТПЖ).
Материалы и методы. Проведено открытое проспективное сравнительное когортное исследование, в которое включили 72 пациента с ТПЖ, госпитализированных в отделение урогенитального туберкулеза ФГБУ ННИИТ МЗ РФ в период с 2012 по 2014 г.
Критерии включения в исследование: мужчины в возрасте 20–60 лет, активный туберкулез простаты, возможность получения эякулята путем мастурбации.
Критерии исключения: возраст младше 20 или старше 60 лет, азооспермия (отсутствие сперматозоидов в эякуляте), аспермия (отсутствие эякулята), сопутствующие онкологические заболевания, инфекции, передающиеся половым путем (ИППП), в период проведения исследования, алкоголизм и наркомания, эндокринные заболевания, влияющие на уровень тестостерона (анорхизм, монорхизм, синдром Клайнфельтера, синдром Каллманна, пангипопитуитаризм, гипотиреоз, опухоли гипофиза), лекарственно обусловленное снижение секреции тестостерона (прием глюкокортикоидов, антиандрогенов, эстрогенов), сахарный диабет 1 типа, стадия декомпенсации сопутствующих соматических и/или психических заболеваний, ВИЧ-инфекция.
Всем больным проводили стандартное клиническое обследование: общие анализы мочи и крови, биохимическое исследование крови, бактериоскопическое и бактериологическое исследование мочи, секрета простаты и эякулята. Кроме того, выполняли микроскопическое исследование секрета простаты, при этом пациент должен был воздерживаться от семяизвержения в течение не менее суток до исследования. Для исключения перемешивания секрета предстательной железы с уретральным содержимым перед данной манипуляцией больной должен был помочиться. Материал для исследования получали путем изгоняющего пальцевого массажа предстательной железы. Каплю полученного секрета распределяли по предметному стеклу тонким слоем, накрывали покровным стеклом. Исследовали нативный материал секрета предстательной железы, доставленный в лабораторию в срок не позднее 30 мин с момента его получения. Микроскопическое исследование проводили посредством микроскопа CarlZeiss (Германия) при увеличении 7х40, при этом оценивали следующие параметры: количество лецитиновых зерен (липоидных телец), лейкоцитов, эритроцитов и клеток эпителия.
Воспаление предстательной железы констатировали при обнаружении в нативном препарате секрета простаты более 10 лейкоцитов в поле зрения и снижении числа лецитиновых зерен до уровня 2 и ниже. Количество лецитиновых зерен в локальной лаборатории определяют в градации от «0» – не обнаружены в поле зрения, до «3» – много; количественный подсчет не выполняют.
По результатам обследования выявляли факторы, являющиеся критерием диагностики МС. Наличие МС констатировали при выявлении как минимум трех из вышеперечисленных признаков.
Всем пациентам исследуемой группы выполняли спермограмму. Согласно рекомендациям ВОЗ (5-е издание, 2010), эякулят должен быть получен по прошествии 2–7-дневного периода полового воздержания. В нашем исследовании для получения более достоверных и сравнимых результатов был установлен одинаковый срок полового воздержания – 3 сут. Материал для исследования получали в изолированной комнате, расположенной на территории урогенитального отделения для лечения больных мочеполовым туберкулезом, путем мастурбации и собирали в чистую, стерильную емкость из нетоксичного пластика с широким горлышком. Доставку материала осуществляли при температуре 20–30°С не позднее 20 мин после получения эякулята в контейнере, на котором были указаны идентификационный номер пациента, дата и время получения эякулята.
Оценка эякулята предполагала определение следующих параметров: время разжижения, объем, вязкость, рН, концентрация, количество сперматозоидов, их морфология.
Время разжижения. Контейнер с эякулятом помещали в термостат при 37°С на 25–30 мин. Перемешивали 1 раз в 8–10 мин колебательными движениями. Через 25–30 мин оценивали степень разжижения. За норму принимали разжижение образца эякулята в течение 60 мин.
Вязкость. В эякулят опускали стеклянную палочку и наблюдали за длиной нити, которая тянется за палочкой после ее выведения из эякулята. Если образовывалась нить длиной более 2 см, регистрировали повышенную вязкость.
Объем материала исследовали с помощью градуированной стеклянной пробирки. Минимальным референсным значением для объема эякулята является 1,5 мл.
рH измеряли через стандартный промежуток времени – 30 мин. Для этого каплю эякулята наносили на индикаторную полоску бумаги. Через 30 с, когда полоска становилась равномерно окрашенной, ее цвет сравнивали с калибровочными стандартами. За нормальные показатели принимали значения, расположенные в пределах 7,2–8,0.
Микроскопическое исследование эякулята. Первоначальную микроскопическую оценку эякулята проводили под световым микроскопом («CarlZeiss», Германия) при увеличении 7х40. На первом этапе микроскопического исследования оценивали концентрацию, подвижность и агглютинацию сперматозоидов, наличие других клеточных элементов; затем определяли морфологическую полноценность сперматозоидов. Приготовление влажного препарата. Препарат хорошо перемешивали, избегая образования пузырьков и пены. Объем наносимого на предметное стекло эякулята и размеры покровного стекла всегда были стандартными – 10 мкл и 22х22 мм соответственно. Свежеприготовленный препарат оставляли на 1 мин для стабилизации и прекращения «дрейфа».
Оценка наличия агглютинации сперматозоидов. Прикрепление подвижных сперматозоидов друг к другу (головка–головка, жгутик–жгутик, головка–жгутик) считается агглютинацией сперматозоидов. Степень агглютинации оценивали по количеству склеенных сперматозоидов: I степень – менее 10 сперматозоидов; II – 10–50; III – более 50 сперматозоидов; IV степень – склеивание всех сперматозоидов.
Подсчет количества сперматозоидов. Исследование проводили при 400-кратном увеличении. Последовательно просматривали и подсчитывали число сперматозоидов в поле зрения. При диаметре поля зрения микроскопа 500 мкм обнаружение 4 сперматозоидов в поле зрения означает концентрацию сперматозоидов 1 млн /мл. Если число сперматозоидов составляло менее 15, то разведение (эякулят:физиологический раствор) было 1:5, 15–40 – 1:10, 40–200 – 1:20 и если определялось более 200 сперматозоидов, разводили в соотношении 1:50. Все образцы, при анализе которых под микроскопом сперматозоидов обнаружено не было, подвергали центрифугированию >3000g (1500 об/мин) в течение 15 мин с последующим повторным микроскопическим исследованием.
Определение концентрации сперматозоидов. Для определения этого параметра использовали камеру Горяева, которую подготавливали по стандартной методике (покровное стекло притирали до появления «радужности» – колец Ньютона). После этого в каждую из двух камер гемоцитометра переносили по 10 мкл тщательно перемешанного разведенного в соответствующей пропорции образца эякулята. Микроскопическое исследование проводили при увеличении 400. Подсчет сперматозоидов в счетной камере гемоцитометра производили следующим образом: центральная решетка содержит 25 больших квадратов, каждый из которых разделен на 16 более мелких квадратов. При наличии менее 10 сперматозоидов на большой квадрат производили подсчет во всех 25 больших квадратах; при наличии от 10 до 40 сперматозоидов на большой квадрат – в 10 больших квадратах, а при наличии более 40 сперматозоидов – в 5 больших квадратах. Если сперматозоид находился на черте, разделяющей два соседних квадрата, его засчитывали, только когда он находился на верхней или левой стороне исследуемого квадрата. Для того чтобы ошибки подсчета были приемлемо малыми, производили 2-кратный подсчет 200 сперматозоидов. Для определения первоначальной концентрации сперматозоидов в эякуляте мы использовали следующую формулу:
С = А ∙ 100 000/ V ∙ B,
где А – общее количество подсчитанных клеток; В – количество просмотренных квадратов в 1 окошке гемоцитометра; V – объем большого квадрата (0,004 мкл).
Минимальное референсное значение для концентрации сперматозоидов – 15 106.В 1 МЛ?
Общее число сперматозоидов в эякуляте получали путем умножения концентрации сперматозоидов на объем эякулята. Минимальное референсное значение для общего числа сперматозоидов – 38 106.
Оценку подвижности сперматозоидов производили на влажном препарате сразу после разжижения, но не позднее 1 ч после эякуляции с использованием фазово-контрастной оптики или при опущенном конденсоре при объективе 40 и окуляре 10. Для измерения подвижности готовили 2 влажных препарата из двух аликвот эякулята. Подсчитывали не менее 200 сперматозоидов на каждом препарате, причем выбирали не менее 5 случайных полей зрения (не на краю препарата). Вначале подсчитывали сперматозоиды с быстрой и медленной прогрессивной подвижностью, затем – с ротационной подвижностью и колебательными движениями головки и неподвижные.
При оценке подвижности сперматозоидов применяли простую систему классификации по категориям (A, B, C, D), используя следующие параметры:
- A – быстрая прогрессивная подвижность (≥25 мкм/с, что примерно соответствует длине 5 головок сперматозоида);
- B – медленная прогрессивная подвижность (5–24 мкм/с);
- C – непоступательное движение (≤5 мкм/с, менее 1 длины головки или движение по окружности);
- D – неподвижные сперматозоиды.
Далее мы подсчитывали процентное содержание сперматозоидов каждой группы подвижности для каждого из двух препаратов. Для этого количество подсчитанных сперматозоидов в каждой группе подвижности (A, B, C, D) делили на общее количество сперматозоидов и умножали на 100.
Минимальным референсным значением прогрессивной подвижности принято считать 32%, общей подвижности – 40%.
Оценка клеточных элементов эякулята. В норме эякулят помимо сперматозоидов содержит и другие клетки, которые в совокупности обозначают термином «круглые клетки», при этом их суммарная концентрация не должна превышать 5 106/мл. К «круглым клеткам» относят лейкоциты, эритроциты, эпителиальные клетки мочеиспускательного канала, клетки предстательной железы, незрелые половые клетки (клетки сперматогенеза). Содержание лейкоцитов в эякуляте более 106/мл – лейкоспермия – расценивали как признак воспаления.
Оценка морфологии сперматозоидов. Для морфологической классификации сперматозоидов производили окраску мазка эякулята по Папаниколау. После чего при увеличении 100 производили микроскопию мазка образца эякулята, при этом последовательно просматривали поля зрения и подсчитывали 200 сперматозоидов, которые классифицировали на 2 группы: морфологически нормальные и патологические. Вначале подсчитывали «идеальные» сперматозоиды. Головка нормального сперматозоида должна быть гладкой, с четким овальным контуром, акросома занимать 40–70 % области головки, в зоне акросомы – не более 2 маленьких вакуолей. Длина головки – 3,7–4,7 мкм, ширина – 2,5–3,2 мкм.
Шейка нормального сперматозоида тонкая, ее длина равна длине головки, ось шейки должна совпадать с центральной осью головки. Цитоплазматическая капля рассматривается как аномальная, если ее размер превышает 1/3 размера головки.
Основная часть жгутика должна иметь одинаковый диаметр по всей длине (около 45 мкм – примерно в 10 раз длиннее длины головки). Минимальное референсное значение нормальных форм – 4%, в соответствии с показателем фертильности – «строгим критерием Крюгера».
Статистическая обработка результатов проведена на персональном компьютере с помощью пакетов статистических программ Мicrosoft Eхсе1 2007 и Statistiсa for Windows 6.0.
В нашем исследовании мы определяли среднюю арифметическую (х сред), отклонение от средней арифметической (х-х сред), далее производили расчет среднеквадратического отклонения (σ) и средней ошибки относительной величины (m). Для решения вопроса о случайности и не случайности расхождений наблюдаемых средних (относительных) величин производили расчет средней ошибки разности двух средних. Полученные результаты представляли как среднее±ошибка средней (M±m). Далее посредством сравнения средних значений двух выборочных совокупностей (М1 и М2) вычисляли критерий (t) Стьюдента и определяли уровень значимости (р). Статистически значимыми считали различия при р<0,05.
Поскольку исследование проводили на выборках малого размера и в большинстве случаев распределение в них не являлось нормальным, для статистического анализа нами был использован непараметрический тест χ2. Когда число наблюдений было небольшим, использовали точный критерий Фишера.
Результаты. При поступлении только у 5 (6,9%) пациентов было бессимптомное течение, остальные пациенты предъявляли разнообразные жалобы. На боль внизу живота жаловались 19 (26,4%) человек, боль в промежности – 17 (23,6%), боль в мошонке – 20 (27,8%). На ослабление струи мочи обратили внимание 19 (26,4%) мужчин, на учащенное мочеиспускание – 12 (16,7%). Несколько реже у пациентов выявлялась кровь в моче, на это обратили внимание 6 мужчин (8,3%). У 5 (6,9%) мужчин присутствовала видимая глазом кровь в сперме. Ухудшение общего состояния отметили 19 (26,4%) пациентов. Боль в суставах и мышечная боль беспокоила 25 (34,7%) человек. Повышенная потливость имела место у 22 (30%) больных. Проблемы со сном были у 23 (31,9%) мужчин. На частое ощущение усталости жаловались 24 (33,3%) человека. Раздражительность и нервозность выявлены у 23 (31,9%) пациентов, тревожность – у 9 (12,5%). Физическое истощение/ упадок жизненных сил отметили 19 (26,4%) пациентов. Снижение мышечной силы выявлено у четверти всех больных. На депрессию и ощущение, что жизненный пик пройден, указали 14 (19,4%) мужчин. Опустошенность, ощущение «дошел до ручки» беспокоили 4 (5,6%) больных. Уменьшение роста бороды заметили 4 (5,6%) человека. Снижение способности к половому акту и частоты сексуальных отношений беспокоило 23 (31,9%) пациентов. Снижение количества утренних эрекций отметили 22 (30,6%) мужчины, снижение сексуального желания/либидо – 18 (25%).
Определяя критерии МС у пациентов, мы выявили следующее: повышение уровня глюкозы отмечено у 30 (41,6%) человек, повышение уровня триглицеридов – у 15 (20,8%); снижение уровня липопротеидов высокой плотности – у 6 (8,3%), увеличение окружности талии – у 39 (54,1%), повышение АД – у 46 (63,8%).
У всех пациентов регистрировали от 2 до 5 признаков; минимальный диагностический критерий (по крайней мере 3 признака) был отмечен у 30 пациентов (41,6%). Таким образом, по совокупности трех признаков МС был выявлен у 41,6% больных ТПЖ.
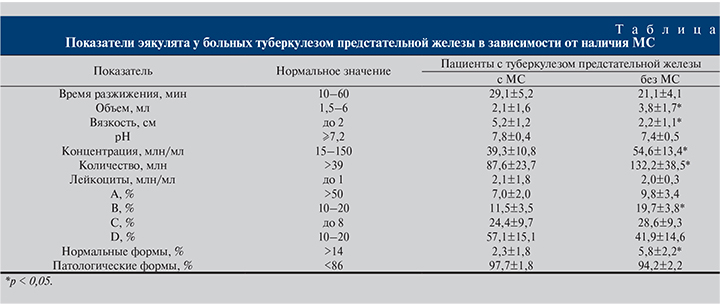
Данные, представленные в таблице, свидетельствуют о негативном влиянии МС на показатели спермограммы, в частности на объем эякулята, вязкость, концентрацию сперматозоидов, их количество, морфологию сперматозоидов. Количество сперматозоидов с нормальной формой достоверно больше было у мужчин, больных ТПЖ без метаболического синдрома.
Заключение. Таким образом, в ходе настоящего исследования установлено, что МС, имевший место у 41,6% пациента с ТПЖ, способствует снижению количества сперматозоидов в 1,5 раза, концентрации сперматозоидов – в 1,4, уменьшению количества нормальных форм сперматозоидов – в 2,5 раза. Полученные данные служат обоснованием необходимости разработки специальной терапии, направленной на восстановление фертильности эякулята у больных туберкулезом предстательной железы, с учетом развития почти у половины из них МС.



