Введение. Функциональные расстройства тазовых органов являются весьма распространенной проблемой в детском возрасте. Так, в возрасте от 5 до 7 лет нарушения акта мочеиспускания встречаются у 20% детского населения, из них у половины отмечается энкопрез. В среднем от 8 до 14% детей в возрасте 5–15 лет страдают нарушениями акта мочеиспускания и дефекации [1].
У детей наиболее часто встречающиеся нарушения акта мочеиспускания обычно представлены «гиперактивным мочевым пузырем» (ГАМП). В этот синдром укладывается 80% всех нарушений мочеиспускания в детском возрасте. При этом синдром ГАМП не только включает ургентные симптомы разной степени выраженности в различных сочетаниях, но и часто сопровождается дисфункцией тазового дна [1].
У детей с синдромом ГАМП отмечаются признаки вегетативной дисфункции в виде тахикардии, повышения уровня тревожности и др. К физиологическим причинам синдрома вегетативных дисфункций (СВД) и ГАМП относятся внутриутробная гипоксия, перинатальная энцефалопатия. СВД имеет место у 3–5% людей, включая как детей, так и взрослых. ГАМП входит в десятку самых распространенных заболеваний, и на протяжении жизни с ним сталкивается 100 млн человек в мире (взрослых и детей) [2].
Нейрогенные дисфункции мочевого пузыря (НДМП) у 37–45% детей сочетаются с дисфункцией толстой и прямой кишки, клинически проявляющейся запорами и/или энкопрезом. Недержанием кала страдает 1–2% детей в возрасте 7–10 лет. При этом недержание мочи и кала одновременно встречается в 12 раз чаще, чем только недержание кала [3–5].
 В патогенезе запоров, анатомической основой которых считаются различные варианты идиопатического мегаколона, прослеживаются схожие с НДМП механизмы. Сюда относятся нарушения нервного обеспечения со стороны парасимпатических нервов крестцовых сегментов спинного мозга, которые выявляются электромиографически. При наличии колостаза как функционального, так и органического происхождения выявляются патологические изменения сосудов на уровне маргинальных ветвей a. mesenterica inferior и микроциркуляторного русла [6, 7]. Большое значение имеет врожденный или приобретенный гипо- и аганглиоз подслизистых и межмышечных нервных сплетений, наличие которого подтверждают в ходе гистологического исследования стенки толстой кишки и гистохимического исследования уровня ацетилхолинэстеразы [8]. При этом развитие приобретенного гипо- и аганглиоза обусловлено в первую очередь нарушениями микроциркуляции, которые происходят не без участия симпатической иннервации.
В патогенезе запоров, анатомической основой которых считаются различные варианты идиопатического мегаколона, прослеживаются схожие с НДМП механизмы. Сюда относятся нарушения нервного обеспечения со стороны парасимпатических нервов крестцовых сегментов спинного мозга, которые выявляются электромиографически. При наличии колостаза как функционального, так и органического происхождения выявляются патологические изменения сосудов на уровне маргинальных ветвей a. mesenterica inferior и микроциркуляторного русла [6, 7]. Большое значение имеет врожденный или приобретенный гипо- и аганглиоз подслизистых и межмышечных нервных сплетений, наличие которого подтверждают в ходе гистологического исследования стенки толстой кишки и гистохимического исследования уровня ацетилхолинэстеразы [8]. При этом развитие приобретенного гипо- и аганглиоза обусловлено в первую очередь нарушениями микроциркуляции, которые происходят не без участия симпатической иннервации.
У детей с запорами и энкопрезом без органического поражения ЦНС в 44% наблюдений ведущая роль в формировании запоров отводится ваготонии [9].
Обследование детей с вегетативными расстройствами и сочетанными нарушениями функции тазовых органов (СНФТО) проводится разрозненно, по мере выявления причин, снижающих качество жизни всей семьи: если ребенок идет в школу, родителей беспокоит дефицит внимания, лечение будет носить преимущественно психоневрологический характер. При ведущих симптомах в виде поллакиурии или энкопреза в первую очередь последует обращение к урологу или проктологу. Между тем в этиологии и патогенезе СВД и СНФТО у детей известно достаточно большое количество факторов, указывающих на их причинно-следственные связи.
Одним из главных компонентов патогенеза ГАМП считается повышенная чувствительность детрузора к медиатору парасимпатической нервной системы ацетилхолину. Она в норме проявляется в раннем постнатальном периоде и обусловливает высокую частоту мочеиспусканий у новорожденных, которая должна постепенно уменьшаться в процессе развития ребенка с уменьшением медиаторной чувствительности [1, 10]. Большое значение в формировании императивных позывов на мочеиспускание принадлежит гипоталамо-гипофизарной дисфункции [11]. Изменение деятельности вегетативной нервной системы (ВНС) в виде гиперактивности ее сегментарных и надсегментарных структур (и во время сна, и во время бодрствования) обусловливает ургентный синдром при дисфункции мочевого пузыря по гиперактивному типу.
Таким образом, выраженность нарушений уродинамики нижних мочевыводящих путей находится в прямой зависимости от степени гиперактивности ответственных структур ВНС [12].
Однако довольно сложно представить изолированную гиперактивность симпатической нервной системы (СНС) в той части, которая регулирует работу мочевого пузыря. Вероятно, в данном случае речь идет о гиперактивности СНС в целом. Исследование ВНС – задача очень сложная в связи с постоянной изменчивостью тонуса ее отделов, обусловленной огромным числом внешних факторов и изменениями внутренней среды организма. Для оценки ВНС предложено множество способов: исследование вариабельности сердечного ритма, концентрации норадреналина в плазме, адренореактивности мембран эритроцитов и др. Самым простым методом оценки является исследование пульса. Безусловно, на частоту сердечных сокращений (ЧСС) оказывают влияние многие факторы: состояние гормонального статуса, парасимпатическая нервная система, заболевания сердечно-сосудистой системы и др., но самым главным остается активность СНС.
Целью настоящего исследования было изучить влияние СНС на резервуарную функцию мочевого пузыря и функцию тазового дна у детей с СНФТО для выработки оптимальных методов коррекции сочетанных расстройств мочеиспускания и дефекации.
Материалы и методы. При плановом диспансерном осмотре детей в детских учреждениях Петрозаводска были выявлены 165 детей (90 мальчиков, 75 девочек) 5–15 лет с жалобами на расстройства мочеиспускания и дефекации. Первичный неврологический осмотр помимо указанных расстройств определил признаки СВД. Органическое поражение ЦНС было исключено по результатам МРТ, нейрофизиологического обследования. Анамнестически у детей отмечено наличие внутриутробной гипоксии и/или дети наблюдались неврологом на первом году жизни с диагнозом «перинатальная энцефалопатия».
При клинической оценке мочеиспускания и дефекации указанных пациентов были выявлены синдром ГАМП, многофазное мочеиспускание и хронические запоры с энкопрезом, анатомической основой которых были различные варианты функционального мегаколона.
Всем детям проведено стандартное обследование (клинические анализы мочи и крови, дневник мочеиспускания и дефекации; УЗИ мочевыделительной системы с определением объема остаточной мочи, органов брюшной полости; урофлоуметрия с ЭМГ; ирригоскопия и профилометрия прямой кишки).
Обследование было дополнено регистрацией ритма спонтанных мочеиспусканий с определением ЧСС по регистрации пульса на лучевой артерии после каждого мочеиспускания в течение трех дней. Таким образом, у 165 детей с СНФТО проанализировано 10 898 мочеиспусканий с регистрацией ЧСС.
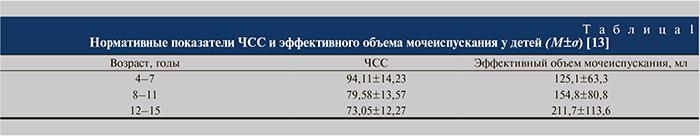
В связи с вариабельностью норм ЧСС и эффективного объема мочеиспускания для каждого возрастного диапазона дети были разделены на стандартные группы по возрастам (табл. 1) [13].
В качестве лечебных мероприятий предложена двухэтапная схема терапии. На первом этапе в течение месяца проводили курсы терапии методами биологической обратной связи (БОС) с периодическим выполнением гипертонических клизм, а также формированием ритма дефекации. Вторым этапом назначали месячный курс терапии ноотропным препаратом пикамилоном по 0,02 мг 2 раза в день детям в возрасте до 10 лет и 0,05 мг 2 раза в день – в возрасте старше 10 лет и α-адреноблокатором доксазозином от 0,5 мг детям до 10 лет, до 1 мг детям старше 10 лет однократно на ночь. После первого курса терапии провели клинический контроль состояния и выполнили урофлоуметрию – непосредственно после лечения и через месяц после него. Интервал между курсами терапии – 1 мес. После второго курса то же обследование дополнено регистрацией ритма спонтанных мочеиспусканий с определением ЧСС (выполнено 8784 пары определений объем/пульс, а всего до и после лечения исследовано 19 682 мочеиспускания с регистрацией ЧСС).
Результаты исследований подвергнуты статической обработке с помощью пакета «Анализ данных» программы Excel, представлены в виде среднего значения (М) и среднеквадратичного отклонения σ.
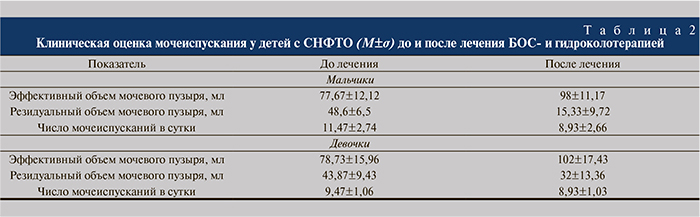
Результаты и обсуждение. Международным стандартом лечения больных нарушениями функции тазовых органов является налаживание самостоятельной дефекации и мочеиспускания приемами БОС-терапии [14]. На фоне проведения БОС-терапии и очистительных клизм у пациентов увеличился эффективный объем мочевого пузыря, незначительно уменьшилось количество остаточной мочи (табл. 2). Причем у девочек динамика увеличения эффективного объема была заметнее – от 78 до 102 мл в среднем. У мальчиков за тот же промежуток времени более выраженно изменялся объем остаточной мочи – с 48,6 до 15,33 мл, что объясняется анатомической разницей конфигурации уретрального аппарата (табл. 2).
Сопоставимой оказалась и динамика числа мочеиспусканий в сутки, причем у мальчиков эффект был заметнее: их число сократилось с 11,47 до 8,93, тогда как у девочек – с 9,47 до 8,93.
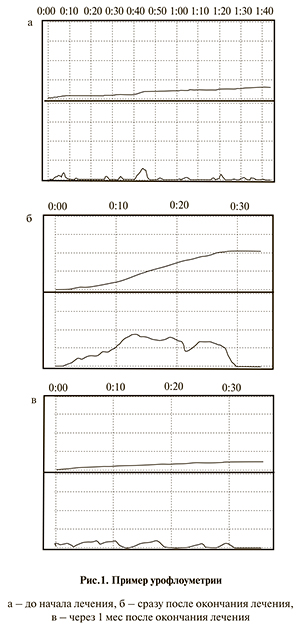
Приводим пример урофлоуграмм до начала лечения, сразу после его окончания и через месяц (рис. 1).
Эффект лечения сохранялся в пределах одного месяца. При этом сохранялись проявления СВД, постепенно увеличивалось число мочеиспусканий в сутки, усиливались запоры и вновь появлялся энкопрез. В связи с этим проведен второй этап терапии – медикаментозный, включивший ноотропный препарат пикамилон и α-адреноблокатор доксазозин. Для анализа результатов данного этапа лечения дети были разделены на стандартные возрастные группы в связи с большой вариабельностью нормативов ЧСС в разном возрасте.
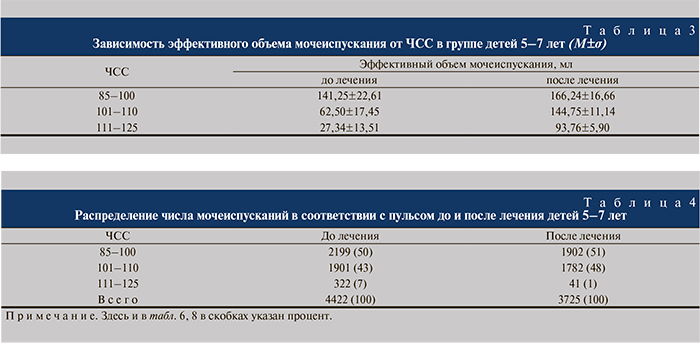
 Дети 5–7 лет. В данной возрастной группе до лечения зарегистрировано и проанализировано 4422 акта мочеиспускания. Все мочеиспускания разделены на 3 группы по показателю ЧСС после мочеиспускания: 85–100 (норма), 101–110, 111–125. Выявлена зависимость: с увеличением ЧСС снижается эффективный объем мочеиспускания. Так, если в группе мочеиспусканий с пульсом 85–100 средний эффективный объем мочеиспускания составляет 141,25±22,61 мл и не отличается от нормативных значений, то в структуре пульса 101–110 объем в 3,1 раза, а при тахикардии 111–125 – уже в 5,0 раз ниже, чем при нормальных значениях ЧСС.
Дети 5–7 лет. В данной возрастной группе до лечения зарегистрировано и проанализировано 4422 акта мочеиспускания. Все мочеиспускания разделены на 3 группы по показателю ЧСС после мочеиспускания: 85–100 (норма), 101–110, 111–125. Выявлена зависимость: с увеличением ЧСС снижается эффективный объем мочеиспускания. Так, если в группе мочеиспусканий с пульсом 85–100 средний эффективный объем мочеиспускания составляет 141,25±22,61 мл и не отличается от нормативных значений, то в структуре пульса 101–110 объем в 3,1 раза, а при тахикардии 111–125 – уже в 5,0 раз ниже, чем при нормальных значениях ЧСС.
После курса лечения в данной возрастной группе проанализировано 3725 мочеиспусканий. При увеличении эффективного объема мочевого пузыря сохранялась его зависимость от частоты пульса. В группе мочеиспусканий с пульсом 85–100 прирост эффективного объема составил 14%. При исходной тахикардии 101–110 увеличение объема пузыря произошло в 2,3, а при высокой частоте сокращений 111–125 – в 3,4 раза (табл. 3). Анализ количества мочеиспусканий в каждой группе значений ЧСС выявил сокращение числа эпизодов тахикардии с 322 до 41 (табл. 4).
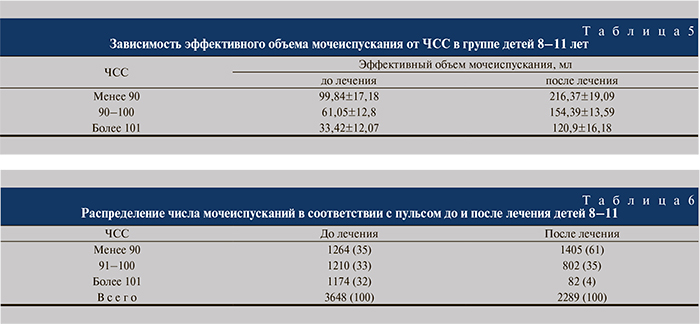
Дети 8–11 лет. В данной возрастной группе до лечения зарегистрировано и проанализировано 3648 мочеиспусканий с определением ЧСС. Все мочеиспускания разделены на 3 группы по показателю ЧСС после мочеиспускания: до 90 (норма), 90–100, 101 и более. Выявлены аналогичные с предыдущей группой зависимости (табл. 5, 6).
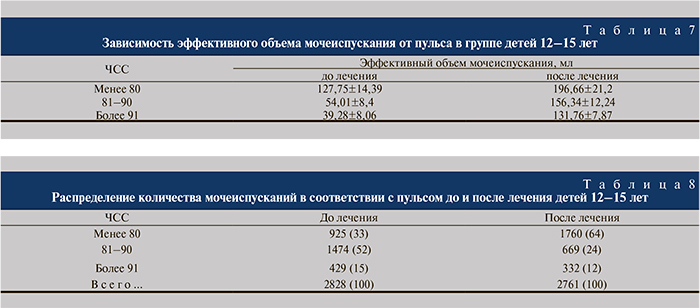
Дети 12–15 лет. В данной возрастной группе до лечения зарегистрировано и проанализировано 2828 мочеиспусканий с определением пульса. Все мочеиспускания разделены на 3 группы по показателю ЧСС после мочеиспускания: до 80, 81–90, 91 и более. Установленные зависимости были аналогичными таковым, выявленным в предыдущих группах (табл. 7, 8).
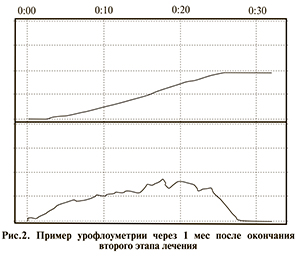
На рис. 2 представлен пример урофлоуграммы через 1 мес после окончания второго этапа лечения.
Обсуждение. В возрастной группе 5–7 лет нормальным считается пульс до 100 [6]. При этом эффективный объем мочеиспускания у детей с пульсом до 100 практически не отличается от нормы. Клиническая картина у детей данной категории характеризовалась энурезом, императивными позывами на мочеиспускание и недержанием мочи. При нарастании ЧСС (в подгруппах с пульсом 100–110, 111 и более) начинал прогрессивно снижаться эффективный объем мочеиспускания. Поскольку ЧСС является одним из основных маркеров СНС, в данном случае можно говорить о непосредственном симпатическом влиянии на детрузор. После лечения уменьшилась частота выявления тахикардии – произошло уменьшение числа мочеиспусканий с пульсом более 111 – с 322 до 41, или с 7 до 1% от общего числа.
В возрастной группе 8–11 лет эффективный объем мочеиспускания при наличии нормального пульса (до 90) не отличался от контрольных возрастных показателей, а детрузорная гиперактивность детей данной категории проявлялась так же, как в предыдущей возрастной группе. При нарастании ЧСС тоже начинал снижаться эффективный объем мочеиспускания. Таким образом, и в группе детей 8–11 лет, по результатам исследования ЧСС, можно говорить о высокой активности симпатического отдела ВНС и ее непосредственном влиянии на фазу накопления микционного цикла. В этой возрастной группе после лечения выявлены весьма значительные изменения в структуре пульс/объем. Произошло заметное уменьшение числа наблюдений эпизодов тахикардии – число мочеиспусканий, сопряженных с пульсом более 101, снизилось с 1174 до 82 (в 14 раз), или с 32 до 4% от общего числа. С уменьшением числа мочеиспусканий в сутки увеличился эффективный объем мочеиспускания.
В возрастной группе 12–15 лет эффективный объем мочеиспускания при наличии нормального пульса (до 80) также не отличался от нормы. Что касается детрузорной гиперактивности, то и в этой возрастной группе она клинически проявлялась таким же образом, как и в двух предыдущих: энурез, редкие императивные позывы на мочеиспускание, незначительная поллакиурия. При нарастании тахикардии начинал снижаться и эффективный объем мочеиспускания, что свидетельствует о высокой активности СНС, ее непосредственном влиянии на детрузор. При анализе числа мочеиспусканий в старшей возрастной группе в каждой категории значений ЧСС выраженная исходная тахикардия выявлена в относительно небольшом количестве наблюдений – 429 (15%) мочеиспусканий из 2828. После лечения этот показатель уменьшился незначительно – до 332 (из 2761) – и стал составлять 12%. Значительная динамика отмечена среди детей с умеренной исходной тахикардией (ЧСС 81–90) – частота ее выявления снизилась с 52 до 24%. С уменьшением количества мочеиспусканий в сутки увеличились эффективные объемы мочевого пузыря. Нормальный пульс с нормальными эффективными объемами стал проявляться в 64% мочеиспусканий и вырос почти в 2 раза (с 33%) по сравнению с ситуацией до начала лечения.
Разнообразие клинических вариантов расстройств мочеиспускания и дефекации во многом обусловлено сложной многоуровневой системой регуляции деятельности органов и систем – зачастую с параллельным дублированием. В составе тазового сплетения тесно связаны симпатические и парасимпатические структуры мочевого пузыря, симпатические и соматические структуры проксимальной части уретры. Наружный сфинктер уретры имеет тройную иннервацию (преимущественно соматическую), которая обеспечивает реципрокную иннервацию и координацию работы нижних мочевыводящих путей с учетом влияния внутренних и внешних факторов.
В связи с этим объяснимо, что расстройства мочеиспускания, которые проявляются прерывистым мочеиспусканием с натуживанием, низкой скоростью потока, синдромом ГАМП, встречаются в большинстве случаев среди детей без органического поражения ЦНС. Анатомическая причина, характерная для инфравезикальной обструкции, в виде стеноза, дивертикула уретры, деформации шейки мочевого пузыря в данном случае отсутствует. Снижение скорости потока мочи, многофазное мочеиспускание, часто в сочетании с запорами и/или энкопрезом происходят из-за недостаточной релаксации мышц тазового дна. Их продолжительная патологическая гиперактивность приводит к угасанию сокращений детрузора и появлению остаточной мочи.
Лечение дисфункций тазового дна в педиатрии методами БОС, относящимся к методам афферентного воздействия, является частью широко применяемой в европейской урологии уротерапии, т.е. поведенческой терапии, направленной на формирование нормального акта мочеиспускания. При внешне простой тренировке мышц происходит активация вегетативных центров иннервации, что способствует восстановлению сбалансированных взаимоотношений замыкательных механизмов тазового дна и детрузора.
Однако с помощью урофлоуметрии и ЭМГ анального сфинктера показано, что у детей с достоверным увеличением частоты спонтанных мочеиспусканий, 2–3-кратным уменьшением эффективного объема мочевого пузыря уже через 3–4 нед после курса БОС-терапии имеет место возобновление усиления активности сфинктерного аппарата. Такой результат свидетельствует о скором истощении нервно-рефлекторной передачи, по-видимому, связанном с недостаточной трофикой. Сопоставление результатов исследования уродинамики и ЧСС позволило установить нарастание тяжести дисфункции мочевого пузыря параллельно с повышением тонуса и реактивности симпатического отдела ВНС.
Таким образом, активация пузырных и запирательных рефлексов методами БОС-терапии оказывает лишь кратковременный эффект. Для стойкого положительного эффекта в виде расслабления детрузора и возобновления адекватной мышечной деятельности тазового дна требуется перманентное нейрогуморальное воздействие, которое заключается в регулирующем и координирующем влиянии нервной системы и содержащихся в крови, лимфе и тканевой жидкости биологически активных веществ. Током крови они распределяются по органам-мишеням. Под их влиянием происходит возбуждение адрено-, холино-, серотонин- и гистаминреактивных структур организма. Основной «мишенью» для симпатической нервной системы служит сосудистая система мочевого пузыря и α-адренорецепторы, расположенные в шейке и уретре. Стимуляция α-адренорецепторов вызывает сосудистый спазм, и если он сохраняется в течение продолжительного времени, нарушается релаксация всего сфинктерного аппарата тазового дна, что вызывает гипоксию нижних мочевыводящих путей с нарушением их функции.
Наличие хронической тканевой гипоксии при ГАМП доказано реографическими исследованиями пузырного кровотока и данными гистологического исследования полосок детрузора [10].
Ноотроп, оказывающий противотревожное и противогипоксическое действие, в данном случае является фоном для уроселективного α-адреноблокатора. Однако наряду с улучшением резервуарной функции мочевого пузыря купирована и тахикардия. В группах детей с умеренно повышенными показателями ЧСС эффективный объем мочеиспускания после лечения увеличился более чем в 2 раза, а ЧСС снизилась на 3–5%. В группах с исходно выраженной тахикардией отмечено увеличение эффективного объема мочеиспускания более чем в 3 раза, а снижение пульса – на 5–7%. На основании данных фактов, видимо, можно предполагать не только наличие нисходящего влияния СНС на нижние мочевыводящие пути, но и какое-то взаимное влияние – уменьшение общих проявлений симпатической гиперактивности на фоне восстановления резервуарной функции мочевого пузыря.
Выводы
- Дети с сочетанными расстройствами функции тазовых органов, имеющие в анамнезе внутриутробную гипоксию, перинатальную энцефалопатию, страдают расстройствами вегетативной нервной системы в виде СВД.
- Лечение детей с СНФТО и СВД методами афферентного воздействия оказывает кратковременный эффект из-за недостаточности гуморальной регуляции деятельности адренорецепторов, расположенных в интиме уретры и периферических сосудов.
- Одним из самых простых и надежных методов исследования нейрогуморальной регуляции считается исследование пульса, который мгновенно реагирует на его малейшие колебания. Существует причинно-следственная связь между ЧСС и эффективными объемами мочеиспускания: при увеличении объема пузыря ЧСС снижается и наоборот. Оба показателя из-за своей широкой вариабельности подлежат многократному определению.
- С целью улучшения резервуарной и эвакуаторной функции мочевого пузыря, снижения симпатической активности показано последовательное оказание афферентного и гуморального воздействия на ганглии и рецепторы мочевого пузыря, а также тазового дна.
- Одним из возможных способов повышения эффективности лечения детей с СФНТО на фоне симпатической гиперактивности является комплексное использование препаратов центрального и периферического механизма действия – уроселективных α-адреноблокаторов и ноотропных препаратов.



