Рак предстательной железы (РПЖ) является одним из наиболее распространенных онкологических заболеваний у мужчин. Во всем мире заболеваемость и смертность от данного заболевания постоянно растут. В настоящее время РПЖ занимает 2-е место среди онкологических заболеваний по смертности у лиц мужского пола [1].
Широкое использование простатспецифического антигена (ПСА) в качестве маркера РПЖ обусловило увеличение числа мужчин, подвергающихся биопсии простаты под ультразвуковым контролем, в основном из трансректального доступа [2].
Трансректальная биопсия простаты позволяет брать образцы ткани простаты из периферических отделов железы, где располагается большая часть опухолей. Методика проведения трансректальной биопсии простаты предусматривает возможность забора образцов ткани простаты из периферических отделов железы, где чаще всего локализуются опухоли. Чувствительность метода составляет 39–52%, специфичность – до 82% [3, 4]. Трансректальная биопсия связана также с минимальным повреждением тканей и как следствие – с меньшей морбидностью и небольшим количеством осложнений, поэтому выполняется в основном в амбулаторных условиях. Между тем даже при проведении расширенной трансректальной биопсии (из 12–18 точек) может быть пропущено до 40% опухолей предстательной железы [5].
При повторной биопсии простаты частота выявления РПЖ варьируется от 10 до 35% [6–9]. Подозрение на РПЖ сохраняется у пациентов с предшествующими отрицательными результатами биопсий в анамнезе при росте уровня ПСА, при наличии изменений простаты по данным пальцевого ректального исследования, реже – при наличии гипоэхогенных зон по данным трансректального УЗИ (ТРУЗИ). Вопрос, следует ли проводить повторные биопсии трансректальным доступом, остается предметом дискуссии. Предложены различные подходы к проведению биопсий этим пациентам, в том числе повторные расширенные биопсии и трансректальные сатурационные биопсии [8, 10].
В последнее время растет интерес к промежностной сатурационной биопсии простаты [11, 12]. Выполняя промежностную биопсию простаты с использованием решетки для брахитерапии, H. Li и соавт. [13] получали в среднем 23,7 кусочка ткани. Авторы пришли к следующему выводу: сатурационная промежностная биопсия простаты под контролем ТРУЗИ остается безопасной процедурой и обеспечивает высокий уровень диагностики РПЖ.
 S. Bott и соавт. [14, 15] описали технику промежностной сатурационной биопсии простаты с использованием решетки для брахитерапии. G. Novara и соавт. [16] показали, что выявляемость РПЖ сходна при различных доступах: при трансректальном подходе она составляет от 14 до 45%, при промежностном – от 23 до 42%.
S. Bott и соавт. [14, 15] описали технику промежностной сатурационной биопсии простаты с использованием решетки для брахитерапии. G. Novara и соавт. [16] показали, что выявляемость РПЖ сходна при различных доступах: при трансректальном подходе она составляет от 14 до 45%, при промежностном – от 23 до 42%.
F. Abdollah [17] также подтвердил, что нет статистической разницы в выявляемости РПЖ при различных подходах у мужчин с отрицательными биопсиями в анамнезе.
В ряде ретроспективных и проспективных исследований проведено сравнение различных подходов и сообщается о более высокой частоте обнаружения РПЖ при промежностном доступе [18, 19]. Последний обеспечивает высокую выявляемость рака простаты и является достаточно безопасной процедурой, поэтому популярен при планировании фокальной терапии и при выборе тактики активного наблюдения [20, 21]. Однако эти результаты еще не окончательные и требуют подтверждения.
В настоящее время не существует стандартизированной техники выполнения промежностной сатурационной биопсии простаты.
Целью настоящего исследования было изучение эффективности промежностной биопсии с использованием решетки для брахи/криотерапии в выявлении РПЖ среди пациентов с отрицательными трансректальными биопсиями в анамнезе, но стойким подозрением на РПЖ.
Материалы и методы. С января 2011 по март 2013 г. в клинике урологии МГМСУ выполнено 59 промежностных сатурационных биопсий под наркозом с использованием решетки для брахи/криотерапии. Почти все пациенты имели не менее двух отрицательных трансректальных биопсий в анамнезе. Из них у 45 мужчин отмечен рост уровня ПСА после предыдущих трансректальных биопсий, не подтвердивших РПЖ. У 14 человек, по данным трансректальной биопсии, в 1–2 фрагментах выявлен рост аденокарциномы; данным пациентам планировалась фокальная терапия. Ожидаемая минимальная продолжительность жизни всех пациентов составяла не менее 10 лет.
Промежностную биопсию простаты выполняли в операционной под спинномозговой анестезией в положении больного для операций на промежности. Все пациенты получали α-адреноблокатор (тамсулозин) и антибиотик за сутки до биопсии и в течение 5–7 дней после биопсии (при необходимости пациенты получали α-адреноблокатор и дольше). Выполняли пальцевое ректальное исследование с определением подозрительных на рак участков. Далее проводили обработку операционного поля как для промежностных операций.
Мочевой пузырь дренировали уретральным катетером Фолея 14–16 Ch. В прямую кишку вводили трансректальный ультразвуковой датчик BK Medical Pro-Focus 2202 8–12 МГц, фиксированный в пошаговом стабилизирующем устройстве, затем устанавливали стандартную решетку для брахи/криотерапии.
Выполняли ТРУЗИ с определением размеров и объема предстательной железы. Биопсию производили с помощью пистолетов ProMag Ultra и Bard, биопсийных игл 18G длиной 20 см с глубиной вкола 2,–2,2 см. Простата была условно разделена на 4 зоны (правая верхняя и нижняя, левая верхняя и нижняя; см. рис. 1).
Под контролем УЗИ в режиме реального времени проводили пункцию каждой зоны из 8–14 точек с таким расчетом, чтобы на каждый 1 см3 ткани простаты приходилось как минимум по одному кусочку ткани.

В отношении пациентов с большим объемом простаты (≥50 см3) приходилось использовать ручную корректировку направления вкола иглы в переднюю часть железы. Гистологический материал размещали в соответствующие контейнеры с 10%-ным забуференным формалином. После завершения биопсии осуществляли давление на область промежности пациента в течение 10–15 мин с гемостатической целью. Дренирование мочевого пузыря продолжалось в течение одних суток. Если после удаления уретрального катетера развивалась острая задержка мочеиспускания, дренирование мочевого пузыря продолжалось до утра следующего дня.
Результаты. Средний возраст пациентов, вошедших в исследование, составил 64,1 (43–77) года. Уровень ПСА на момент промежностной биопсии составил в среднем 13,6 (3,6–36) нг/мл, на момент предыдущей биопсии – 10,3 (3,6–34) нг/мл. Между трансректальной и промежностной сатурационной биопсией проходило в среднем 8,3 (2–15) мес.
У 24 (53,3%) из 45 пациентов диагностирована аденокарцинома простаты, у 3 (6,7%) выявлены комплексы атипической мелкоацинарной пролиферации (ASAP), у 1 (2,2%) пациента найдена простатическая интраэпителиальная неоплазия (ПИН) высокой степени, у 5 (11,1%) человек имел место хронический простатит в стадии обострения, у остальных 12 (26,7%) пациентов – аденома предстательной железы (АПЖ). У 12 из 14 пациентов с уже выявленным РПЖ диагноз подтвердился (рис. 2).
Среднее число (диапазон) биоптатов со злокачественными клетками составило 6,75 (1–20). У 29 из 36 (80,6%) пациентов аденокарцинома простаты была найдена более чем в одном квадранте. Из 36 пациентов у 24 (66,7%) пациентов сумма баллов по системе градации Глисона составила 6 (3+3), у 9 (25%) – 7 (3+4; 4+3), у 3 (8,3%) – 8 и более.
У 23 (63,9%) пациентов рак располагался в передней зоне простаты, из них у 9 (39,1%) аденокарцинома была диагностирована только в передней зоне простаты (25% от общего количества диагностированных случаев РПЖ).
Средний уровень ПСА у пациентов с аденокарциномой составил 16,6 нг/мл, у остальных пациентов – 9,3.
У 7 из 12 мужчин с уже выявленным РПЖ после промежностной сатурационной биопсии суммарный балл по Глисону повысился, у 9 из 12 пациентов было выявлено более обширное поражение простаты (аденокарцинома выявлена более чем в одном квадранте) по сравнению с предшествующей трансректальной биопсией.
Были зафиксированы следующие осложнения промежностной сатурационной биопсии: гематурия в течение суток – у 24 (40,7%) человек, гемоспермия – у 21 (75%) из 28 сексуально активных мужчин, острая задержка мочеиспускания, потребовавшая более длительного дренирования мочевого пузыря, – у 9 (15,3%), петехии на промежности и мошонке – у 33 (55,9%). Случаев острого простатита и уросепсиса отмечено не было.
Обсуждение. Стандартным диагностическим подходом к мужчинам с подозрением на РПЖ в настоящее время является трансректальная биопсия простаты. Использование промежностной сатурационной биопсии через решетку для брахи/криотерапии становится все более популярным. Данный метод показал превосходство в обнаружении РПЖ, особенно локализующегося в апикальной и передней частях железы [18, 22, 23].
Промежностный доступ позволяет получать образцы ткани из зон простаты, не доступных при трансректальном подходе [21].
Не существует стандартизированной техники проведения промежностной биопсии простаты: нет четких показаний к ее проведению, а также нет информации, сколько и откуда брать фрагменты ткани [13, 14, 22].
В литературе не так много исследований, посвященных сравнению промежностного и трансректального подходов к проведению биопсии простаты. Так, например, R. Hara [12] утверждает, что при первичной биопсии простаты нет существенной разницы между трансректальным и промежностным доступами в выявляемости РПЖ, числе положительных фрагментов ткани и в количестве осложнений. Однако данные исследователи использовали 12-точечную промежностную биопсию.
При использовании повторной трансректальной сатурационной биопсии простаты под УЗ-контролем частота обнаружения РПЖ составляет 13–34% [24, 25].
W. Artibani и соавт. [26] попытались выявить различия между трансректальным и промежностным подходами к мужчинам, подвергавшимся повторной сатурационной биопсии. Трансректальную биопсию перенесли 332 (70%) пациента, промежностную – 140 (30%). Авторы пришли к следующему выводу: уровень выявления РПЖ при использовании трансректального и промежностного способа сопоставим и оба метода могут быть предложены пациентам, которым предстоит повторная сатурационная биопсия.
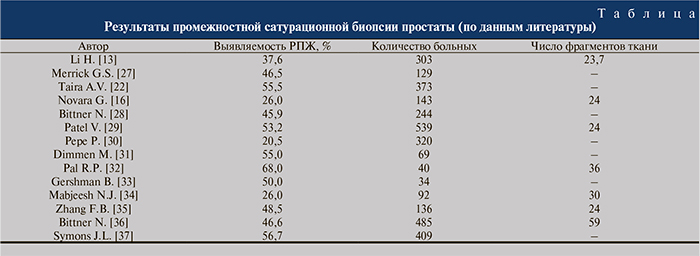
Сатурационная промежностная биопсия, по мнению многих авторов, показала превосходство при повторном исследовании, когда одна или две предыдущие расширенные трансректальные биопсии не позволили выявить РПЖ (см. таблицу).
Было также показано, что с увеличением число точек биопсии росла и частота обнаружения РПЖ. Однако оптимальное количество точек при промежностной сатурационной биопсии не определено.
T. Hossack и соавт. [38] провели ретроспективный анализ 1132 простат, удаленных при радикальной простатэктомии. Первоначальный диагноз РПЖ был поставлен на основе результатов трансректальных и промежностных биопсий простаты. Авторы показали, что эффективность обоих методов в выявлении РПЖ (по размеру опухоли и стадии заболевания) сопоставима. Однако промежностная биопсия позволяет обнаруживать большее количество опухолей меньшего размера, располагающихся в передней части простаты.
В нашем исследовании мы производили забор не менее чем из 30 точек. Это значительно больше, чем при трансректальной методике. В данной ситуации растет вероятность обнаружения клинически незначимого РПЖ. Однако по результатам гистологического исследования у значительной части пациентов с аденокарциномой простаты рак располагался более чем в 3 столбиках ткани и более чем в одном квадранте простаты, что может говорить об объеме опухолевого очага более 0,5 см3.
Несмотря на то что промежностная сатурационная биопсия позволяет выявлять РПЖ чаще, многие авторы не рекомендуют ее как первоначальную процедуру, так как она требует проведения анестезии [11, 22].
Требует уточнения продолжительность периода между трансректальной и промежностной биопсией. Для некоторых пациентов она составила больше года. Возможно, за это время РПЖ прогрессировал, а это может объяснить, почему РПЖ не был выявлен при трансректальной биопсии.
Заключение. Промежностная сатурационная биопсия характеризуется высокой выявляемостью РПЖ среди пациентов с сохраняющимся подозрением на рак после отрицательных трансректальных биопсий, не связана с увеличением диагностики клинически незначимого рака и частоты осложнений, однако требует больших временных и финансовых затрат. Такие вопросы, как техника проведения биопсии, количество точек, время, через которое необходимо выполнять промежностную биопсию, требуют дальнейшего изучения и стандартизации.



