Введение. Современные представления об эрекции, имеющей гемодинамическую основу и представляющей собой результат сложного взаимодей-ствия центральной и вегетативной нервных систем, подтверждены рядом отечественных и зарубежных ученых [1, 2]. Поскольку связь между фазой быстрого сна (ФБС) и ночными спонтанными эпизодами эрекции в настоящее время несомненна, исследование эректильной функции (ЭФ) вне связи с картиной сна является неполной, и вероятность упущения начальных проявлений эректильной дисфункции достаточно высока. Известно, что все исследования ЭФ проходят при определенных стимулирующих посылах. При ночном сне показано усиление активности парасимпатической нервной системы на фоне снижения тонуса симпатической нервной системы. Происходящие во время сна трофотропные сдвиги способствуют восстановлению затраченных энергетических ресурсов в различных физиологических системах [3]. Возможность объективного исследования ночных пенильных эпизодов эрекции (night penile tuminiscents — NPT) при проведении полисомнографии (ПСГ) позволяет выявлять начальные проявления эректильной дисфункции (ЭД) и предотвращать ее ложноположительные или ложноотрицательные результаты. Исследования NPT одновременно с ПСГ позволяют провести дифференциальный диагноз между органическими и психогенными причинами ЭД. В последние годы ЭД считается одной из широко обсуждаемых проблем медицины, которая вышла за рамки урологии. Ее называют междисциплинарной проблемой, барометром мужского здоровья и «айсбергом» системных сосудистых патологических изменений [4].
Нарушением ЭФ разной степени выраженности страдает более 150 млн мужчин в мире, и данное состояние может встречаться при различных патологических состояниях [5–7], в том числе и при синдроме обструктивного апноэ сна (СОАС) [8–13]. В литературе представлено не так много работ по исследованию ЭФ при СОАС, в которых мониторинг NPT происходит одномоментно с ПСГ [14], однако они представляются неполными. Целью настоящей работы стало исследование ЭФ во время ночного сна у мужчин с СОАС с учетом временных точек NPT.
Материалы и методы. В исследовании принял участие 51 мужчина в возрасте 46–55 лет, не предъявляющий жалоб на нарушение ЭФ. На этапе клинико-анамнестического обследования было проведено анкетирование пациентов с помощью специализированных опросников – скрининг-анкеты нарушений дыхания во время сна и расширенного Стэнфордского опросника сна. На втором этапе исследования после ночи адаптации в специально оснащенной лаборатории сна, условия в которой максимально приближены к домашним, всем обследуемым было проведено ПСГ-исследование с использованием системы GRASS-TELEFACTOR Twin PSG (Comet) с усилителем As 40 с интегрированным модулем для сна SPM-1 (США) и опцией для мониторинга NPT во время 7-часового ночного сна.

Расширенное ПСГ-исследование включало запись электроэнцефалограммы в 4 стандартных отведениях с наложением референтных электродов на сосцевидные отростки (О1/А2, О2/А1, С3/А2, С4/А1); движения глазных яблок правого и левого глаз (электроокулограмма); электромиограммы с подбородочных и передних большеберцовых мышц; электрокардиограммы в одном стандартном отведении. Одновременно производили регистрацию ороназального воздушного потока дыхания с помощью термопары, генерирующей электрический сигнал в ответ на колебания температуры воздуха при дыхании; грудного и брюшного дыхательных усилий посредством пъезокристаллических датчиков, генерирующих электрический сигнал в ответ на растяжение эластичного фиксирующего пояса; определение степени насыщения крови кислородом (пульсоксиметрию) посредством наложения специального датчика на указательный палец исследуемого, мониторинг ночных эпизодов эрекции. Также накладывали датчики для регистрации эпизодов храпа и положения тела пациента во время сна. Исследование ночных эпизодов эрекции осуществлялось путем наложения растяжимых латексных датчиков в виде кольца, наполненного ртутью. Через ртуть пропускается небольшой электрический ток, и изменение сопротивления преобразуется в электрическое напряжение с помощью мостового усилителя. В ограниченном интервале измерений увеличение в объеме приводит к удлинению и утончению измерителя, таким образом изменение сопротивления в линейном отношении отражает увеличение окружности.
В течение всей ночи исследования пациент находился под видеонаблюдением, осуществляемым посредством специальной инфракрасной видеокамеры.
Наложение электродов и датчиков, монтаж и физиологическую калибровку, устранение возможных артефактов, определение и оценку стадий сна проводили в соответствии с международными рекомендациями и критериями американских экспертов [15]. Результат анализа ПСГ представлял собой графические изображения в виде гипнограммы — графики динамики стадий сна на протяжении всего времени регистрации – иными словами, дискретной реализации всех стадий сна, по которому можно было судить об архитектуре сна.
По результатам ПСГ пациенты были разделены на две группы. Основную составили 37 человек с СОАС (средний возраст – 53,16±3,45 года, индекс массы тела – 33,19±5,76 кг/м2). Длительность СОАС у них составила 10,5±1,5 года. Контрольную группу составили 14 мужчин (средний возраст – 50,38±2,63 года, индекс массы тела – 34,27±3,48 кг/м2), не страдающих нарушениями дыхания во время сна.
При проведении исследования соблюдались этические принципы, предъявляемые Хельсинкской декларацией Всемирной медицинской ассоциации. Получение информированного согласия на участие в проводимом исследовании стало обязательной процедурой при включении мужчин в одну из групп.
Для анализа полученных данных использовали статистический пакет STATISTICA 6.1 Stat-Soft Inc., США (правообладатель лицензии – ФГБУ «НЦ проблем здоровья семьи и репродукции человека» СО РАМН). При анализе межгрупповых различий для независимых выборок использовали параметрический критерий Стьюдента. Критический уровень значимости принимался равным 5 % (0,05).
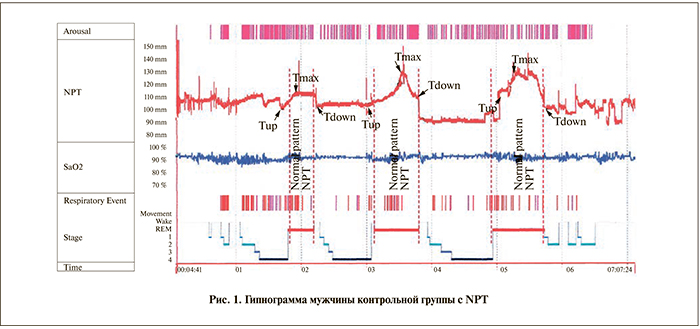
Результаты. Для характеристики эпизода NPT были использованы 3 временные точки, или периоды, составившие эпизод NPT:
- Tup (начало эрекции). Обозначает период между Tup и Tmax, в котором произошло увеличение полового члена на 2 мм выше базисной линии;
- Tmax (максимальное увеличение). Первая точка после Tup, когда окружность полового члена достигает 75% от максимального увеличения его окружности за весь период ночи. Период между Tmax и Tdown;
- Tdown (спадение). Обозначает период между Tmax и Tdown, в котором начинается спадение полового члена, когда его окружность становится ниже уровня точки Tmax;
- TTT – общее время эпизодов эрекции (total tumescence time);
- Т/R – отношение общего времени эпизодов эрекции к длительности всех эпизодов ФБС;
- Tm/R – отношение Tmax к длительности эпизодов ФБС.
Анализ результатов полисомнографического мониторирования выявил выраженные изменения и нарушения структуры сна в основной группе пациентов (табл. 1).

Общая эффективность сна, оцениваемая как отношение общего времени сна к общему времени записи, в исследуемых группах не различалась. Однако у пациентов с СОАС отмечена грубая фрагментация сна, выраженная статистически значимым преобладанием ПС (р<0,05), дефицитом глубоких стадий сна (уменьшение на 30% по сравнению с контролем), статистически значимым недостатком (длительности) ФБС. Кроме того, была резко нарушена цикличность сна, генерируемая избыточным количеством реакций ЭЭГ-активаций (в 3 раза по сравнению с контролем), вследствие чего регистрировали частые пробуждения в течение ночи, появление специфического феномена дизрегуляции сна — «альфа–дельта—сон». Количество эпизодов апноэ/гипопноэ у пациентов с СОАС в 14,5 раз превышало контрольные значения.
В результате спадения стенок дыхательных путей прекращалось поступление воздуха, происходило падение насыщения крови кислородом и увеличение содержания в ней углекислого газа. По данным пульсоксиметрии, проведенной одновременно с ПСГ, наблюдалось статистически значимое снижение сатурации до 78,67±8,2, т.е. десатурация составила 20% от контрольных значений и от исходного уровня сатурации при бодрствовании. В результате перераздражения хеморецепторов, рецепторов верхних дыхательных путей происходила активация мозговых структур, возникали реакции ЭЭГ-активации, не всегда сопровождаемые поведенческим пробуждением.
Данные табл. 2 подтверждают факт измененного паттерна ночных спонтанных эрекций у мужчин с СОАС. У пациентов основной группы имело место увеличение временного интервала периода Тup относительно показателя контрольной группы в 2,2 раза (р<0,05), т.е. отмечалось замедленное, как бы отсроченное по времени относительно ФБС начало эректильного эпизода. Показатель Тmax и период Тdown были значимо снижены относительно контроля – в 1,8 и 1,5 раза соответственно (р<0,05 для обоих показателей). Следует отметить близкую к контролю общую длительность всех эпизодов NPT (ТТТ), хотя у пациентов основной группы количество NPT было значимо ниже контрольных значений — в 1,68 раза (р<0,05).
При анализе показателей NPT относительно эквивалента ФБС обращали на себя внимание уменьшение отношения Тmax/R (в 2,38 раза (р<0,05) и увеличение отношения Тup/R (в 2,09 раза (р<0,05). По этим отношениям можно судить о неадекватном (относительно временных границ ФБС) начале и максимальном временном эпизоде NPT. На рис. 1, 2 представлены типичные гипнограммы мужчины с NPT и пациента с СОАС и ЭД с указанием временных точек эпизодов NPT.
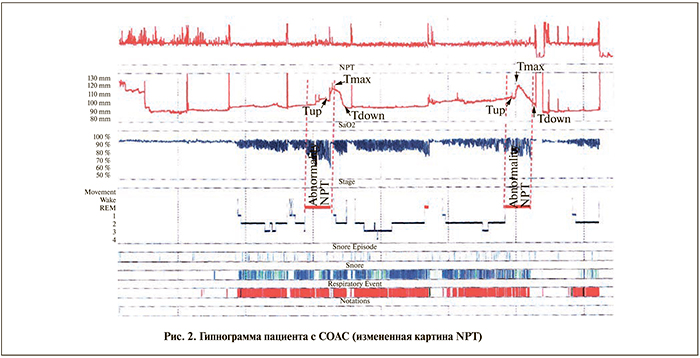
Обсуждение. Проведенные ранее исследования показали, что у здоровых мужчин в ФБС отмечается 4–6 эпизодов физиологических эрекций длительностью по 10–15 мин, а общая их продолжительность в течение ночи составляет 20% от всего времени сна [16]. А.А. Белкиным и соавт. [14] показано, что у пациентов с СОАС наравне с грубой фрагментацией и нарушением структуры сна имеет место недостаточное количество NPT, качество которых не соответствует удовлетворительной ригидности полового члена. Результаты нашего исследования согласуются с данными ранее проведенных научных изысканий, однако в соответствии с поставленной целью мы сформировали более полное представление о качестве эпизодов NPT с указанием трех временных точек — начало эрекции, максимальное увеличение полового члена и период детумесценции. Нами установлено, что у пациентов с СОАС наряду со снижением количества эпизодов NPT отмечается замедленное начало и удлинение периода детумесценции эректильного эпизода относительно ФБС, что указывает на начало развития ЭД (доклиническая стадия). Известно, что в развитии эрекций играет роль преобладающее влияние парасимпатической нервной системы, однако периодические остановки дыхания при СОАС вызывают активацию симпатической нервной системы с последующей вазоконстрикцией сосудов [17]. Возможно, этим объясняется выявленные нами изменения в качестве эпизодов NPT у мужчин с СОАС.
Определенную роль в развитии ЭД играет изменение секреции мужского полового гормона – тестостерона, выработка которого носит циркадный характер и пики его секреции отмечаются во время фазы медленного сна [18]. Выявленный нами дефицит глубоких стадий сна (уменьшение на 30% по сравнению с контролем) ведет к недостаточной продукции тестостерона (уменьшение на 20% по сравнению с контролем), что проявляется изменением качества в первую очередь ночных спонтанных эректильных эпизодов, а по мере прогрессирования СОАС – клинически выраженной ЭД.
Важным звеном в патогенетической связи СОАС и ЭД служит абдоминальное ожирение и, соответственно, нарушения липидного обмена [19]. В литературе СОАС рассматривается как один из важнейших факторов риска атеросклероза, что обусловлено периодической хронической гипоксией в течение ночи, продолжительной симпатической активностью, колебаниями внутригрудного давления, циклами гипоксемии/реоксигенации, окислительным стрессом, что в конечном итоге вызывает эндотелиальную дисфункцию и повреждение сосудистой стенки [20–22]. Вместе с тем развитие атеросклероза имеет непосредственную связь с концентрацией тестостерона в крови, и андрогенный дефицит, выявленный у мужчин с СОАС, способствует развитию данного патологического состояния и ЭД.
Таким образом, периодические остановки дыхания во сне приводят к нарушению сегментарной организации структуры сна мужчин с уменьшением эпизодов ФБС и снижением представленности медленно-волнового сна, а также чрезмерной активацией мозговых структур в ответ на гипоксию, что в конечном итоге обусловливает андрогенный дефицит и ЭД.
В заключение следует сказать, что возможности современной медицины сна открывают новую страницу в изучении ЭД, объединяющей врачей различных специальностей: урологов, андрологов, эндокринологов, терапевтов, неврологов и сомнологов (специалистов по медицине сна). Использование новейшего оборудования позволяет более полно раскрывать механизмы формирования ЭД, диагностировать ее на начальной (доклинической) стадии и начинать своевременную патогенетически обоснованную немедикаментозную терапию пациентов с СОАС, направленную на устранение эпизодов апноэ во сне, а следовательно, циклов гипоксемии/реоксигенации и чрезмерной симпатической активации как важных пусковых факторов развития ЭД, что позволит значительно улучшить качество жизни мужчин трудоспособного возраста.



