Введение. В связи с повсеместным использованием скрининга на уровень простатспецифического антигена и ежегодным ростом числа больных раком предстательной железы (РПЖ) увеличилось количество осложнений, связанных с лечением данного заболевания. Стриктуры везикоуретрального анастомоза (ВУА) входят в тройку наиболее часто встречающихся поздних послеоперационных осложнений радикального лечения РПЖ [1]. Стриктуры ВУА и уретры, облитерация шейки мочевого пузыря резко снижают качество жизни пациента и способны приводить к развитию жизнеугрожающих состояний. По данным различных авторов, частота развития стриктуры после радикальной простатэктомии (РПЭ) варьируется от 0,4 до 32,0%, после аблации высокоинтенсивным фокусированным ультразвуком (HIFU) — от 1 до 31%, после дистанционной лучевой терапии (ДЛТ) и брахитерапии превышает 12%, после трансуретральной резекции предстательной железы (ТУРП) составляет 2,2–9,8% [2–4]. Считается, что истинная частота встречаемости стриктур выше приводимых данных статистики в связи с «маскированием заболевания» и гиподиагностикой [5] .
 Наличие стриктуры ВУА и уретры вызывает инфравезикальную обструкцию различной степени тяжести, приводит к увеличению объема остаточной мочи, может стать причиной острой задержки мочеиспускания или так называемого недержания при переполнении (парадоксальной ишурии). Нарушение эвакуаторной функции мочевого пузыря способствует развитию восходящей инфекции, а также гидронефротической трансформации почек. Несмотря на то что диагностика стриктур ВУА и уретры не вызывает затруднений, доля пациентов, длительно наблюдавшихся по поводу инконтиненции после лечения РПЖ в различных медицинских учреждениях, у которых при обследовании обнаруживалась обструкция нижних мочевыводящих путей, связанная с рубцовыми изменениями, достаточно высока.
Наличие стриктуры ВУА и уретры вызывает инфравезикальную обструкцию различной степени тяжести, приводит к увеличению объема остаточной мочи, может стать причиной острой задержки мочеиспускания или так называемого недержания при переполнении (парадоксальной ишурии). Нарушение эвакуаторной функции мочевого пузыря способствует развитию восходящей инфекции, а также гидронефротической трансформации почек. Несмотря на то что диагностика стриктур ВУА и уретры не вызывает затруднений, доля пациентов, длительно наблюдавшихся по поводу инконтиненции после лечения РПЖ в различных медицинских учреждениях, у которых при обследовании обнаруживалась обструкция нижних мочевыводящих путей, связанная с рубцовыми изменениями, достаточно высока.
На сегодняшний день нет единого стандарта лечения данного осложнения. Одни исследователи считают, что предпочтительны эндоскопические методики ввиду того, что «большинство из них отличается относительной простотой в исполнении, малотравматичностью, небольшим количеством осложнений» [6]. По мнению других специалистов, «первой линией лечения» являются реконструктивно-пластические операции [7]. Тем не менее как реконструктивно-пластические операции, так и классические эндоскопические вмешательства (инцизия холодным ножом, баллонная дилатация и т.д.) не всегда обусловливают удовлетворительные результаты. Во время операции высоки риски возникновения кровотечения, нарушения целостности уретры, перфорации мочевого пузыря, после операции возможно развитие септических состояний; высока вероятность рецидива стриктуры, особенно у пациентов, уже подвергавшихся эндоскопическим или реконструктивным операциям [8].
Достижения в области лазерной хирургии и эндоурологии способствовали разработке альтернативного метода лечения стриктур ВУА, уретры и облитерации шейки мочевого пузыря — эндоскопической лазерной уретротомии. Основные преимущества метода: минимальные интраоперационные травма и кровопотеря. Метод применим при протяженных и множественных стриктурах, а также при облитерации шейки мочевого пузыря [8].
Целью исследования явилась апробация оптической уретротомии с применением гольмиевого лазера на алюминиево-иттриевом гранате (Ho:YAG) для лечения стриктур ВУА и уретры.
Материалы и методы. С 2012 г. в урологическом отделении РНЦРХТ осваивается методика оптической лазерной уретротомии с применением гольмиевого лазера Dornier® Medilas H20 на алюминиево-иттриевом гранате (Ho:YAG). Выполнено 12 лазерных эндоскопических уретротомий. Возраст пациентов варьировался от 55 до 79 лет и в среднем составил 72,3±2,06 года. Обследование пациентов включало сбор анамнеза заболевания, объективное обследование, урофлоуметрию, УЗИ мочевого пузыря с определением объема остаточной мочи, микционную уретроцистографию, уретроцистоскопию, общий и микробиологический анализ мочи с антибиотикограммой. Максимальная длина сужения, по данным уретрографии, составила 4,5 см. Распределение больных с учетом этиологии, локализации и протяженности стриктуры представлено в табл. 1.
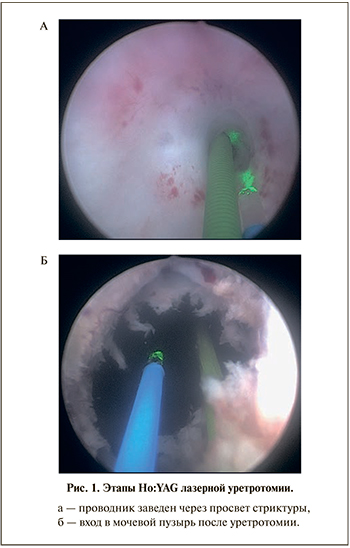
Все оперативные вмешательства осуществляли под эпидуральной анестезией в литотомическом положении пациента. Операцию начинали с визуального осмотра уретры до участка рубцового сужения с помощью цистоскопа Storz® 22 Fr c двумя инструментальными каналами, подключенного к ирригационной системе. В отсутствие тотальной облитерации уретры через суженный просвет по инструментальному каналу цистоскопа в мочевой пузырь заводили универсальный проводник, использованный впоследствии в качестве ориентира для корректного проведения цистоскопа (рис. 1а). По второму инструментальному каналу к участку сужения подводили оптическое волокно с оголенным дистальным концом «bare fiber» и осуществляли уретротомию. Деструкцию рубцовых тканей производили оптическим волокном 400 мкм контактно на 5, 7 и 12 ч условного циферблата в режиме максимальной мощности аппарата 20 Вт. После деструкции рубца цистоскоп проводили далее по уретре. После достижения полости мочевого пузыря на антеградном ходе цистоскопа всю рубцовую ткань подвергали вапоризации до границ с неизмененными тканями (рис. 1б). При наличии полной облитерации шейки пузыря пациентам с эпицистостомой цистоскоп заводили через надлобковый свищ и выполняли ретроградную лазерную реканализацию с последующим заведением в канал универсального проводника и продолжением оперативного вмешательства по вышеописанной технике.

После завершения операции устанавливали силиконовый катетер Фолея 22 Fr (RUSH Teleflex Medical®). Для адекватного дренирования полости мочевого пузыря 3 пациентам, имеющим помимо стриктуры уретры конкремент мочевого пузыря, впоследствии подвергнутый лазерной литотрипсии, был установлен уретральный катетер 24 Fr. Уретральный катетер устанавливался на срок, достаточный для заживления раневой поверхности, – от 10 до 21 дня в связи с тем, что уменьшение сроков шинирования уретры приводит к статистически значимому возрастанию риска повторного стриктурообразования, а более длительные сроки не оказывают статистически значимого влияния на результаты эндоскопического лечения [9]. Более длительные сроки применялись при протяженных стриктурах более 2,5 см. В послеоперационном периоде все пациенты получали антибактериальную терапию с учетом антибиотикограммы по данным бактериологического анализа мочи и стандартную консервативную послеоперационную терапию. Для профилактики рецидива стриктуры выполняли парауретральные инъекции противофибротических и глюкокортикоидных препаратов (лидаза, преднизолон), при этом установленный уретральный катетер использован для корректного выполнения процедуры; назначали пероральный прием энзимов (флогэнзим).
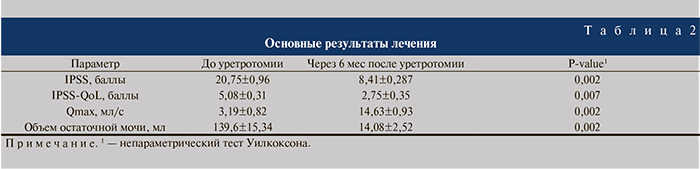
 Эффективность лечения оценивали через 6 мес после операции по изменению субъективных симптомов заболевания в баллах опросника IPSS, объему остаточной мочи, данных повторной уретрографии, значению Qmax урофлоуметрии. Влияние заболевания на качество жизни оценивали по шкале IPSS-QoL. Статистическую обработку полученных данных проводили с использованием программного пакета Statistica 6.1. Для оценки значимости статистических различий применялся непараметрический критерий Вилкоксона для зависимых выборок.
Эффективность лечения оценивали через 6 мес после операции по изменению субъективных симптомов заболевания в баллах опросника IPSS, объему остаточной мочи, данных повторной уретрографии, значению Qmax урофлоуметрии. Влияние заболевания на качество жизни оценивали по шкале IPSS-QoL. Статистическую обработку полученных данных проводили с использованием программного пакета Statistica 6.1. Для оценки значимости статистических различий применялся непараметрический критерий Вилкоксона для зависимых выборок.
Результаты. Время оперативного вмешательства колебалось от 45 до 120 мин и в среднем составило 78,8±8,55 мин, причем непосредственно уретротомия занимала не более 25% времени оперативного вмешательства, основное же время было затрачено на лазерную вапоризацию рубцовых тканей. После удаления уретрального катетера на 10–21-е сутки у всех пациентов восстановилось самостоятельное мочеиспускание. После удаления катетера пациентам, имеющим до начала лечения надлобковый свищ, эпицистостомический дренаж пережимали и оставляли на случай острой задержки мочеиспускания. В связи с отсутствием вышеописанного осложнения на 6-е сутки эпицистостомический катетер у всех пациентов был удален, проводилось консервативное закрытие надлобкового свища. Основные результаты лечения приведены в табл. 2.
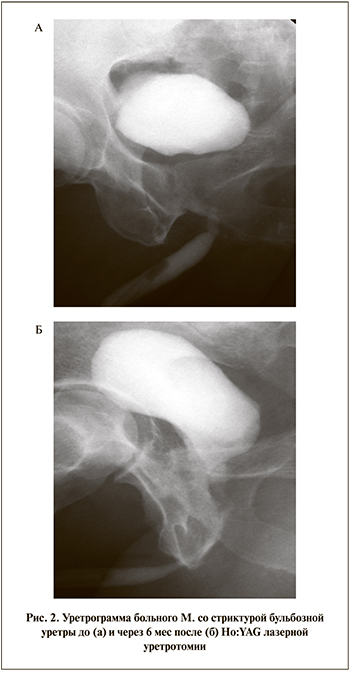
Оценка эффективности лечения пациентов со стриктурами ВУА, уретры, облитерацией шейки мочевого пузыря с использованием Ho:YAG-лазера показала восстановление проходимости уретры по данным уретрографии (рис. 2), значимое (на 59,5%) снижение баллов по шкале IРSS через 6 мес после лечения, улучшение качества жизни – снижение количества баллов IPSS-QoL на 45,87%, снижение объема остаточной мочи на 89,92%, увеличение Qmax на 78,19%.
Интраоперационных и ранних послеоперационных осложнений ни у одного из пациентов зарегистрировано не было. В течение 2 мес после операции 2 (16,6%) пациентам, оперированным по поводу стриктуры ВУА, в связи с ухудшением мочеиспускания и развитием рецидива стриктуры выполнено повторное оперативное вмешательство. После удаления уретрального катетера у 5 (41,6%) пациентов диагностирована стрессовая инконтиненция, в связи с чем в течение 4–12 нед проводилась консервативная терапия, направленная на укрепление мышц тазового дна (заявка на патент «Способ лечения недержания мочи после радикальной простатэктомии» № 2013133338/14 от 17.07.2013), которая позволила снизить количество теряемой мочи менее 60 г (1 прокладка) в сутки по данным дневника мочеиспускания 3 пациентам и достигнуть полного удержания мочи 2 пациентам через 3 месяца наблюдения.
Обсуждение. Стриктуры ВУА, уретры, облитерация шейки мочевого пузыря входят в первую тройку наиболее часто встречаемых осложнений лечения РПЖ наравне с эректильной дисфункцией и недержанием мочи. Формирование стриктуры манифестирует различными симптомами нарушения функции нижних мочевыводящих путей, в том числе и недержанием мочи, а порой приводит к развитию острой задержки мочеиспускания. Разнообразие симптомов способствует гиподиагностике данного заболевания. Причины возникновения стриктур зависят от выбранного метода лечения РПЖ. Так, стриктуры ВУА обычно являются следствием кругового рубцового сужения в области созданной шейки мочевого пузыря после РПЭ [10]. Радиоиндуцированные стриктуры после дистанционной лучевой терапии являются следствием нарушения тканевой микроциркуляции с развитием ишемии и фиброза уретры [11]. Риск стриктурообразования увеличивается при комбинации ТУР с последующей лучевой терапией за счет радиопотенцирования образования протеогликанов фибробластами после отторжения электрокоагулированных тканей предстательной железы [12]. Для профилактики рецидивов стриктуры мы применяли парауретральные инъекции глюкокортикоидных препаратов, так как они способны снижать количество коллагеновых волокон и фибробластов, а также подавлять пролиферацию фибробластов в зонах поврежденного уротелия [13].
Помимо снижения качества жизни пациента за счет обструктивной симптоматики самого заболевания лечение стриктур связано с целым спектром осложнений [14]. Несмотря на радикальность реконструктивно-пластических операций, их выполнение сопряжено с риском развития кровотечения, высокой вероятностью присоединения гнойно-септических инфекций. Эндоскопическая уретротомия Sachse, долгое время считавшаяся «золотым» стандартом лечения стриктур, сопряжена с высоким (более 75%) риском возникновения рецидива заболевания, а использование техник, сочетающих уретротомию и трансуретральную резекцию рубцовых тканей, приводит к повторному стриктурообразованию у трети пациентов [15]. В связи с болезненностью и травматичностью процедуры многие пациенты отказываются от самокатетеризации; бужирование уретры травматично и может приводить к формированию ложных ходов; баллонная дилатация применима только при относительно коротких (до 1,5 см) стриктурах [16]. Первые попытки лазерной уретротомии были выполнены в 1990 г. с использованием неодимового лазера на алюминиево-иттриевом гранате (Nd:YAG) [17]. Основными преимуществами этого метода были безопасность, небольшая кровопотеря и сокращение койко-дня, однако частота рецидива стриктур достигала 50% и была связана с повреждением глубжележащих тканей лазерной энергией [18]. В отличие от неодимового Ho:YAG- лазер имеет длину волны 2100 нм, которая сильно поглощается водой. Глубина проникновения в ткани гольмиевого лазерного излучения не превышает 0,5 мм, что позволяет выполнять рассечение и вапоризацию рубца без термического повреждения нормальных тканей уретры [19].
Заключение. Ho:YAG-лазер является минимально инвазивным и безопасным инструментом лечения стриктур ВУА, уретры и облитерации шейки мочевого пузыря, возникших после лечения РПЖ. Несомненным преимуществом Ho:YAG-лазера является деструкция рубцовых тканей с одновременным выраженным гемостатическим эффектом и отсутствием влияния на окружающие ткани, что предотвращает последующее грубое рубцевание уретры. Делать окончательные выводы об эффективности данной малоинвазивной методики можно будет только по мере накопления опыта, с учетом отдаленных результатов и данных сравнительных исследований.


