Введение. Эпидемиологические данные последних 30 лет свидетельствуют о значительном росте заболеваемости мочекаменной болезнью (МКБ) в общей популяции. Помимо увеличения частоты встречаемости уролитиаз прогрессивно «молодеет» и становится одним из распространенных хронических заболеваний [1, 2].
Многочисленные исследования теорий камнеобразования показали, что риск уролитиаза увеличивается при первичном анатомо-функциональном поражении почки(ек) и инфекции мочевых путей, на фоне которых различные экзо- и эндогенные факторы, сопровождающиеся метаболическими нарушениями, приводят к формированию мочевых камней [3–7]. Многочисленными исследованиями доказана связь метаболического синдрома (МС) с уролитиазом [8, 9]. Некоторые авторы предлагают считать МКБ еще одним компонентом МС [11]. Выявлено, что риск спонтанного образования камней в два раза выше у пациентов при наличии МС [9]. В исследованиях на животных показано, что на уровень кальциурии и фосфатурии может влиять длительная диета, обогащенная жирами животного происхождения [10].
Цель исследования: изучить взаимосвязи между гормонально-метаболическими показателями и различными формами МКБ.
Материалы и методы. В исследование включены 82 пациента (48 женщин, 34 мужчины) в возрасте 52,6 (27–80) года с МКБ, ранее не подвергавшихся оперативному вмешательству. Пациенты находились на стационарном лечении в клинике урологии НИИ уронефрологии и репродуктивного здоровья человека.
Для всех пациентов диагноз МКБ был подтвержден данными УЗИ и/или компьютерной томографии (КТ) почек и мочевыводящих путей. По УЗИ и КТ почек оценен размер и плотность камня.
У 93,7% пациентов камни локализовались в почках, у 6,3% – в мочеточниках. Односторонняя локализация камней встречалась гораздо чаще дву- сторонней – 81 против 19%. Анализ клинических форм МКБ показал, что преобладали первичные (n=58; 70,7%) над рецидивными (n=24; 29,3%); простые (n=59; 72%) над коралловидными (n=23; 28%). До оперативного лечения у всех пациентов были исследованы основные лабораторные показатели фосфорно-кальциевого, углеводного, липидного и пуринового обменов (табл. 1).
Критерии включения: пациенты обоего пола с МКБ в возрасте от 20 до 80 лет.
Критерии исключения: пациенты с онкологиче- скими заболеваниями, с единственной почкой.
Статистическую обработку результатов провели с использованием пакета прикладных программ Statistica (StatSoft Inc. США, версия 6.0). Качественные признаки описали в виде долей и абсолютных значений. Для количественных признаков вычислили медиану, крайние квартили [25, 75]. Последние в данной публикации опущены с целью упростить восприятие статистической обработки. Сравнение количественных признаков проведено с помощью критерия Манна–Уитни. Для изучения взаимосвязи количественных признаков применен непараметрический метод Спирмена. Статистически значимыми считали значения критериев и коэффициентов при р<0,05.
 Результаты и обсуждение. Длительность заболевания МКБ в среднем составила 8,32 года, в группе пациентов с первичными камнями – 7,4; рецидивными – 15,9 года (табл. 2).
Результаты и обсуждение. Длительность заболевания МКБ в среднем составила 8,32 года, в группе пациентов с первичными камнями – 7,4; рецидивными – 15,9 года (табл. 2).
По данным анализа основных лабораторных показателей углеводного, липидного, фосфорно-кальциевого и пуринового обменов установлено, что у пациентов с МКБ всего имели место нарушения фосфорно-кальциевого обмена. Выявлено также, что при сочетании двух и более видов гормонально-метаболических нарушений увеличилась встречаемость рецидивных камней (табл. 3). По данным КТ почек средний размер камней составил 19,45 (3,6–57,8) мм, плотность – 898,9 (398–1540) HU. При оценке связей между размером камня и биохимическими параметрами выявлена достоверная отрицательная корреляция с уровнем Са (rs=-0,674, р=0,0023), положительная – с уровнем ОХ (rs=0,489, р=0,049). Однако отсутствовала достоверная корреляция с уровнем глюкозы (р=0,321) и UA (р=0,467). Анализ взаимосвязей тех же лабораторных параметров с плотностью камня выявил достоверную положительную корреляцию с уровнем Са (rs=0,617, р=0,014) и отрицательную – с уровнем глюкозы (rs=-0,487, р=0,031), корреляция с уровнем ОХ (р=0,871) и UA (р=0,921) отсутствовала.
Липидный обмен
Дислипидемия диагностирована 31 (37,8%) пациенту. Длительность нарушения обмена в среднем составила 5,85 (от полугода до 12) года. Следует отметить, что ни один из пациентов постоянно не принимал антиатерогенную терапию и не соблюдал гипохолестериновую диету. У пациентов с нарушением липидного обмена чаще встречались рецидивные камни (табл. 3). Выявлена достоверная положительная корреляция между уровнем сывороточного Саобщ. и ОХ (rs=0,3315, р=0,0103). Условием для манифестации генетически детерминированной программы атеросклероза служит длительный дефицит Mg, при котором повышается уровень ОХ, ТГ, ЛПНП, активность ГМК-КОА-редуктазы, снижается уровень ЛПВП и активность протеинлипазы, лецитин-холестерол-аминотрансферазы [12]. Анализируя влияние магниемии на липидный профиль, мы выявили достоверную значимую связь между уровнями Mg и ТГ (rs=-0,2961, р=0,0405); Mg и ЛПВП (rs=0,3395, р=0,0320). Следовательно, можно сделать следующий вывод: низкий уровень сывороточного Mg как самостоятельно, так и через повышение атерогенных липидов может увеличивать риск нефролитиаза.
Нарушение углеводного обмена
Как и у пациентов с нарушением липидного обмена, у обследованных с нарушением углеводного обмена доминировали рецидивные камни (табл. 3). Среди них шестеро страдали сахарным диабетом (СД) 2 типа (СД2) (один впервые выявленным), трое – изменением гликемии натощак (один впервые выявленным), двое – впервые выявленным нарушением толерантности к глюкозе. Длительность нарушения углеводного обмена в среднем составила 9,12 (0–26) года. При анализе медицинской документации пациентов с впервые выявленными нарушениями сведений о гипергликемии за предыдущие годы не представлено, следовательно, они не принимали гипогликемическую терапию и не соблюдали диету. У пациентов с СД2 с уровнем гликированного гемоглобина выше целевых значений и с впервые выявленным заболеванием (54,6%, n=6) определен статистически более высокий уровень UA (р<0,001) и ЛПНП (р<0,001) по сравнению с пациентами с компенсированным углеводным обменом.
Пуриновый обмен
Нарушение пуринового обмена чаще встречалось среди пациентов с простыми и первичными камнями (табл. 3). В исследовании участвовали 8 (9,6%) пациентов с нарушениями пуринового обмена, из них пятерым ранее была диагностирована подагра, у троих повышение уровня UA сочеталось с таковым уровня Cr крови на момент исследования.
Нарушение фосфорно-кальциевого и магниевого обменов
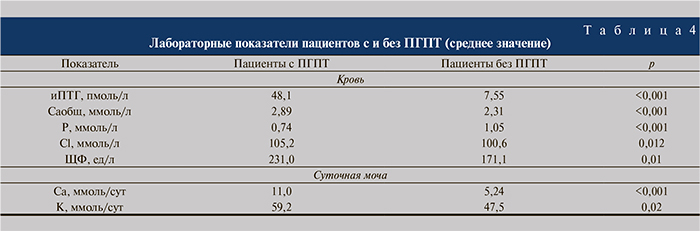
Нарушение фосфорно-кальциевого обмена выявлено у 43 (52,4%) пациентов, из них впервые выявленный первичный гиперпаратиреоз (ПГПТ) диагностирован 7 пациентам, вторичный гиперпаратиреоз (ВГПТ) – 35. У 1 пациентки гиперкальциемия оказалась проявлением остеолитического поражения костей (в анамнезе аденокарцинома тела матки), в связи с чем она была исключена из исследования. У пациентов с ПГПТ основные показатели фосфорно-кальциевого обмена достоверно отличались от таковых пациентов без ПГПТ (табл. 4).
Известно, что гиперкальциурия как один из главных факторов риска образования и рецидивирования МКБ чаще встречается среди пациентов с ПГПТ [7]. В нашем исследовании гиперкальциурию чаще выявляли у пациентов без ПГПТ, чем с ПГПТ – у 13 (17,3%) и 5 (71,4%) соответственно, однако по ее уровню группы не различались – 11,3 и 12,6 ммоль/сут. Двоим (28,6%) пациентам с ПГПТ диагностировали коралловидный нефролитиаз, остальным – простые камни. Встречаемость ПГПТ была выше в группе пациентов с рецидивными камнями (57,1%).

Анализируя данные, мы отметили сильную связь между уровнем кальциурии и магниурии (rs=0,6268, р=0,000002) у всех пациентов. После разделения пациентов на группы с/без ПГПТ достоверное влияние изменения уровня магниурии выявлено только у пациентов без ПГПТ (rs=0,6928, р=0,000009). Скорее всего, это указывает на снижение роли магния при наличии ПГПТ, поскольку при избытке паратиреоидного гормона повышение концентрации фильтруемого кальция (вследствие его усиленной мобилизации из костей) приводит к увеличению абсолютного количества кальция в моче, несмотря на повышение его фракционной реабсорбции.
У большинства (84,7%) пациентов, включенных в исследование, уровень 25(ОН)D соответствовал дефициту или недостаточности. Средний уровень 25(ОН)D у пациентов с гипокальциемией составил 12,7 нг/мл. Установлена положительная связь между уровнем кальция и витамина D (rs=0,4711, р=0,0359), отрицательная – между уровнем кальция и иПТГ (rs=-0,27002, р=0,0441). Компенсаторная гиперфункция околощитовидных желез (ВГПТ) диагностирована у 22,4% пациентов с гипокальциемией. Среди пациентов с коралловидными камнями ВГПТ встречалась в 31% наблюдений, с простыми камнями – в 69%. Встречаемость ВГПТ была практически одинаковой у пациентов как с первичными, так и с рецидивными камнями – 48,6 и 51,4% соответственно.
Дефицит витамина D, снижение всасывания кальция и увеличение синтеза ПТГ могут быть связаны также с уменьшением количества действующих нефронов при снижении функции почек. Однако различий в уровне креатинина у пациентов с ВГПТ и без него не выявлено (р=0,8047). Концентрация витамина D низка не только для пациентов с гипокальциемией, но и при дефиците Mg. Анализ данных выявил достоверную положительную связь между уровнем Mg и Саобщ (rs=0,2854, р=0,020), Mg и витамина D (rs=0,5199, р=0,039). Гипомагниемия диагностирована в 14,1% случаев, из них в 87,5% имели место коралловидные камни. Существует также достоверная положительная корреляция между уровнями сывороточного Mg и Cl (rs=0,431, р=0,014) и Саобщ и Cl (rs=0,615, р=0,0004), что указывает на вероятную роль хлора в развитии нефролитиаза. Для оценки влияния Mg на кальциемию и ПТГ пациенты без ПГПТ были разделены на три группы в зависимости от уровня магниемии (табл. 5). При мультифакторном анализе доказано, что группы достоверно различались по содержанию данного микроэлемента (р=0,0000). Проведенный анализ позволил выявить достоверную положительную корреляцию между уровнями кальциемии и магниемии только в первой группе (rs=0,6608, р=0,0193). В последней не выявлено никаких достоверных взаимосвязей между Mg и ПТГ, однако имела место зависимость между Саобщ и ПТГ (rs=0,6854, р=0,0014). В отличие от первой группы отрицательная корреляция выявлена между уровнем Mg и ПТГ во второй (rs=-0,5125, р=0,0147) и третьей (rs=-0,5565, р=0,0311) группах. Проведенный анализ показал, что низкий либо близкий к нижней границе референсных значений уровень кальция в крови в отличие от магния оказывает более сильное влияние на уровень ПТГ. Однако при нормальном уровне кальция в крови уже определяется влияние сывороточного магния на ПТГ.
Цитратурия, оксалатурия
Известно, что цитрат мочи ингибирует, а оксалат, наоборот, повышает риск кальцийоксалатного камнеобразования. Выявлено, что снижать экскрецию цитрата с мочой может дефицит калия [2]. В нашем исследовании мы не получили данных о достоверной взаимосвязи между уровнем сывороточного калия и цитратурией, однако у пациентов без ПГПТ выявлена отрицательная корреляция между кальциемией и цитратурией (rs=-0,6768, р=0,0315). Не получено достоверных различий при оценке уровня цитратурии (р=0,9468) и оксалатурии (р=0,1864) у пациентов с простыми и коралловидными камнями. Гипероксалатурия диагностирована в 45,6% случаев. Низкий уровень сывороточного кальция связан с повышенной оксалатурией (rs=-0,4270, р=0,0295), однако отсутствовала достоверная корреляция между уровнем 25(OH)D и оксалатов мочи (rs=0,021, р=0,877). При оценке встречаемости гипероксалатурии в зависимости от клинических форм МКБ выявлено, что при простых камнях она диагностируется у 39,6% пациентов, а при коралловидных камнях – у 57,2%. Показано значительное влияние натрийурии на экскрецию с мочой оксалатов (rs=0,6107, р=0,0001), ионов Mg (rs=0,4156, р=0,0096) и К (rs=0,5234, р=0,00005).

Заключение. Проведенный нами анализ показал, что гормонально-метаболические нарушения (углеводное, липидное, фосфорно-кальциевое, пуриновое) играют немаловажную роль в развитии нефролитиаза. При нарушениях углеводного, липидного и фосфорно-кальциевого обменов чаще встречались простые и рецидивные камни, а при нарушении пуринового обмена – простые и первичные (что может быть связано с малым числом пациентов). Встречаемость коралловидных камней не доминировала ни при каком из обменов, максимальным данный показатель был среди пациентов с нарушениями фосфорно-кальциевого обмена – 46,5%. При нарушениях фосфорно-кальциевого обмена у пациентов с простыми камнями ПГПТ и ВГПТ выявлялись чаще. При сочетании двух и более видов гормонально-метаболических нарушений увеличивается встречаемость простых и рецидивных камней (61,5%). При МКБ дефицит витамина D или диета, бедная кальцием, может приводить к повышенной оксалатурии с образованием оксалатных камней. Поступление кальция в организм должно быть адекватным, при недостаточности витамина D необходима коррекция его уровня для полноценного усвоения кальция. Исходя из вышесказанного, можно сделать вывод о важности профилактики и ранней коррекции нарушений гормонально-метаболического обмена, что позволит уменьшить риск камнеобразования и госпитализации по причине осложнений, связанных с ним.



