Введение. Распространенность стриктур мочеиспускательного канала поддается лишь приблизительной оценке. В США стриктуры уретры диагно-стируют у 0,6% мужского населения, они являются причиной более 5000 госпитализаций в год [1].
Мета-анализ данных литературы показал, что примерно треть стриктур передней уретры имеет ятрогенное происхождение и столько же идиопатические, 19 и 15% приходится на долю посттравматических и инфекционных стриктур соответственно [2].
 Внутренняя оптическая уретротомия и бужирование – малоинвазивные методики лечения, эффективны только при коротких первичных стриктурах, в основном луковичного отдела уретры. Успех лечения при использовании внутренней оптической уретротомии непосредственно после процедуры варьируется от 66 до 90%, однако отдаленные результаты указывают на постепенное снижение эффективности, что свидетельствует о нерадикальности метода. Риск возникновения рецидива возрастает при неадекватном предыдущем лечении, протяженных стриктурах (>2 см), при сложных (сочетанных) стриктурах как бульбозного, так и пенильного отдела, а также при наличии инфекции мочевых путей в предоперационном периоде [3–5].
Внутренняя оптическая уретротомия и бужирование – малоинвазивные методики лечения, эффективны только при коротких первичных стриктурах, в основном луковичного отдела уретры. Успех лечения при использовании внутренней оптической уретротомии непосредственно после процедуры варьируется от 66 до 90%, однако отдаленные результаты указывают на постепенное снижение эффективности, что свидетельствует о нерадикальности метода. Риск возникновения рецидива возрастает при неадекватном предыдущем лечении, протяженных стриктурах (>2 см), при сложных (сочетанных) стриктурах как бульбозного, так и пенильного отдела, а также при наличии инфекции мочевых путей в предоперационном периоде [3–5].
Поскольку представленные выше методы лечения не радикальны, предпочтение отдается различным видам уретропластик, как анастомотическим, так и с использованием трансплантатов или лоскутов. С конца ХХ в. широкое распространение получила буккальная уретропластика, имеющая ряд преимуществ перед различными кожными трансплантатами. Буккальная уретропластика применяется в том числе и при реконструкции коротких стриктур благодаря относительной простоте хирургической техники, надежности и хорошим результатам. Осложнения после буккальной уретропластики возникают редко. Послеоперационные осложнения могут проявиться в двух областях: в донорской зоне и в месте реконструкции уретры [6]. Потенциальными осложнениями в месте забора трансплантата могут быть следующие: кровотечение, боль, отек тканей лица, повреждение протока околоушной слюной железы (Stensen), парестезии, а также ограничение подвижности в височно-нижнечелюстном суставе. Отеки лица и ограничения подвижности в височно-нижнечелюстном суставе самостоятельно проходят в течение первых 3 мес и встречаются довольно редко [7–10]. Гнойные осложнения в области послеоперационной раны промежности, гематомы, нарушения кожной чувствительности регистрируют крайне редко [11–13].
 Толчком к развитию реконструктивной хирургии послужили достижения тканевой инженерии. Тканеинженерные конструкции, созданные из натурального или искусственного матрикса и аутологичных клеток пациента, могут быть использованы для лечения различных дефектов уретры. Находят применение матрицы как без клеток [14–23], так и с различными видами аутологичных клеток [24–27]. В частности, тубуляризированные тканеинженерные эквиваленты уретры, полученные на основе синтетической матрицы и аутологичных уроэпителиоцитов и гладкомышечных клеток мочевого пузыря, демонстрируют гистологические и функциональные характеристики, сходные со свойствами нативной уретры и обеспечивают нормальный пассаж мочи в течение не менее 6 лет наблюдений [28].
Толчком к развитию реконструктивной хирургии послужили достижения тканевой инженерии. Тканеинженерные конструкции, созданные из натурального или искусственного матрикса и аутологичных клеток пациента, могут быть использованы для лечения различных дефектов уретры. Находят применение матрицы как без клеток [14–23], так и с различными видами аутологичных клеток [24–27]. В частности, тубуляризированные тканеинженерные эквиваленты уретры, полученные на основе синтетической матрицы и аутологичных уроэпителиоцитов и гладкомышечных клеток мочевого пузыря, демонстрируют гистологические и функциональные характеристики, сходные со свойствами нативной уретры и обеспечивают нормальный пассаж мочи в течение не менее 6 лет наблюдений [28].
Таким образом, тканеинженерные конструкции могут стать альтернативным материалом для уретропластики. Это позволит избежать специфических осложнений в донорской зоне, а также решит вопрос дефицита тканей для реконструкции.
В настоящее время перед тканевой инженерией мочеиспускательного канала стоят следующие задачи:
- выбор оптимальной матрицы-носителя;
- выбор определенного вида аутологичных клеток;
- создание тканеинженерной конструкции для заместительной уретропластики;
- решение этических вопросов.
Цель настоящего исследования – получить децеллюляризированную матрицу из трупной артериальной стенки (ДМТАС), пригодную для заместительной уретропластики в эксперименте. Для достижения данной цели были поставлены следующие задачи:
- отработка технологии получения ДМТАС;
- оценка биосовместимости и биодеградации ДМТАС в эксперименте на крысах;
- оценка эффективности реконструкции дефекта уретры с использованием ДМТАС в эксперименте на кроликах.
Материалы и методы. Создание децеллюляризированной матрицы из трупной артериальной стенки. Выбор стенки артерии человека в качестве основы для создания тканеинженерной матрицы обусловлен тем фактом, что данный биологический материал с успехом использовался в сосудистой хирургии в качестве гомографта [29, 30]. Методика децеллюляризации. Изъятие трупного материала производили в соответствии с приказами № 483 МЗ СССР от 14.06.1972 и № 189 от 19.08.1993 в условиях морга в течение 24 ч после констатации смерти. Механически удаляли периартериальную клетчатку и фасциальный футляр, выделяли отходящие сосудистые ветви. Промывали водой (в течение 4 ч), физиологическим раствором (в течение 18 ч со сменой раствора каждые 6 ч), 1/15 М раствором двухзамещенного фосфата натрия (в течение 8 ч). Проводили ферментную обработку раствором террилитина при 40°С в течение 4 ч в фосфатном буфере с рН 7,5–8,0 и расходе фермента 15–25 ПЕ/г влажной ткани. Промывали водой в течение 1 ч и обрабатывали 1%-ным раствором лимонной кислоты в течение 1 ч; обрабатывали фосфатным буфером с рН 7,0–7,5 в течение 4 ч и промывали водой 4 ч.
Контроль децеллюляризации осуществляли морфологически по отсутствию клеток. Промытые сосуды подвергали отжиму салфетками для удаления избыточной влаги и упаковывали в двойной полимерный пакет: первый – из полиэтилена, второй – из дублированной пленки полиэтилен–фольга. Проводили радиационную стерилизацию (доза 2,5 Мрад).
Оценка биосовместимости и биодеградации матрицы на основе децеллюляризированной трупной артериальной стенки в эксперименте на крысах
Для оценки биосовместимости и биодеградации образцы ДМТАС размером 0,8×0,8 см (которые были предварительно разрезаны вдоль длинной оси сосуда, т.е. детубуляризированы) имплантировали подкожно в межлопаточную область белым лабораторным крысам (средняя масса тела – 350 г; рис. 1).
Имплантацию осуществляли под внутримышечным наркозом комбинацией следующих препаратов: золетил 100 (10 мг/кг)+ксилазин 2% (0,1 мл/кг)+атропин 0,1% (0,05 мг/кг). Использовали три типа ДМТАС: 1) на основе полнослойной стенки артерии; 2) с удаленной intima и внутренней третью media; 3) с удаленной адвентициальной оболочкой. Животных выводили из эксперимента на 7-е, 30, 60 и 90-е сутки после имплантации (по 3 животных на каждый срок). Область имплантации иссекали, а полученные образцы тканей направляли на гистологическое исследование.
Образцы тканей, предназначенные для морфологического исследования, фиксировали в 10%-ном растворе нейтрального формалина в течение 3 сут, проводили через серию спиртов возрастающей концентрации, заливали в парафин. Парафиновые срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону для выявления коллагеновых волокон, орсеином для выявления эластических волокон, комбинированной окраской коллагеновых и эластических волокон по методу Ван-Гизон–Унна, толуидиновым синим для выявления кислых гликозаминогликанов. Полученные микропрепараты изучали с использованием светового микроскопа OlympusBX51 («Olympus», Япония), оснащенного цифровой видеокамерой SDU-252 («Спецтелетехника», Россия), при увеличениях 40, 100, 200, 400.
Оценка эффективности реконструкции дефекта уретры с использованием трубчатой децеллюляризированной артериальной стенки в эксперименте на кроликах
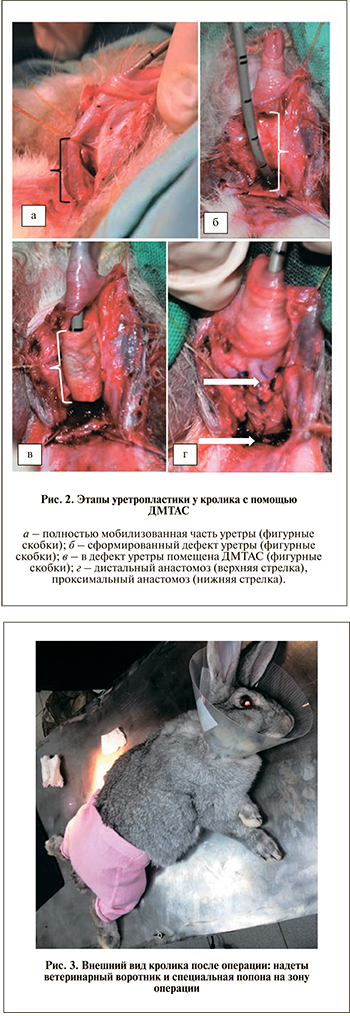
Эксперимент проводили на самцах кроликов 2–3-летнего возраста, средняя масса которых составляла 3,5 кг. Оперативное вмешательство осуществляли под внутримышечным наркозом по описанной выше методике. Проводили полную мобилизацию луковичной и проксимальной частей пенильной уретры кролика на протяжении 2,2–2,5 см (рис. 2, а). Фрагмент уретры протяженностью 1,8 см иссекался полностью (рис. 2, б). В ходе операции использовали окуляры операционные с увеличением 4,0×. Сформированный дефект уретры замещали трубчатой ДМТАС (рис. 2, в). Проксимальный и дистальный анастомозы между культями уретры и концами трубчатой ДМТАС формировали путем наложения узловых швов из монофиламентного нерассасывающегося шовного материала пролен 5–0 (рис. 2, г).
Дренирование мочевого пузыря осуществляли силиконовым уретральным катетером Фолея № 6Сh в течение 7–10 дней после операции. Во избежание самостоятельного удаления катетера в послеоперационном периоде кроликам надевали специальный ветеринарный воротник и фиксировали попону на зону операции (рис. 3).
За 30 мин до операции, а также на весь период дренирования мочевого пузыря уретральным катетером назначали энрофлоксацин 50 по 5 мг/кг 1 раз в день. Животных выводили из эксперимента на 7-е, 14, 30, 90, 180-е сутки после операции (по 3 кролика на каждый срок) путем создания двустороннего пневмоторакса под внутримышечным наркозом с использованием представленных выше препаратов. Ретроградную уретроцистографию выполняли через 30, 90 и 180 дней после операции под внутримышечным наркозом по методике, описанной выше. На головку полового члена кролика предварительно накладывали провизорную лигатуру (Vicryl 4–0); в наружное отверстие уретры вводили торцевой мочеточниковый катетер с оливовидным расширением № 8 Сh, по которому ретроградно вводили до 20 мл 38%-ного раствора урографина.
Морфологическое исследование проводили по описанной выше методике.
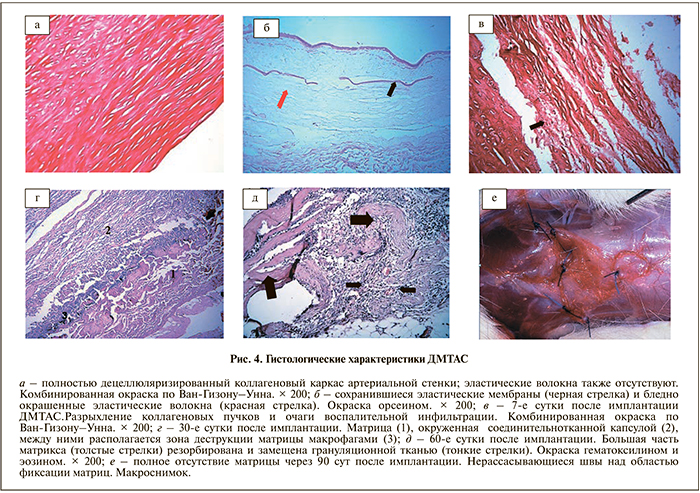
Результаты. Создание децеллюляризированной матрицы из трупной артериальной стенки. Макроскопически сразу после децеллюляризации стенка артерии выглядела разрыхленной. При микроскопическом исследовании ДМТАС представляла собой местами разрыхленный, местами плотный (рис. 4, а) коллагеновый каркас стенки артерии. Клетки в артериальной стенке отсутствовали, а из структур эластической сети частично сохранялись лишь внутренняя и наружная эластические мембраны артерии и отдельные слабоокрашенные эла-стические волокна медии средней оболочки (рис. 4, б).
Оценка биосовместимости и биодеградации матрицы на основе трупной артериальной стенки в эксперименте на крысах
На 7-е сутки после имплантации в ДМТАС усиливалось разрыхление коллагеновых пучков вследствие отека ткани, а также выявлялись мелкие очаги воспалительной инфильтрации (рис. 4, в). Соединительнотканная капсула вокруг ДМТАС к этому сроку еще не сформировывалась, но в окружающей ткани отмечалась слабая лимфомакрофагальная реакция с небольшой примесью нейтрофильных лейкоцитов. На 30-е сутки отмечалось формирование соединительнотканных капсул вокруг ДМТАС, появлялись признаки частичной биодеградации наружных слоев имплантата (рис. 4, г), что выражалось в макрофагальной резорбции наружных слоев имплантата (бывшей адвентициальной оболочки сосуда).
К 60-м суткам продолжалась постепенная деструкция ДМТАС. При этом оставался лишь тонкий фрагмент имплантата, инфильтрированного макрофагами и лимфоцитами (рис. 4, д), тогда как большая часть имплантата к тому времени была резорбирована. На 90-е сутки почти во всех случаях наблюдалась полная резорбция имплантатов (рис. 4, е).
Различие между группами, в которых были использованы трансплантаты артерии с предварительно удаленным внутренним или наружным слоем сосудистой стенки и полнослойные ДМТАС, были незначительными: отмечалась лишь ускоренная резорбция имплантата с удаленной адвентициальной оболочкой.
Полученные данные свидетельствуют об очень слабой биоактивности ДМТАС вследствие низкой иммуногенности материала. При этом резорбция материала идет в течение довольно длительного периода (до 60–90 сут).
Оценка эффективности реконструкции дефекта уретры с использованием трубчатой децеллюляризированной артериальной стенки в эксперименте на кроликах
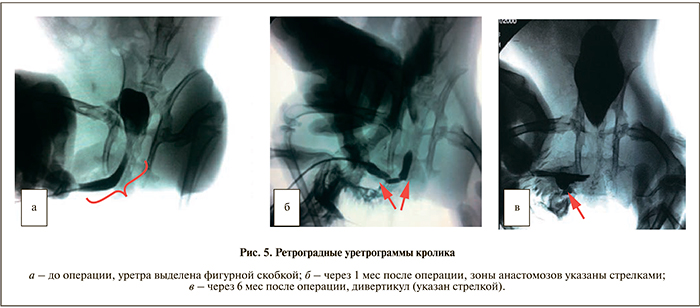
Ретроградную уретроцистографию по описанной выше методике выполняли после удаления уретрального катетера спустя 1, 3 и 6 мес после операции. Полученные уретрограммы сравнивали с предоперационной уретрограммой (рис. 5, а). На уретрограммах через 1 мес после операции хорошо видна зона имплантации ДМТАС, затеков контрастного вещества не было (что свидетельствует о полном приживлении матрицы), просвет уретры полностью сохранен (рис. 5, б). В сроки 1 и 3 мес уретрограммы значимо не отличались друг от друга. Через 6 мес после операции просвет уретры также сохранен, однако отмечалось формирование дивертикула в зоне имплантации ДМТАС (рис. 5, в).
Самостоятельное мочеиспускание восстановилось у всех животных после удаления катетера и сохранялось до конца наблюдения. Признаков облитерации просвета уретры не обнаружено.
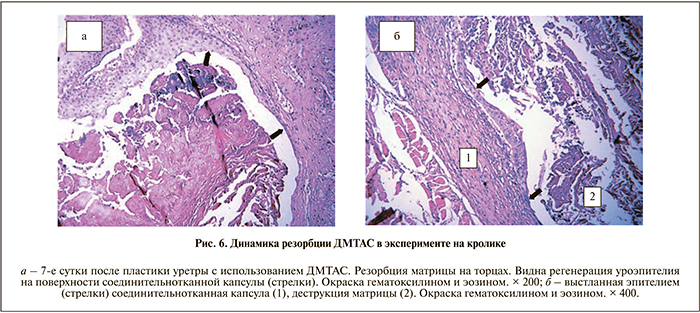
Морфологическое исследование показало, что ДМТАС представляет собой бесклеточный коллагеновый каркас артерии. Биодеградация ДМТАС к 10–30-м
суткам после операции незначительна и отмечалась только на торцах протеза (рис. 6, а). К 30-м суткам вокруг имплантата формировалась соединительнотканная капсула, чаще всего отделенная небольшой щелью от его наружной поверхности. Начиная с 10-х суток после операции со стороны резидентных (нативных) тканей уретры наблюдался постепенный рост эпителиального пласта, который по своим характеристикам соответствует уроэпителию (рис. 6, а). Рост уроэпителия продолжался до 60-х суток до полной эндотелизации внутренней поверхности капсулы (рис. 6, б). Только к 60-м суткам ДМТАС подвергалась деструкции и клеточной инфильтрации, а капсула протеза приобретала морфологические черты слизистой оболочки уретры (см. рис. 6, б).
Выводы
- Коллагеновая матрица на основе децеллюляризированной трупной артерии человека обладает низкой биологической активностью и безопасна в качестве материала для заместительной уретропластики.
- В эксперименте на крысах биодеградация сосудистой матрицы (ДМТАС) наступает в течение 60–90 сут.
- В эксперименте на кроликах при пластике уретры сосудистой матрицей (ДМТАС) была выявлена медленная деструкция матрицы и прогрессирующая эпителизация соединительнотканной капсулы.
- Использование ДМТАС в качестве материала для заместительной уретропластики в эксперименте на кроликах показало хороший структурный и функциональный результат.
Заключение
Регенеративная медицина в общем и тканевая инженерия в частности интенсивно развиваются. Различные матрицы и тканеинженерные конструкции уже используются для заместительной уретропластики как в эксперименте на животных, так и в клинических исследованиях.
Разработанная нами децеллюляризированная матрица из трупной артериальной стенки проявила свойства, которые позволяют рассматривать ее в качестве материала для заместительной уретропластики: низкая биологическая активность, приемлемые сроки биодеградации (60–90 суток). Трубчатая ДМТАС позволяет поддерживать просвет уретры при заместительной уретропластики у кролика в течение всего срока наблюдения (6 месяцев).
Дальнейшие шаги могут быть направлены в сторону создания тканеинженерной конструкции, состоящей из данной матрицы и аутологичных клеток пациента. Успешная реализация этой задачи позволит оценить возможность выполнения тканеинженерной уретропластики пациенту при соблюдении этических принципов.
Авторы благодарят за помощь в работе над проектом зав. виварием А. В. Лузина, зав. каф. оперативной хирургии и топографической анатомии проф.
С. С. Дыдыкина, зав. каф. иностранных языков И. Ю. Марковину, начальника отдела клинических исследований И. И. Ермолаеву, председателя независимого этического комитета проф.
Д. А. Балалыкина, независимых экспертов: проф. Н. А. Григорьева и проф. Е. А. Безрукова.
Исследования выполнены при поддержке грантов РФФИ № 13-02-01363 и 13-04-12075.



