Введение. Патологические сужения просвета мочеиспускательного канала, или стриктуры, вызванные фиброзными изменениями субэпителиальных структур спонгиозного тела или окружающих тканей [1, 2], приводят к нарушению оттока мочи, вызывая развитие ряда вторичных изменений урогенитального тракта [3]. Распространенность стриктур уретры зависит от возраста и, по разным оценкам, варьируется от 0,01 до 0,9% мужского населения [1, 4]. Заболеваемость стриктурами уретры в развитых странах может достигать 9 случаев на 1000 лиц мужского пола [4], что обусловливает более 5000 госпитализаций в год [5]. По данным мета-анализа [6], ведущей причиной (33%) развития стриктур передней уретры является ятрогенное повреждение во время медицинских процедур (катетеризация, эндоскопические пособия и т.д.). Второй по распространенности (19%) причиной служит повреждение уретры вследствие травмы (ДТП, падение на промежность и т.д.); третьей (15%) – инфекции (например, гонорейный уретрит).
Оптическая уретротомия и бужирование являются малоинвазивными методами лечения. Вместе с тем выполнение данных процедур оправданно только при коротких первичных стриктурах, преимущественно луковичного отдела уретры. Эффективность оптической уретротомии в таких случаях может достигать 66–90% в краткосрочной перспективе, однако в отдаленном периоде отмечается существенное ухудшение результатов вмешательства, что свидетельствует о нерадикальности метода [7–9].
С учетом вышесказанного предпочтение отдается различным видам уретропластик, как анастомотическим, так и заместительным (с использованием трансплантатов или лоскутов). В последнее время наиболее широко используемым материалом для заместительной уретропластики является слизистая оболочка щеки [10, 11], которая обладает рядом преимуществ по сравнению с другими трансплантатами и лоскутами. Буккальная уретропластика применяется при стриктурах любой протяженности, множественных стриктурах, в том числе при рецидивных стриктурах. При относительной простоте хирургической техники данный метод позволяет добиваться надежных и хороших результатов подавляющему большинству пациентов [12–15]. Послеоперационные осложнения могут проявляться в двух областях: в донорской зоне и в месте реконструкции уретры [16]. Гнойные воспаления в области послеоперационной раны промежности, гематомы, нарушение кожной чувствительности регистрируются крайне редко [17–19]. Потенциальными осложнениями в месте забора трансплантата могут быть кровотечение, боль, отек тканей лица, повреждение протока околоушной слюной железы (Stensen), парестезии, а также ограничение подвижности в височно-нижнечелюстном суставе. Отеки лица и ограничения подвижности в височно-нижнечелюстном суставе самостоятельно проходят в течение первых 3 мес и встречаются довольно редко [10, 20–22].
 Несмотря на указанные достоинства слизистой оболочки щеки, остается нерешенным ряд вопросов. Во-первых, необходимость получения любого трансплантата в той или иной степени сопряжена с морбидностью в донорской зоне. Даже если эта морбидность низкая или крайне низкая, она всё же присутствует и оказывает отрицательное влияние на состояние пациента. Выраженность данного влияния напрямую зависит от размеров донорской зоны. Во-вторых, протяженные стриктуры уретры требуют забора графтов (трансплантатов) из нескольких донорских участков. Это существенно увеличивает время хирургического вмешательства, а следовательно, и риск интра- и послеоперационных осложнений [23]. В-третьих, при повторных заместительных уретропластиках (в случаях рецидивов стриктуры) забор слизистой оболочки ротовой полости может быть затруднен, что диктует необходимость поиска дополнительного материала для субституции. Аналогичная ситуация возникает во время первого этапа двухэтапных уретропластик, когда требуется эпителизация уретрального ложа. Указанные выше проблемы свидетельствуют об отсутствии в настоящее время идеального материала для заместительной уретропластики, что обосновывает целесообразность его (материала) поиска.
Несмотря на указанные достоинства слизистой оболочки щеки, остается нерешенным ряд вопросов. Во-первых, необходимость получения любого трансплантата в той или иной степени сопряжена с морбидностью в донорской зоне. Даже если эта морбидность низкая или крайне низкая, она всё же присутствует и оказывает отрицательное влияние на состояние пациента. Выраженность данного влияния напрямую зависит от размеров донорской зоны. Во-вторых, протяженные стриктуры уретры требуют забора графтов (трансплантатов) из нескольких донорских участков. Это существенно увеличивает время хирургического вмешательства, а следовательно, и риск интра- и послеоперационных осложнений [23]. В-третьих, при повторных заместительных уретропластиках (в случаях рецидивов стриктуры) забор слизистой оболочки ротовой полости может быть затруднен, что диктует необходимость поиска дополнительного материала для субституции. Аналогичная ситуация возникает во время первого этапа двухэтапных уретропластик, когда требуется эпителизация уретрального ложа. Указанные выше проблемы свидетельствуют об отсутствии в настоящее время идеального материала для заместительной уретропластики, что обосновывает целесообразность его (материала) поиска.
Тканевая инженерия открыла новые перспективы для реконструктивной хирургии, одной из областей применения которой является уретропластика.
В регенеративной урологии используются как матрицы без клеток [24–34], так и матрицы (матриксы, скаффолды) с различными видами аутологичных клеток [35–38], или тканеинженерные конструкции. Разработка оптимальной тканеинженерной конструкции (матрица+клетки, получаемые неинвазивным путем [39, 40]) позволит свести к нулю морбидность в донорской зоне, решит проблему нехватки материала для заместительной уретропластики (даже при протяженных и/или рецидивных стриктурах уретры), а также сократит длительность операции, что обеспечит снижение риска интра- и послеоперационных осложнений.
Одним из критериев успешной реализации тканеинженерной уретропластики считается наличие матрицы, обладающей оптимальными биомеханическими свойствами. В нашей предыдущей работе мы исследовали свойства тканеинженерной конструкции на основе децеллюляризированной артериальной стенки и эпителиоцитов слизистой оболочки щеки. Децеллюляризированная артериальная стенка обладает рядом положительных свойств [41, 42], а именно низкой иммуногенностью, цитотоксичностью и хорошими механическими свойствами. В то же время в ходе исследования был выявлен и ряд недостатков: существенная вариация сроков биодеградации, изменение толщины матрицы в зависимости от возраста и соматического статуса донора, ограниченная способность к клеточной адгезии, затрудненный ангиогенез ввиду высокой плотности матрицы, отсутствие роста нативного уротелия со стороны окружающих тканей, а также способность индуцировать выраженный рубцово-склеротический процесс в зоне имплантации.
 Все это послужило стимулом для создания матрицы, лишенной указанных выше недостатков. Усилия были сфокусированы на получении гибридной (композитной) матрицы, которая позволила бы объединить положительные свойства как натуральных, так и синтетических материалов.
Все это послужило стимулом для создания матрицы, лишенной указанных выше недостатков. Усилия были сфокусированы на получении гибридной (композитной) матрицы, которая позволила бы объединить положительные свойства как натуральных, так и синтетических материалов.
Несущую основу новой гибридной матрицы составляет сетка из полилактогликолида, которая характеризуется постоянством сроков биодеградации, стабильностью и воспроизводимостью механических свойств, низкой иммуногенностью и высокой биосовместимостью [43–45]. При этом относительно большое расстояние между волокнами сетки создает трудности для засеивания сетки клетками. С целью оптимизации условий для роста сосудов и адгезии клеток предложено покрывать матрицу с двух сторон реконструированным коллагеном, который является хорошей матрицей для роста на нем клеток, а также способен усиливать пролиферацию собственных фибробластов и биосинтез ими коллагена [46].
В предыдущем исследовании [47] мы в экспериментах на крысах выявили биосовместимость новой матрицы и особенности ее биорезорбции.
Цель настоящего исследования — получить гибридную матрицу на основе сетки из полилактогликолида и реконструированного коллагена, пригодную для заместительной уретропластики в эксперименте, а также создать тканеинженерную конструкцию на основе данной матрицы.
Для достижения этой цели были поставлены следующие задачи:
- разработать технологию получения гибридной матрицы;
- оценить цитотоксичность матрицы, а также адгезию и пролиферацию линейных фибробластов 3Т3 и С3Н на матрице;
- оценить биосовместимость и биодеградацию данной матрицы в эксперименте на крысах;
- оценить эффективность реконструкции дефекта уретры с использованием гибридной матрицы в эксперименте на кроликах.
Материалы и методы. Создание гибридной матрицы на основе сетки из полилактогликолида и реконструированного коллагена
 Мы разработали авторскую методику получения гибридной матрицы, предусматривающую получение коллагена с сохраненной трехспиральной структурой и совмещение его с сеткой из полилактогликолида. Коллаген извлекали из дермы крупного рогатого скота. Кусочки дермы обрабатывали раствором пепсина, тщательно отмывали, измельчали и растворяли в растворе уксусной кислоты. Полученный таким образом раствор коллагена разливали в кюветы. Между двумя слоями коллагена помещали сетку из полилактогликолида (VICRYL® (polyglactin 910) Woven Mesh, Ethicon, «Johnson & Johnson»). Полученный гибридный материал замораживали, высушивали сублимационно до остаточной влажности 30% и прессовали до получения необходимой толщины. Для увеличения механической прочности путем поперечного сшивания молекул коллагена гибридный материал помещали в пары формалина, после чего проветривали и отмывали от остатков формалина до отрицательной реакции на присутствие альдегидов и проводили повторную сублимацию, а затем разрезали на фрагменты размером 1×1 см (для эксперимента на крысах) и 1×2 см (для эксперимента на кроликах), упаковывали в индивидуальные полиэтиленовые пакеты и стерилизовали γ-излучением (доза 2,5 Мрад).
Мы разработали авторскую методику получения гибридной матрицы, предусматривающую получение коллагена с сохраненной трехспиральной структурой и совмещение его с сеткой из полилактогликолида. Коллаген извлекали из дермы крупного рогатого скота. Кусочки дермы обрабатывали раствором пепсина, тщательно отмывали, измельчали и растворяли в растворе уксусной кислоты. Полученный таким образом раствор коллагена разливали в кюветы. Между двумя слоями коллагена помещали сетку из полилактогликолида (VICRYL® (polyglactin 910) Woven Mesh, Ethicon, «Johnson & Johnson»). Полученный гибридный материал замораживали, высушивали сублимационно до остаточной влажности 30% и прессовали до получения необходимой толщины. Для увеличения механической прочности путем поперечного сшивания молекул коллагена гибридный материал помещали в пары формалина, после чего проветривали и отмывали от остатков формалина до отрицательной реакции на присутствие альдегидов и проводили повторную сублимацию, а затем разрезали на фрагменты размером 1×1 см (для эксперимента на крысах) и 1×2 см (для эксперимента на кроликах), упаковывали в индивидуальные полиэтиленовые пакеты и стерилизовали γ-излучением (доза 2,5 Мрад).
Таким образом, гибридная матрица представляла собой стерильные фрагменты материала на основе сетки из полилактогликолида и реконструированного коллагена дермы крупного рогатого скота.
Оценка цитотоксичности матрицы, адгезии и пролиферации клеток
Оценку цитотоксичности проводили по оптимизированному методу Мосмана и Монкса (МТТ-тест) на 6-е сутки культивирования с применением линий клеток 3T3 и C3H и с использованием методов световой микроскопии.
После разморозки культур линейных клеток культивирование проводили в полной питательной (ростовой) среде DMEM/F12 («Invitrogen», США), содержащей 10% телячьей фетальной сыворотки (HyClone Defined, «HyClone», США), инсулин 0,4 мкМ и 0,25 мг/л гентамицина в количестве 2,0–2,5 млн кл/мл в культуральных флаконах 175 см2 («Corning», США). Культивирование осуществляли в стандартных условиях в СО2-инкубаторе с концентрацией СО2 5%, атмосферного воздуха 95% и с повышенной влажностью. Замену культуральной среды на свежую осуществляли каждые 72 ч. Образцы матриц нарезали на фрагменты площадью 2 см2 и помещали в 12-луночный планшет. Плотность посева составляла для 3Т3 3 ∙ 104 клеток на 1 см2 и для С3Н 7∙104 клеток на 1 см2 (25% от монослоя). Время культивирования клеток на матрицах составляло 6 сут, после чего проводили реакцию с 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромидом (МТТ) и инкубировали 4 ч. Интенсивно окрашенные кристаллы формазана, образующиеся в результате метаболической активности жизнеспособных клеток, растворяли в диметилсульфоксиде и определяли оптическую плотность одинаковых объемов растворов в 96-луночном планшете с помощью спектрофотометра (Мultiscan FC, «Thermo Scientific») при длине волны 540 нм.
Световую микроскопию проводили на микроскопе Nikon TE-2000 при увеличении ×40, ×60, ×100, ×200, ×400 с фазовым контрастом для оценки контрольных лунок и визуализации клеток, находившихся по краю матрицы.
Оценку адгезии и пролиферации клеток на гибридной матрице проводили с использованием тех же линейных фибробластов 3Т3 и С3Н и с той же плотностью посева, как при оценке цитотоксичности. Для визуализации клеток применяли двойную окраску акридиновым оранжевым и этидиумом бромидом.
Стоковый раствор красителей готовили следующим образом: 1,5 мг акридинового оранжевого и 5 мг этидиума бромида растворяли в 0,1 мл 95%-ного этанола, затем добавляли 5 мл дистиллированной воды. Рабочий раствор красителей готовили из стокового путем растворения в 100-кратном объеме PBS. Для окрашивания образцы, предварительно отмытые от среды для культивирования, заливали рабочим раствором красителей на 5 мин. В результате происходило окрашивание живых клеток акридиновым оранжевым, а мертвых – этидиумом бромидом.
Локализацию флуоресценции образцов матрикса фиксировали с помощью лазерного сканирующего конфокального микроскопа LSM-710 («Carl Zeiss Microscopy», Германия). Окрашенные образцы из чашек для культивирования in vitro переносили на стерильные чашки Петри с тонким стеклянным дном толщиной 0,16 мм в растворе PBS. Для получения изображений использовали объектив EC Plan-Neofluar 10×/0.3/М27. Возбуждение флуоресцентного акридинового оранжевого производили лазером с длиной волны 488 нм, регистрировали флуоресценцию в диапазоне 495–545 нм. Возбуждение флуоресцентного этидиума бромида производили лазером с длиной волны 561 нм, регистрировали флуоресценцию в диапазоне 580–690 нм. В результате получали наложение флуоресцентных изображений локализаций акридинового оранжевого (зеленый цвет), этидиума бромида (красный цвет) и изображения, полученного в режиме проходящего света.
Протезирование уретры
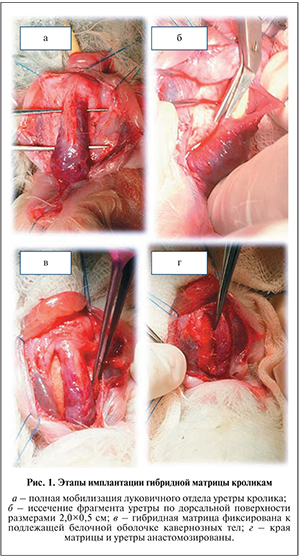
Эксперимент проводили на 12 самцах кроликов 2-летнего возраста, средняя масса которых составила 3,5 кг. Перед операцией выполняли ретроградную уретрографию. Оперативное вмешательство осуществляли под общим наркозом по методике, описанной ранее [41]. Проводили полную мобилизацию луковичной и проксимальной части пенильной уретры кролика на протяжении 2,2–2,5 см (рис. 1, а). Полностью иссекали фрагмент уретры по ее дорсальной поверхности размером 2,0×0,5 см (рис. 1, б). Матрицу фиксировали к вентральной поверхности белочной оболочки пещеристых тел одиночными узловыми швами викрил 5–0 по краям и в центре (рис. 1, в). Сформированный дефект уретры замещали образцом гибридной матрицы, размеры которой после адаптации под уретральное ложе составляли 2,0×0,5 см. Края матрицы сшивали с краями уретры в зоне дефекта непрерывным швом, используя викрил 5–0 (рис. 1, г).
Дренирование мочевого пузыря осуществляли силиконовым уретральным катетером Фолея № 6Сh в течение 5–7 дней после операции. Во избежание самостоятельного удаления катетера в послеоперационном периоде кроликам надевали специальный ветеринарный воротник и послеоперационную попону. За 30 мин до операции, а также на весь период дренирования мочевого пузыря уретральным катетером назначали энрофлоксацин по 5 мг/кг 1 раз в день. Животных выводили из эксперимента на 7-е, 30, 60, 90-е сутки после операции (по 3 кролика на каждую временную точку) путем передозировки средств для наркоза. В день выведения животных из эксперимента выполняли ретроградную уретрографию.

Морфологическое исследование
Для морфологического исследования образцы тканей фиксировали не менее 48 ч в 10%-ном растворе нейтрального забуференного формалина («Biovitrum», Россия), проводили через серию спиртов восходящей концентрации, заливали в парафин. Микротомные срезы толщиной 5–6 мкм тщательно депарафинировали и окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону (для выявления коллагена), фукселином по Унна (для выявления эластических волокон), толуидиновым синим (для выявления кислых гликозаминогликанов). Кроме того, для одновременного выявления различных тканевых компонентов использовали многоцветное окрашивание по Маллори.
Изучение гистологических препаратов выполняли с помощью прямого светового микроскопа исследовательского класса Olympus BX51 («Olympus», Япония), оснащенного цветной цифровой камерой SDU-252 («Спецтелетехника», Россия) при оптическом увеличении от ×40 до ×1000.
Результаты.
Оценка цитотоксичности, адгезии и пролиферации клеток
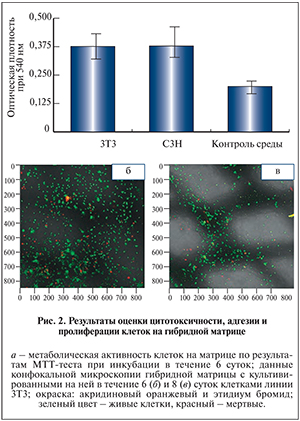
МТТ-тестирование показало отсутствие токсичности исследуемых образцов матрицы при использовании культур линейных фибробластов 3Т3 и С3Н (рис. 2, а).
Адгезия и пролиферация клеток отмечены на всех исследуемых образцах матрицы, при этом значительно преобладали клетки с высокой жизнеспособностью (рис. 2, б, в).
Таким образом, клетки линий 3Т3 и C3H адгезируются и пролиферируют на исследуемой гибридной матрице, что позволяет рассматривать такие материалы в качестве эффективных носителей клеток и предполагает их возможное использование в качестве каркаса для тканеинженерной конструкции.
Оценка эффективности реконструкции дефекта уретры
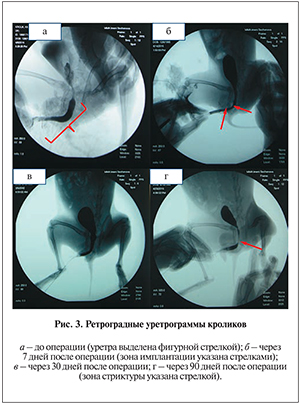
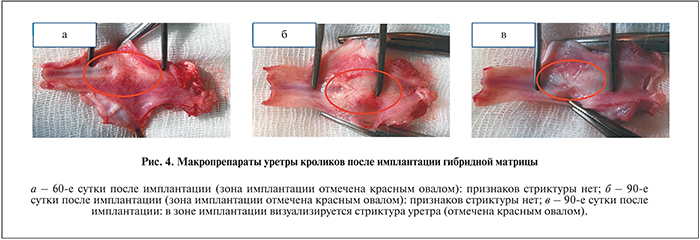
Ретроградную уретроцистографию по описанной выше методике выполняли после удаления уретрального катетера на 10-е, 30, 60 и 90-е сутки после операции. Полученные уретрограммы сравнивали с предоперационными. На уретрограммах через 7, 30 и 60 сут после операции зона имплантации матрицы не определялась, затеков контрастного вещества не обнаружено (что свидетельствует о хорошем функциональном результате), просвет уретры полностью сохранен. Лишь у одного кролика из 12 на 90-е сутки выявлена стриктура уретры, по данным как уретроцистографии, так и аутопсии (рис. 3, 4).
Самостоятельное мочеиспускание восстановилось у всех животных после удаления катетера и сохранялось до конца наблюдения. Облитерации уретры, образования мочевых свищей не наблюдалось.
Морфологическое исследование
Макроскопически матрица выглядит довольно плотной, хорошо держит форму, оставаясь при этом достаточно гибкой, не теряет форму при длительном нахождении в воде.
При гистологическом изучении на 7-е сутки стенка интактной уретры (вне протеза) имела обычную структуру, состояла из переходного эпителия (уротелия), собственной пластинки слизистой оболочки, подслизистой основы, относительно толстого слоя плотной соединительной ткани, мышечного слоя и кавернозного тела (рис. 5).
В области протезирования на стороне, обращенной к просвету уретры, обнаруживались нити сетки из полилактогликолида, причем каждая нить состояла из тонких филаментов (см. рис. 5, а). Внутри сетки из полилактогликолида видны отложения фибрина, скопления нейтрофилов, большей частью разрушенных, и макрофагов. Среди фибрина местами видны остатки коллагеновой губки в виде фуксинофильных (при окраске пикрофуксином по Ван-Гизону) волокнистых структур. К тому сроку губка (реконструированный коллаген) была почти полностью резорбирована, кроме отдельных элементов на внутренней стороне протеза.
Следует отметить, что нити полилактогликолида также были инфильтрированы фибрином и нейтрофилами с проникновением их между филаментами. Среди этого инфильтрата в нитях обнаруживались макрофаги и единичные гигантские клетки инородных тел (см. рис. 5, б). Резорбции филаментов на этом сроке не определялось. Местами отмечено образование грануляционной ткани снаружи от слоя фибрина. Эта грануляционная ткань состояла из многочисленных кровеносных сосудов капиллярного типа, тяжей фибробластов (см. рис. 5, в) и фуксинофильных по Ван-Гизону коллагеновых волокон (см. рис. 5, г).
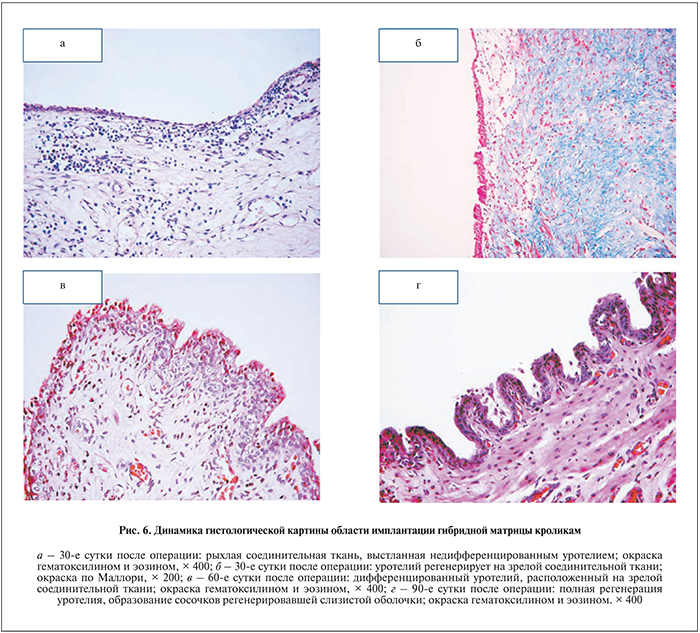
На 30-е сутки имплантированный материал не обнаружен. Большая часть внутренней поверхности (за исключением середины) бывшего протеза к этому сроку была выстлана переходным недифференцированным уротелием. Этот эпителий располагался на рыхлой соединительной ткани, богатой сосудами, с очагами инфильтрации лимфоцитами и макрофагами. Новообразованная соединительная ткань была близкой к структуре собственной пластинки слизи стой оболочки в интактной уретре (рис. 6, а).
У одного животного эпителий был более зрелым, а подлежащая соединительная ткань также имела зрелый характер: больше коллагеновых волокон, окрашивающихся в красный цвет по Ван-Гизону и в синий цвет по Маллори (рис. 6, б).
На 60-е сутки степень дифференцировки эпителия, выстилающего новообразованную внутреннюю поверхность стенки уретры, сформировавшейся на месте имплантированной матрицы, была более выраженной по сравнению с 30-ми сутки: он имел типичную для уротелия многорядную структуру, но базальная мембрана местами была еще недостаточно дифференцирована. Подлежащая соединительная ткань близка по структуре к интактной собственной пластинке слизистой оболочки уретры (рис. 6, в).
На 90-е сутки уротелий приобретал структуру, не отличимую от нативной: с полностью восстановленной базальной мембраной; регенерировавшая слизистая оболочка формировала четко видимые сосочки (рис. 6, г). Новообразованная слизистая практически не отличалась от слизистой оболочки интактной уретры, причем она была прочно соединена с мышечной оболочкой и кавернозным телом.
Заключение. Основной целью данного исследования было создание гибридной матрицы, которую можно было бы эффективно использовать при заместительной уретропластике в эксперименте. Результаты исследования показывают, что цель достигнута. Использование сетки из полилактогликолида и реконструированного коллагена позволяет создавать стабильную и функциональную композитную конструкцию. Полученная гибридная матрица не проявляет цитотоксических свойств, клетки на ее поверхности активно прикрепляются, а затем пролиферируют. В процессе биодеградации матрица замещается структурно и функционально полноценными новообразованными тканями уротелия и слизистой оболочки мочеиспускательного канала. В эксперименте было использовано 12 кроликов, и лишь у одного из них отмечено формирование стриктуры уретры в месте имплантации матрицы.
Все вышесказанное позволяет рассматривать созданную гибридную матрицу как потенциальный материал для тканеинженерной конструкции с последующим применением при заместительной уретропластике у человека.
Таким образом:
- Разработан метод получения гибридной тканеинженерной матрицы на основе сетки из полилактогликолида и реконструированного коллагена, обладающей достаточной механической прочностью, стабильностью в биологических жидкостях, не вызывающей цитотоксических реакций и поддерживающей адгезию и пролиферацию клеток;
- Указанные выше свойства позволяют рассматривать гибридную матрицу в качестве эффективного носителя клеток с последующим возможным применением в качестве каркаса для создания тканеинженерных конструкций;
- Заместительная уретропластика с использованием гибридной матрицы обеспечивает структурную и функциональную регенерацию уротелия и слизистой оболочки уретры, а также интеграцию регенерировавшей ткани с окружающими анатомическими элементами, кавернозным телом и мышечной оболочкой. В процессе заместительной регенерации гибридная матрица активно прорастает кровеносными сосудами и обеспечивает поддержку формирования компонентов стенки уретры;
- Биодеградация гибридной матрицы наступает в срок до 30 дней;
- Развитие стриктуры уретры в области проведенного вмешательства отмечено только у 1 (8%) из 12 кроликов через 90 дней после операции.
Благодарность
Исследования выполнены при поддержке грантов РФФИ № 13-02-01363 (оценка цитотоксичности матрицы), РФФИ № 13-04-12075 (оценка адгезии и пролиферации линейных фибробластов 3Т3 и С3Н на матрице) и РНФ № 15-15-00132 (способ формирования гибридной матрицы, оценка ее биосовместимости in vivo в экспериментах с малыми лабораторными животными).



